TGFβ1/smad7信号通路在大鼠肝纤维化发生中的活化及意义*
2015-11-10余晓红郑颖娟吕宏迪杨廷桐
余晓红,郑颖娟,吕宏迪,杨 旸,杨廷桐
肝纤维化是由多种原因引起肝小叶结构破坏和细胞外基质(extracellular matrixc,ECM)过度沉积的结果,寻求防治肝纤维化已经成为当前医学界的重中之重。因此深入研究探讨诱导ECM沉积的原因,阻断这个过程,可能成为临床上预防肝硬化重要的环节。转化生长因子 β1(transforming growth factor-β,TGF-β1)/Smad7 通路具有刺激成纤维细胞增生,促进组织器官纤维化形成等作用,但其在肝纤维化发生中的机制尚不清楚,国内外尚少见研究报道,因此深入研究TGF-β1/smad7信号传导通路在肝纤维化中激活与作用,对于阐明肝纤维化发病机制意义重大。并可对临床上防治肝的纤维化提供新的思路。
1 材料与方法
1.1 材料
1.1.1 药品及试剂 CCl4(天津市北宏试剂厂),TGF-β1、Smad3、Smad7 (北京中生物技术有限公司),RT-PCR试剂盒及相关试剂 (北京赛百盛公司)。
1.1.2 动物 健康清洁级 Wistar大鼠 (scxk豫2007-0001)40 只,雌雄各半,体质量(180±20) g,购自河南省实验动物中心。
1.2 方法
1.2.1 肝脏纤维化模型建立 将Wistar大鼠40只随机均分为两组。对照组20只,给予腹腔注射0.9%氯化钠注射液,模型组20只,给予腹腔注射10%的CCl4,每周2次,连续8周。8周后用10%水合氯醛 0.3ml/kg 麻醉处死,经门静脉采血 2ml,1500 r/min离心5min,取上清备用。取肝脏组织,一部分肝组织固定于10%甲醛中,另一部分肝组织储存于液氮备用。
1.2.2 检测项目 血清 TGF-B1、ALT(丙氨酸转氨酶)和HA检测:采用Olympas7100全自动生化仪酶法和放射免疫法检测。
1.2.3 肝组织病理学观察 取肝组织经脱水,浸蜡,石蜡包埋,常规制片,4μm切片,HE染色在Olympus BX51光学显微镜下观察。炎性反应分级及纤维化分期参见文献[1]。
1.2.4 Western blot分析 取适量模型组与对照组肝组织,提取总蛋白,用Bradford法测定蛋白含量。取50μg总蛋白变性5min后进行 SDS-PAGE电泳,分离后的蛋白10 V恒压35min转移至硝酸纤维素膜(NC膜)。5%脱脂奶粉室温封闭2 h,用含0.05%Tween-20 的 Tris缓冲液(TBST)洗涤 NC 膜 3次,加入 1∶100 稀释的 TGF-β1,Smad3,Smad7 特异抗体,4℃过夜,TBST洗膜后加入辣根过氧化物酶(HRP)标志的二抗(1∶1 000 稀释),室温 2 h,洗膜后加入化学发光 (electrochem-iluminescence,ECL)试剂显色曝光。以β-actin为上样量的内参照,用相对吸光度值(目的基因条带吸光度值/β-actin条带吸光度值)表示 TGF-β1,Smad3,Smad7 蛋白的相对表达强度。应用 Olympus BX51光学显微镜观察,摄影。采用北京航空航天大学病理图像分析系统分析结果,每个样本取3张切片,每张切片取5个视野进行光密度值分析。
1.2.5 肝组织 TGF-β1、Smad3 和 Smad7 表达的检测 用RT-PCR法,采用Trizol试剂一步法提取肝组织总RNA,合成cDNA,PCR扩增。PCR引物设计如下:
TGF-β1 5'-ACCTGCAAGACCATCCACATG-3'5'-GGTTTTCTCATAGATGGCATT-3' 258 bp Smad3 5'-TGATCACATTTCGATATTCATC-3'5'-TCAGCTTCTCTGATCCTGTGTAC-3' 306 bp Smad7 5'-CCATTCCTCGGAATCGATAGACG-3'5'-TCATTCCTCGGAATCGATAGACG-3' 469 bp β-actin 5'-AAGCCCATCACCATCTTCCACGA-3'5'-CCTTCCCTCACCAGTTTACTTG-3' 124 bp
反应条件如下:反应条件为94℃ 5min;94℃30 s,57 ℃ 30 s,72 ℃ 45 s,30 个循环;72 ℃ 10min。扩增产物进行琼脂糖凝胶电泳,紫外透射仪观察,应用法国VL公司BIO-PROFIF凝胶图像分析系统Bio-1D分析软件对目的电泳条带进行分析,以目的基因条带与内参照β-actin条带吸光度值之比表示表达量。
1.3 统计学分析 所有数据以均使用 SPSS 17.0统计软件处理。
2 结 果
2.1 两组血清ALT、HA和 TGF-β1表达水平 模型组血清 ALT (178.46±24.37)U/L,HA (693.38±206.36) μg/L ,TGF-β1(73.95±28.38) U/L,分别明显 高于对 照组的 (42.81±8.38)U/L,(59.36±28.13) μg/L,(20.69±17.86) U/L(P<0.01)。
2.2 两组肝组织病理观察 对照组大鼠肝小叶中央静脉、肝肝索、肝窦结构正常,无肝细胞坏死及纤维组织增生;模型组小鼠肝组织小叶内可见点状或灶状肝细胞坏死伴炎性细胞浸润,汇管区可见纤维组织增生,并向肝小叶内穿插,形成纤维间隔。见图1。
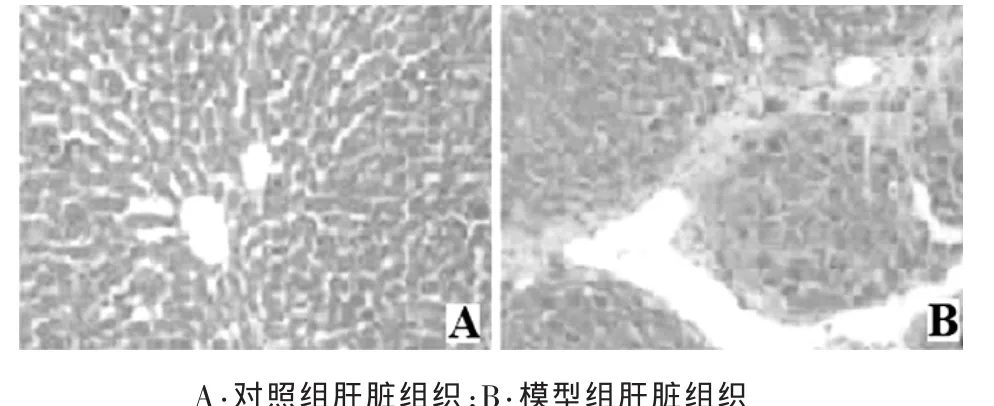
图 1 对照组与模型组肝组织病理观察(HE×10)
2.3 Western blot结果 TGF-β1、Smad3 和 Smad7蛋白在模型组与对照组中的表达是 TGF-β1,Smad3,模型组光密度值明显高于对照组(P<0.01),Smad7模型组光密度值明显低于对照组 (P<0.01)。见图 2,表 1。
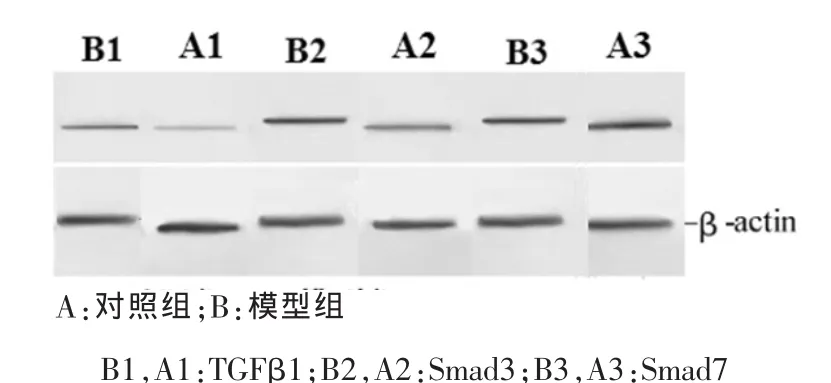
图 2 Western blot分析结果
2.4 两组肝组织中 TGF-β1、Smad3、Smad7 的表达在模型组肝组织TGF-β1、Smad3 mRNA表达明显高于对照组(P<0.01);而对照组中 Smad7 mRNA表达明显高于模型组(P<0.01),见图 3,表 1。
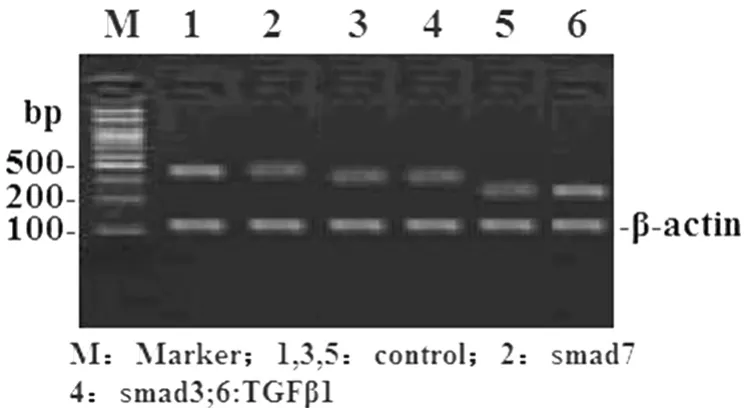
图 3 RT-PCR 检测 TGFβ1,Smad3,Smad7 mRNA在模型组和对照组肝组织中的表达
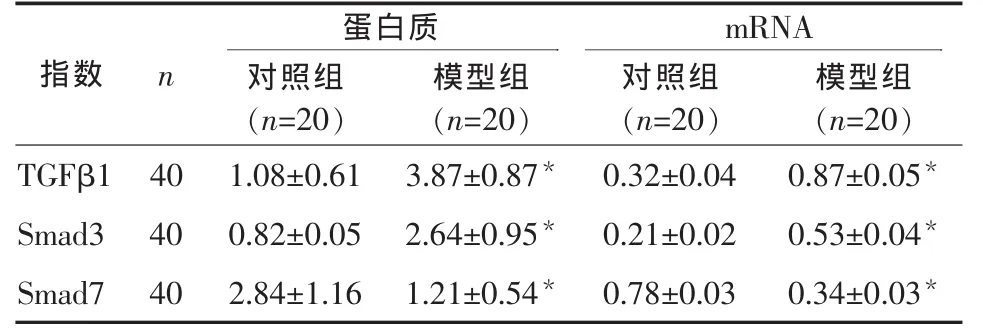
表 1 两组肝组织中蛋白与基因 TGF-β1、Smad3、Smad7(x±s)
3 讨 论
转化生长因子1(transforming growth factorbeta1,TGF-β1)是一种具有多向生物学效应的多肽类细胞调节因子[2],其主要通过 TGF/Smad 信号通路发挥生物学效应,对其作用机制的深入阐述有非常重要的意义[3]。Smad 蛋白是 TGF-β1 跨细胞膜传入的重要蛋白,TGF-β1与细胞膜上的 TGF-βRII结合后,活化 TGF-βRI,使 Smad2或 Smad3 C 末端磷酸化,并与Smad4形成异聚体转录复合物,移位至细胞核与序列特异的DNA结合,诱导基因转录,诱导使肝脏纤维化产生和发生发展。Smad7基因是TGF-β1信号传导通路的抑制元件,通过与活化的TGF-βI型受体结合,一方面抑制Smad2、Smad3的磷酸化,另方面抑制Smad2、Smad3与受体结合,在TGFβ信号传导中构成负反馈环路,发挥抗纤维化作用。TGF-β1是激活HSC的主要细胞因子之一,是最强的肝纤维化促进剂[4],本研究显示在肝脏纤维化的肝组织中Smad7的表达明显减少,在对照组中呈现高表达。而TGF-β1、Smad3蛋白在对照组正常肝组织中低表达,在肝脏纤维化中呈现高表达。并且蛋白和基因的表达呈现一致性。证明了肝纤维化发生时TGF-β1/Smads通路的信号分子存在过度活化。同时Smad7的功能明显的减弱。说明这种基因的明显变化证明是肝脏纤维化发生的重要基础。
慢性乙肝是肝硬化和肝细胞癌的高危因数,亚洲地区目前属其感染的高流行区[5,6]。肝纤维化是慢性肝病发展为肝硬化的病理必经过程,目前的研究认为肝纤维化是可逆的,而肝硬化是不可逆的。因此肝纤维化的早期诊断和及时干预对疾病的进展及预后的改善非常重要[7]。研究肝纤维化发展过程中各阶段的病理变化,解释其发生的机制,是进一步治疗和预防肝硬化的重要措施。本研究显示细胞的外基质沉积是导致肝纤维化发生的重要条件,而TGF-β1高表达在促进肝纤维化发生中起重要作用。因此在细胞外基质降解下降的纤维化中发生的TGF-β1 是最为重要的细胞因子[8]。
肝脏疾病在临床上采用肝活检病理诊断是诊断肝脏纤维化的客观标准,但血清学诊断的指标是目前临床常用的判断和分析是否有HBV感染及患者病程的重要指标之一[9],也成为目前研究肝脏疾病的焦点,研究认为,在肝纤维化发生过程中具有重要价值的指标有:HA、ALT、TGF等。大鼠血清ALT、HA、TGF-β1表达水平模型组与对照组相比具有显著性差异,并且其表达量随肝脏纤维化演进程度呈一致性。ALT、HA、TGF-β1三者在血清中的表达可以作为判断肝脏纤维化程度的生物学指标。
本研究显示,在肝纤维化形成和演进过程中,肝组织 TGF-β1、Smad3表达明显增强,血清中ALT、HA、TGF-β1表达水平明显升高,而肝脏组织中的Smad7表达显著减低,TGFβ1/smad信号传导通路功能明显增强,这些改变对肝纤维化发生及发展都起到了十分显著的重要作用,为临床上防治肝脏纤维化和肝硬化提供了新的思路。但是TGFβ1/smad信号传导通路中的调控机制,尚需要进一步深入研究。
[1]中华医学会传染病与寄生虫病学分会,肝病学分会.病毒性肝炎防治方案[J].中华肝脏病杂志,2004,8(6):329-330.
[2]程 林,向广阳,陈 德.TGF-β1及其受体与肝癌转移复发关系的研究进展[J].世界华人消化杂志,2012,20(33):3231.
[3]朱宏斌,杨云生,郭明洲.肝癌中转化生长因子信号转导通路的研究进展[J].胃肠病学和肝病学杂志,2012,21(3):206.
[4]车丽双,黄荣桂.TGF-β1与CTGF在肾间质纤维化中的作用[J].医学综述,2013,19(4):624-626.
[5]余晓红,王 媛,杨廷桐.乙型肝炎病毒cccDNA临床应用研究新进展[J].中华医院感染学杂志,2013,23(17):4338.
[6]余晓红,吕书锋,宋 蓓.1248例乙型肝炎标志物感染模式分析[J].中国误诊学杂志,2008,8(33):8212.
[7]田红娟.肝纤维化血清血检测指标的研究进展[J].中国当代医药,2013,20(9):26-27.
[8]孔令波,任伟光,米红梅,等.小鼠酒精性肝纤维化复合模型的建立及肝组织骨桥蛋白和转化生长因子β1的表达[J].中华肝脏病杂志,2013,21(3):207.
[9]万 亮,张敏燕.慢性乙型肝炎血清HMGB1水平在肝纤维化无创诊断中的价值[J].现代医院,2012,12(8):72-74
