津力达对胰岛素抵抗大鼠骨骼肌脂质沉积及线粒体功能的影响
2014-11-04臧莎莎刘颐轩宋光耀
臧莎莎,刘颐轩,宋光耀,王 超
(1.河北医科大学研究生学院,河北石家庄 050017;2.河北省人民医院,河北石家庄 050051)
2型糖尿病的重要特征是胰岛素抵抗 (IR)[1]。骨骼肌IR的发生在整个机体IR中占重要地位。而骨骼肌脂质沉积是诱导骨骼肌IR的主要原因[2]。当机体出现代谢异常尤其是发生2型糖尿病时,线粒体功能往往已经受损[3],出现线粒体脂肪酸氧化的减少及骨骼肌脂质沉积。降糖中成药津力达能够降低患者血糖、胆固醇、甘油三酯水平,改善IR,但其具体机制尚不明确。本研究从骨骼肌线粒体功能的改变及脂质沉积角度探讨津力达改善IR的作用机制。
1 材料和方法
1.1 材料 中成药津力达由河北以岭药业提供,国药准字Z 20050845;津力达为黄棕色颗粒剂,气微香,味微苦;药用复合膜包装,每袋装9 g,9袋/盒;将津力达颗粒研磨成粉末,用0.5%的羟甲基纤维素钠配制成为25%的津力达溶液灌胃。盐酸吡格列酮片,由日本武田制药有限公司生产,规格15 mg/片,批号149A;盐酸吡格列酮研磨成为粉末后用0.5%的羟甲基纤维素钠配制成0.1%的溶液灌胃。大鼠血清胰岛素及游离脂肪酸(FFA)ELISA试剂盒、骨骼肌甘油三酯 (TG)测试盒、骨骼肌FFA测试盒、骨骼肌长链脂酰辅酶A(LCACoA)ELISA试剂盒均购自南京建成生物试剂公司;肉碱脂酰转移酶1(CPT1)和过氧化物酶体增殖物激活受体γ共激活因子 (PGC-1α)抗体购于Santa Cruz公司,β-actin抗体及辣根过氧化物酶 (HRP)标记的二抗购自ProteinTech Group公司;ECL化学发光试剂盒购于上海生工生物工程股份有限公司。
1.2 实验动物 清洁级雄性SD大鼠36只,体质量 (140±20)g,购自中国食品药品检定研究院实验动物资源研究所,许可证号scxk(京)2009-0017,动物合格证号:0270141。
1.3 实验饲料 基础饲料购自河北医科大学实验动物中心,热量组成为碳水化合物65.5%,脂肪10.3%,蛋白质24.2%,总热量为348 kcal/100 g;自制高脂饲料热量组成为碳水化合物20.1%,脂肪59.8%,蛋白质占20.1%,总热量为501 kcal/100 g。
1.4 方法
1.4.1 动物分组 36只雄性SD大鼠随机分为两组,12只予基础饲料喂养,24只予高脂喂养。6周后每组各取6只行正葡萄糖高胰岛素钳夹实验判断IR模型造模成功。基础饲料喂养的剩余6只继续予基础饲料作为正常对照组;高脂喂养造模成功的18只进一步分组,高脂对照组,吡格列酮治疗组给予 4.5 mg/(kg·d),津力达治疗组给予1.5 g/(kg·d),吡格列酮与津力达溶液用0.5%的羟甲基纤维素钠配制。津力达及吡格列酮给药剂量均采用体表面积折算法将临床用药剂量等效折算为大鼠用药剂量。每日灌胃给药1次,正常、高脂对照组予同体积生理盐水灌胃,每周测量体质量及统计摄食量。灌胃第8周,腹主动脉放血处死大鼠,留取血清;留取股四头肌标本,-80℃保存备用。
1.4.2 高胰岛素-正葡萄糖钳夹试验 60 mg/kg戊巴比妥钠腹腔注射麻醉大鼠,行右颈动脉、右颈静脉插管术,导管经皮下由耳后引出并固定,用100 IU/mL肝素封管,结扎固定于颈后皮肤。插管术后3~5 d,待大鼠恢复体质量,禁食12 h过夜,次日在特制的鼠笼中行清醒状态下高胰岛素-正葡萄糖钳夹实验。测定基础血糖值后,4 mU/(kg·min)匀速输注胰岛素,使大鼠体内的胰岛素水平迅速升高。其后每10 min测定一次静脉血糖,输注并调整30%葡萄糖溶液的输注率,使维持血糖在 (5±0.5)mmol/L,连续3次以上血糖在上述范围即表明达到稳态,取稳态下5~6次葡萄糖输注率 (GIR)的平均值作为大鼠胰岛素敏感性的评价指标。
1.4.3 血液生化指标、骨骼肌 TG、FFA、LCACoA水平测定 灌胃第8周空腹取血,用快速血糖测定仪测定血糖,并分离血清于-80℃保存,同批测定胰岛素、TG、血清胆固醇 (TC)和FFA。血清胰岛素、FFA用ELISA试剂盒检测,血清甘油三酯和总胆固醇采用Beckman X20自动生化仪测定;骨骼肌TG经无水乙醇抽提后用TG试剂盒测定,FFA采用铜显色法测定,LCACoA使用ELISA试剂盒检测。
1.4.4 骨骼肌 PGC-1α和CPT1蛋白表达 采用Western-blotting方法测定。冷冻的骨骼肌组织称质量,加入组织裂解液提取蛋白并定量。取30 μg进行聚丙烯酰胺凝胶电泳分离蛋白后转移至聚偏氟乙烯(PVDF)膜,封闭液室温封闭 4 h,CPT1、PGC-1α、β-actin一抗4℃摇床过夜,洗膜后再加入辣根过氧化物酶 (HRP)标记的二抗,室温孵育2 h,用ECL化学发光试剂盒暗室显影。
1.4.5 RT-PCR检测 用Trizol法提取小鼠骨骼肌总RNA,RT-PCR采用Syber Green I GoTaq©qPCR Master Mix试剂盒在ABI PRISM 7300 PCR仪上进行。反应条件:95℃预变性10 min,随后95℃变性15 s 40个循环,58℃退火20 s,72℃延伸30 s。Pgc1α正向引物5'-AAGACCAGGAAATCCGAGC-3',反向引物5'-TTGCCATCCCGTAGTTCAC-3';Cpt1正向引物5'-CCAAACATCACTGCCCAA-3',反向引物5'-GGAAATAGGCTTCGTCATCC-3';Nrf1正向引物5'-AGACACGGTTGCTTCGGAA-3',反向引物5'-CGCACCACATTCTCCAAAG-3';CoxⅣ正向引物5'-TCGCTGAGATGAACAAGGG-3',反向引物5'-AGTGAAGCCGATGAAGAACA-3';Acadm正向引物 5'-TGACGGAGCAGCAGAAAGAG-3',反向引物5'-TTGATGAGAGGGAACGGGT-3';Pparα正向引物5'-GGTCCGATTCTTCCACTGCT-3',反向引物5'-GGTAACCTGGTCATTCAAGTC-3';Pparγ 正向引物 5'-CCACCAACTTCGGAATCAG-3',反向引物5'-GATGTCAAAGGAATGGGAGTG-3';β-actin正向引物 5'-TGTGATGGTGGGTATGGGT-3',反向引物5'-AGGATGCCTCTCTTGCTCTG-3'。反应结束后,按照各反应孔Ct值,以β-actin基因为内参,根据公式2-ΔCt计算各样品目的基因相对表达量。
1.4.6 电镜观察 透射电镜于河北医科大学观察。切取少量肌组织,用锐利眼科剪剪成 (2 mm×2 mm×2 mm)左右的组织方块,浸泡于2.5%的戊二醛,1%锇酸固定,常规电镜样品制备程序脱水、渗透、包埋,制备成1 μm的超薄切片,最后在HITACHI H7500型透射电镜下观察并摄片。
1.4.7 统计学处理 用spss 13.0统计软件进行分析。所有数据用均数±标准差 ()表示,组间比较用完全随机设计的单因素方差分析。以 P<0.05表示差异有统计学意义。
2 结果
2.1 大鼠体质量及血液生化指标的比较 与正常组相比,高脂组大鼠体质量明显增加 (P<0.05),津力达及吡格列酮组与高脂组比较体质量降低(P<0.05)。每日平均摄入热量津力达、吡格列酮组与高脂组间无统计学差异 (P>0.05)。高脂组空腹血糖、胰岛素、TG、TC、FFA均高于正常组,除TC外都具有统计学差异 (P<0.05);津力达及吡格列酮组空腹血糖高于正常组,低于高脂组,差异有统计学意义 (P<0.05);津力达及吡格列酮组空腹胰岛素、FFA较高脂组降低 (P<0.05),与正常组无差别;津力达能够显著降低TG,TC(P<0.05),吡格列酮组只能降低TG水平 (P<0.05)。见表1。
2.2 胰岛素敏感性评价 高脂组GIR明显低于正常组 (P<0.05),津力达及吡格列酮组GIR较高脂组升高 (P<0.05),与正常组无差别。见表1。
表1 各组大鼠体质量、日均摄食、血糖、胰岛素、血脂、GIR比较 ()Tab.1 Body weight,energy food intake,blood glucose,insulin,lipid and GIR among groups()
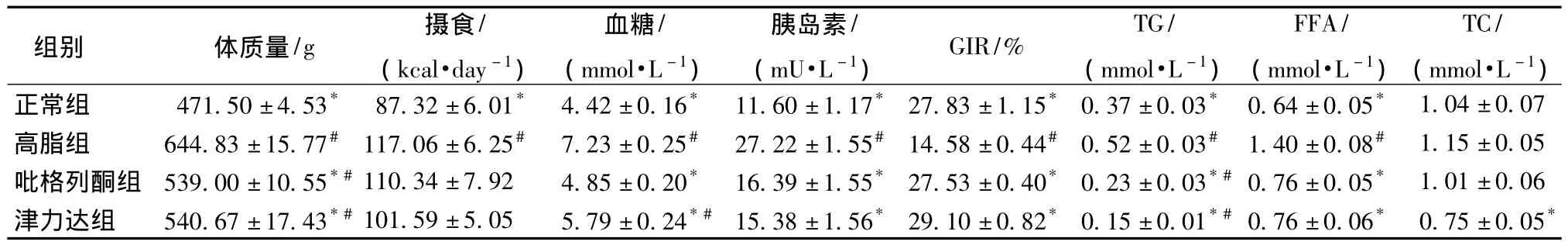
表1 各组大鼠体质量、日均摄食、血糖、胰岛素、血脂、GIR比较 ()Tab.1 Body weight,energy food intake,blood glucose,insulin,lipid and GIR among groups()
注:与高脂组相比,*P<0.05;与正常组相比,#P<0.05
组别 体质量/g 摄食/(kcal·day-1)血糖/(mmol·L-1)胰岛素/(mU·L-1)GIR/% TG/(mmol·L-1)FFA/(mmol·L-1)TC/(mmol·L-1)正常组 471.50±4.53* 87.32±6.01* 4.42±0.16* 11.60±1.17* 27.83±1.15* 0.37±0.03* 0.64±0.05*1.04±0.07高脂组 644.83±15.77# 117.06±6.25# 7.23±0.25# 27.22±1.55# 14.58±0.44# 0.52±0.03# 1.40±0.08# 1.15±0.05吡格列酮组 539.00±10.55*#110.34±7.92 4.85±0.20* 16.39±1.55* 27.53±0.40* 0.23±0.03*#0.76±0.05* 1.01±0.06津力达组 540.67±17.43*#101.59±5.05 5.79±0.24*# 15.38±1.56* 29.10±0.82* 0.15±0.01*#0.76±0.06* 0.75±0.05*
2.3 各组大鼠骨骼肌TG、FFA、LCACoA水平比较 高脂组骨骼肌TG、FFA、LCACoA水平均高于正常组 (P<0.05),津力达及吡格列酮组 TG、FFA、LCACoA水平较高脂组明显降低 (P<0.05)。见表2。
表2 各组大鼠骨骼肌TG、FFA、LCACoA比较 ()Tab.2 TG、FFA、LCACoA in skeletal muscle among groups()
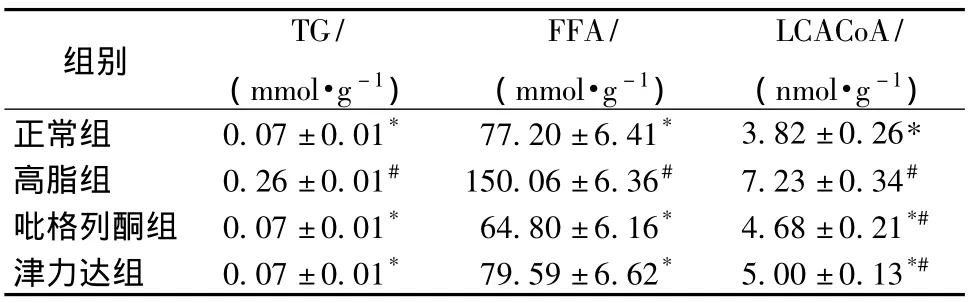
表2 各组大鼠骨骼肌TG、FFA、LCACoA比较 ()Tab.2 TG、FFA、LCACoA in skeletal muscle among groups()
注:与高脂组比较,*P<0.05;与正常组比较,#P<0.05
组别TG/(mmol·g-1)FFA/(mmol·g-1)LCACoA/(nmol·g-1)正常组 0.07±0.01* 77.20±6.41* 3.82±0.26*高脂组 0.26±0.01# 150.06±6.36# 7.23±0.34#吡格列酮组 0.07±0.01* 64.80±6.16* 4.68±0.21*#津力达组 0.07±0.01* 79.59±6.62* 5.00±0.13*#
2.4 各组大鼠线粒体基因的表达 RT-PCR检测了线粒体Pgc1α,核呼吸因子1(Nrf1),细胞色素C氧化酶亚基Ⅳ (CoxⅣ)的表达,同时检测了线粒体氧化脂肪酸基因包括肉碱脂酰转移酶1(Cpt1)、乙酰辅酶A脱氢酶 (Acadm)、过氧化物酶体增殖物激活受体α(Pparα)和Pparγ的表达。与正常组比较,高脂组上述基因mRNA的表达明显下调 (P<0.05),津力达与吡格列酮均上调了Pgc1α、 Cpt1、 Acadm、 Pparα 及 Pparγ (P <0.05),均未改变Nrf1的表达 (P>0.05)。津力达上调了CoxⅣ的表达,而吡格列酮未能上调其表达。见表3。
表3 各组大鼠骨骼肌线粒体基因的比较 ()Tab.3 mRNA levels for multiple genes involved in mitochondrial function and fat oxidation in skeletal muscle among groups()

表3 各组大鼠骨骼肌线粒体基因的比较 ()Tab.3 mRNA levels for multiple genes involved in mitochondrial function and fat oxidation in skeletal muscle among groups()
注:与高脂组比较,*P<0.05;与正常组比较,#P<0.05
组别 Pgc1α Nrf1 CoxⅣ Cpt1 Acadm Pparα Pparγ正常组 1.32±0.08* 0.89±0.06* 1.35±0.09* 1.26±0.05* 1.67±0.19* 1.06±0.06* 1.59±0.08*高脂组 0.49±0.07# 0.47±0.04# 0.72±0.09# 0.49±0.05# 0.62±0.09# 0.39±0.04# 0.59±0.07#吡格列酮组 0.88±0.10*# 0.62±0.04# 0.75±0.06# 1.07±0.05*# 1.22±0.11*# 1.00±0.07* 1.47±0.07*津力达组 0.95±0.06*# 0.62±0.05# 1.12±0.12* 0.96±0.08*# 1.28±0.16*# 0.78±0.04*# 1.29±0.08*#
2.5 各组大鼠骨骼肌PGC-1α和CPT1蛋白表达大鼠骨骼肌组织PGC-1α和CPT1蛋白以其与β-actin的比值表示,结果显示骨骼肌PGC-1α和CPT1蛋白高脂组低于正常组,差异具有统计学意义(P<0.05),津力达及吡格列酮组较高脂组蛋白表达升高 (P<0.05)。见图1、表4。
表4 骨骼肌PGC-1α和CPT1蛋白相对表达量 ()Tab.4 Protein relative expression of PGC-1α and CPT1 in skeletal muscle()

表4 骨骼肌PGC-1α和CPT1蛋白相对表达量 ()Tab.4 Protein relative expression of PGC-1α and CPT1 in skeletal muscle()
注:与高脂组比较,*P<0.05;与正常组比较,#P<0.05
CPT1正常组 1* 1组别 PGC-1α*高脂组 0.46±0.05# 0.43±0.01#吡格列酮组 0.79±0.05*# 0.79±0.07*#津力达组 0.81±0.06*# 0.67±0.09*#
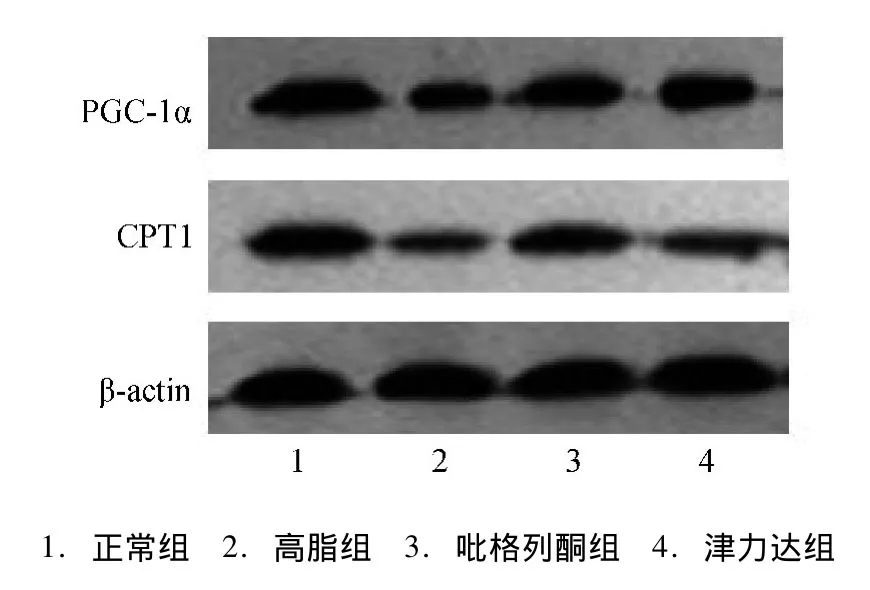
图1 骨骼肌PGC-1α和CPT1蛋白表达比较Fig.1 Protein expression ofPGC-1α andCPT1in skeletal muscle
2.6 电镜观察 正常组大鼠骨骼肌组织线粒体、粗面内质网丰富,胞浆内无脂滴,线粒体膜、嵴结构完整,嵴为隔板状,基质均匀,与线粒体长轴垂直,排列规则,粗面内质网排列整齐。高脂组大鼠骨骼肌组织脂滴较多,线粒体肿胀,线粒体嵴变少变短,部分或全部脊和膜融合消失,甚至出现空泡化,内质网扩张,津力达及吡格列酮干预后脂滴明显减少,线粒体肿胀减轻。见图2。
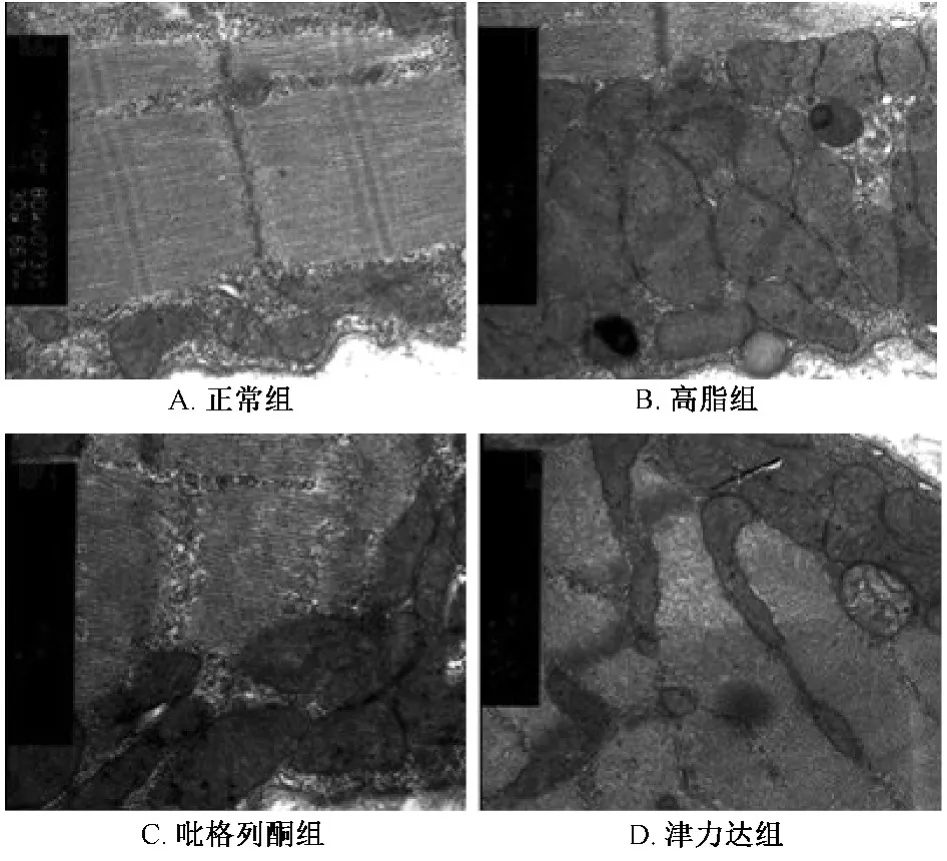
图2 电镜下线粒体形态观察Fig.2 Mitochondria morphology was determined by electron microscopy
3 讨论
胰岛素抵抗 (IR)指外周组织及靶器官对胰岛素的敏感性及反应性降低[1],是肥胖和2型糖尿病的病理基础。虽然引起IR的具体机制仍不明确,但是近年来人们认为脂质剩余可能是其分子基础之一。
骨骼肌组织是全身脂肪酸利用的主要场所,骨骼肌IR的发生在整个机体IR中占重要地位。高脂饮食会诱导IR的发生,同时与细胞脂代谢异常密切相关,当脂肪酸的摄入超出骨骼肌自身氧化能力时通常会导致骨骼肌脂质堆积,如TG,FFA,LCACoA的堆积,从而损害胰岛素信号传导通路[4],最终诱导骨骼肌乃至全身IR的发生。
线粒体是调控代谢的重要细胞器。线粒体内膜上有呼吸链酶系、ATP合成酶系及肉毒碱酰基转移酶等,基质中则存在三羧酸循环酶类、脂肪酸氧化酶类和蛋白质、核酸合成酶类等,外膜中酶的量相对较少。线粒体主要功能是进行氧化磷酸化合成ATP,为细胞生命活动提供直接能量,同时也是糖脂代谢的场所。目前普遍认为机体的IR状态与能量过度摄入,线粒体脂质代谢超负荷,导致线粒体功能障碍有关。当机体出现IR尤其是发生2型糖尿病时,线粒体功能往往已经受损,因此通常出现线粒体脂肪酸氧化的减少及脂质异位积聚[5-6]。IR患者通常伴随编码线粒体蛋白的核基因表达下调,同时过氧化物酶体增殖物激活受体γ共激活因子1α(Pgc1α),调节线粒体生物合成及功能的关键核转录共激活因子,表达明显下调[7]。其中线粒体内膜上的肉碱脂酰转移酶1(CPT1),将长链脂酰辅酶A转运进入线粒体进行β氧化,是β氧化的限速环节,对骨骼肌乃至整个机体脂肪酸的氧化发挥重要作用。高脂饮食诱导的IR大鼠通常伴随CPT1 的表达下调[8]。
津力达是由人参、黄精、苍术 (炒)、苦参、麦冬、地黄等十几味中药制成,具有益气养阴、健脾运津的功效。临床试验及动物实验证实它能够降低四氧嘧啶和肾上腺素所诱发大鼠的高血糖,调节糖耐量[9],临床上主要用于IR及糖尿病的治疗,但是其具体作用机制尚不明确。本研究选用吡格列酮,PPARγ激动剂,作为阳性对照药来探讨津力达改善IR的作用机制。
津力达灌胃8周后明显改善了高脂饮食诱导的大鼠IR:空腹血糖、胰岛素、血TC、TG、FFA等均得到改善;高脂饮食后骨骼肌脂质 (TG、FFA、LCACoA)发生沉积,津力达及对照药物吡格列酮干预后脂质沉积明显减轻。为进一步探究其机制,本实验检测了津力达对骨骼肌线粒体基因Pgc1α、Nrf1、CoxⅣ 及线粒体氧化脂肪酸基因 Cpt1、Acadm、Pparα和Pparγ表达的影响,同时检测了骨骼肌PGC-1α和CPT1蛋白的表达。高脂饮食后线粒体基因及PGC-1α、CPT1蛋白表达明显下调,津力达干预后明显增加了上述基因及蛋白的表达:表达上调的CPT1将LCACoA转运进入线粒体,线粒体基因尤其是氧化脂肪酸基因表达的上调增加了线粒体氧化脂肪酸能力,从而对进入线粒体的脂质进行充分地β氧化,减少了骨骼肌脂质沉积,改善了IR。与津力达不同,吡格列酮未能上调CoxⅣ基因的表达。
总之,本研究发现高脂饮食大鼠骨骼肌线粒体基因表达下调、功能减低,骨骼肌脂质TG、FFA、LCACoA水平增加,发生胰岛素抵抗。津力达干预之后上调了骨骼肌线粒体基因的表达,增强了线粒体功能及脂肪酸β氧化,最终减少了骨骼肌脂质沉积,改善了胰岛素抵抗。
[1]Sinaiko A R,Caprio S.Insulin resistance[J].Pediatr,2012,161(1):11-15.
[2]Pedersen B K,Febbraio M A.Muscles,exercise and obesity:skeletal muscle as a secretory organ [J].Nat Rev Endocrinol,2012,8(8):457-465.
[3]Giebelstein J,Poschmann G,Hojlund K,et al.The proteomic signature of insulin-resistant human skeletal muscle reveals increased glycolytic and decreased mitochondrial enzymes[J].Diabetologia,2012,55(4):1114-1127.
[4]Eckardt K,Taube A,Eckel J.Obesity-associated insulin resistance in skeletal muscle:role of lipid accumulation and physical inactivity[J].Rev Endocr Metab Disord,2011,12(3):163-172.
[5]邹琪婧,曹仁贤,洪 涛.线粒体脂质过载与胰岛素抵抗[J].现代医药卫生,2012,28(6):880-882.
[6]赵 斐,靳庆勋,乔海荣,等.有氧运动改善高脂膳食诱导的胰岛素抵抗:增强骨骼肌线粒体融合与分裂及功能[J].中国运动医学杂志,2012,31(1):24-30.
[7]张 媛,漆正堂,郭 维,等.耐力训练对高脂膳食大鼠骨骼肌线粒体脂肪氧化及 PGC-α基因表达的影响[J].天津体育学院学报,2010,25(3):193-196.
[8]Zhang X,Wang C,Song G,et al.Mitofusion-2-mediated alleviation of insulin resistance in rats through reduction in lipid intermediate accumulation in skeletal muscle[J].J Biomed Sci,2013,20(1):Epub ahead of print.
[9]洪晓华,李映欧,于魏林,等.津力达口服液对糖尿病大鼠肝细胞膜胰岛素受体的影响[J].中国中西医结合杂志,1997,17(S1):113-114.
