芹菜素对U937细胞增殖凋亡及SALL4基因和Wnt/β-catenin信号通路的影响
2014-11-04刘江华戴碧涛梁绍燕
刘江华,戴碧涛,张 妮,梁绍燕,于 洁
(重庆医科大学附属儿童医院血液肿瘤科,儿童发育疾病研究教育部重点实验室,儿科学重庆市重点实验室,重庆市儿童发育重大疾病诊治与预防国际科技合作基地,重庆 400014)
芹菜素 (化学名4',5,7-三羟基黄酮)是一种多酚类黄酮化合物,广泛分布于芹菜、洋葱、橘子等多种水果和蔬菜中,具有抗炎、抗氧化、抗肿瘤、抗病毒等药理活性,其中以抗肿瘤作用最为突出[1-2]。实验证明,芹菜素对多种肿瘤细胞具有抑制生长和诱导凋亡的作用,如肺癌NCI-H460细胞[3]、胃癌 SGC-7901 细胞[4]、卵巢癌 CAOV3 细胞[5]、膀胱癌BIU-87细胞[6]等。对白血病的研究发现,芹菜素在体外能诱导急性早幼粒白血病细胞株HL-60发生凋亡[7],在体内能够抑制小鼠移植性白血病肿瘤的生长[8],但其抗白血病作用的机制尚不明确。
SALL4是新发现的癌基因,位于20q13,编码一种锌指蛋白转录因子,其异常表达与白血病的发生及预后密切相关。SALL4过表达的转基因小鼠最终发生了急性髓细胞白血病,且在不同类型的白血病细胞株及病人中都检测到了SALL4的高表达;SALL4致白血病的机制可能是通过激活造血干细胞自我更新的重要通路 Wnt/β-catenin通路实现的[9-10]。
芹菜素作为潜在的抗肿瘤药物,对SALL4基因及Wnt/β-catenin信号通路的影响目前未见报道。本研究选择急性单核细胞白血病细胞株U937作为研究对象,探讨芹菜素对U937细胞增殖凋亡及SALL4基因和Wnt/β-catenin信号通路的影响。
1 材料与方法
1.1 主要试剂 芹菜素 (纯度>95%)、二甲基亚砜 (DMSO)购自Sigma公司;RPMI-1640培养基、胎牛血清 (FBS)购自Hyclone公司;CCK-8试剂购自南京凯基生物科技发展有限公司;Annexin V-FITC/PI细胞凋亡检测试剂盒购自欣博盛生物科技有限公司;TRIzol试剂购自Invitrogen公司;逆转录试剂盒及SYBR GreenⅡ荧光染料购自Takara(大连宝生物生物工程有限公司);SALL4多抗购自 GeneTex公司,Bcl-2、Caspase-3单抗购自Cell Signaling公司,β-actin单抗及羊抗兔或羊抗鼠IgG二抗购自北京中杉金桥生物有限公司。实验前将芹菜素溶解在DMSO溶剂中,配成39.2 mmol/L的浓缩液,-20℃贮存备用。实验时用含10%FBS的RPMI-1640培养基配制成芹菜素工作液,DMSO终质量分数在0.4%以下,预实验证明该质量分数对细胞生长无影响。
1.2 方法
1.2.1 细胞株及细胞培养 人U937细胞株由重庆医科大学附属儿童医院儿科研究所传代冻存。复苏后培养于含10%胎牛血清、100 U/mL青霉素、100 U/mL链霉素的 RPMI-1640培养液中,置37℃、5%CO2、饱和湿度培养箱内培养,2~3 d传代1次,取对数生长期细胞用于实验。
1.2.2 倒置显微镜观察细胞形态变化 取对数生长期的U937细胞,加入不同体积的芹菜素浓缩液,使芹菜素终浓度分别为0、20、40、60 μmol/L(0组为对照组)。培养24 h后,倒置显微镜下观察细胞形态变化。
1.2.3 CCK-8法检测芹菜素对U937细胞的增殖影响 将不同处理组细胞 (芹菜素终浓度分别为0、20、40、60 μmol/L)以1×105个/mL密度接种于96孔培养板中,每孔100 μL培养体系,每组设3个复孔。置37℃、5%CO2的培养箱分别培养12、24、36 h后,每孔加入10 μL CCK-8试剂,于培养箱中继续孵育2 h,酶标仪上测定450 nm波长处每孔细胞的光密度值 (A)。按以下公式计算细胞增殖抑制率 (%)=[(对照孔A值-加药孔A值)/对照孔A值]×100%,并计算API处理U937细胞24 h的IC50。实验重复3次。
1.2.4 流式细胞仪测定细胞周期 收集不同浓度(0、20、40、60 μmol/L)芹菜素处理 24 h 的U937细胞,800 r/min离心5 min,弃上清,预冷PBS洗涤细胞2次,75%乙醇固定细胞。离心重悬细胞后加入碘化丙啶,4℃避光孵育1 h后上流式细胞仪检测。
1.2.5 Annexin V-FITC/PI双染法检测细胞凋亡 收集不同浓度 (0、20、40、60 μmol/L)芹菜素处理24 h后的细胞,800 r/min离心5 min,弃上清,预冷PBS洗涤细胞2次。Binding Buffer重悬细胞后,取195 μL的细胞悬液加入5 μL的Annexin V-FITC,混匀后间隔3 min,再加入10 μL碘化丙啶,室温避光孵育10 min后上流式细胞仪检测。
1.2.6 引物设计及合成 根据GeneBank中人SALL4(NM_020436.3)、C-Myc(NM_002467.4)、CCND1(NM_053056.2)、β-actin(NM_001101.3)基因序列设计引物,引物序列见表1。引物均由上海英骏生物工程有限公司合成。

表1 荧光定量PCR引物序列Tab.1 Sequences of real-time PCR primers
1.2.7 荧光定量PCR检测基因表达水平 收集不同浓度 (0、20、40、60 μmol/L)芹菜素处理36 h的细胞,按TRIzol试剂的操作说明提取总RNA,分光光度计测定 RNA浓度及纯度,A260/A280为1.8~2.1者用于逆转录反应。逆转录条件为:37℃ 15 min,85℃ 5 s。以合成的cDNA为模板,进行荧光定量PCR反应,条件为:95℃预变性30 s,95℃变性10 s,58℃退火30 s,72℃延伸20 s,共40个循环,65℃ ~95℃记录熔解曲线。在Bio-Rad CFX96荧光定量PCR仪器上进行反应,以SYBR GreenⅡ作为荧光染料,记录样本的循环阈值 (Ct值)。目的基因Ct值减去内参基因Ct值用ΔCt表示,处理组ΔCt值减去对照组 ΔCt值用ΔΔCt表示,以2-ΔΔCt相对定量法计算各处理组相对于对照组基因表达水平的变化。
1.2.8 Western Blot检测蛋白表达水平 收集不同浓度 (0、20、40、60 μmol/L)芹菜素处理36 h的细胞,用蛋白裂解液提取各组细胞总蛋白,取50 μg蛋白经10%SDS-PAGE电泳后转移至 PVDF膜上,用含5%脱脂奶粉的TBST室温下封闭2 h,加一抗4℃孵育过夜,一抗稀释度为SALL4(1∶800)、Bcl-2(1∶1000)、Caspase-3(1∶1000)、β-actin(1∶200)。TBST洗膜3次,加1∶1000稀释的羊抗兔或羊抗鼠二抗,室温孵育1 h后,TBST洗膜,加入ECL发光成像。
1.3 统计学分析 采用SPSS 17.0统计学软件进行数据分析,计量资料以表示。两样本均数比较采用t检验,多组间比较采用单因素方差分析,相关性分析采用Pearson检验。以 P<0.05为差异有统计学意义。
2 结果
2.1 芹菜素处理后U937细胞形态的变化 与对照组相比,随着药物浓度的增高,处理组的细胞密度逐渐降低,细胞内颗粒增多,透明度逐渐下降,细胞碎片增多。其中60 μmol/L处理组可见大量细胞碎片,活细胞少见 (图1)。
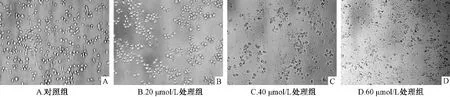
图1 不同浓度芹菜素处理U937细胞24 h后细胞形态的变化 (200×)Fig.1 Morphological changes of U937 cells after beging treated with different concentrations of apigenin for 24 h(200×)
2.2 芹菜素对U937细胞增殖的影响 与对照组相比,处理组的细胞增殖明显受抑制 (P<0.01,表2)。同一时间点随着药物浓度的升高,细胞增殖抑制率逐渐增高 (P<0.05);同一药物浓度,随着作用时间的延长,细胞增殖抑制率逐渐增高(P<0.05)。说明芹菜素对U937的增殖抑制作用呈时间和剂量依赖性。24h的 IC50=32.18 μmol/L,36 h 的 IC50=22.37 μmol/L。
表2 芹菜素对U937细胞增殖抑制率的影响 (%,,n=3)Tab.2 Inhibition rates of U937 cells after beging treated with different concentrations of apigenin for different amount of time(%,,n=3)

表2 芹菜素对U937细胞增殖抑制率的影响 (%,,n=3)Tab.2 Inhibition rates of U937 cells after beging treated with different concentrations of apigenin for different amount of time(%,,n=3)
注:与对照组比较,**P<0.01
芹菜素/(μmol·L -1)12 h 24 h 36 h 000020 20.54 ±4.13** 36.74 ±2.57** 46.70 ±1.46**40 32.04 ±2.96** 56.70 ±3.92** 66.82 ±1.77**60 41.42±3.02** 66.35±3.34** 77.86±1.30**
2.3 芹菜素对U937细胞周期的影响 与对照组相比,随着药物浓度的升高,G2/M期细胞比例增多 (P<0.01),S期细胞比例下降,但差异无统计学意义 (P>0.05)(表3,图2)。提示芹菜素对细胞周期的阻滞发生在G2/M期,且在一定范围内,与药物剂量正相关 (P<0.01)。
表3 芹菜素作用24 h后U937细胞的周期分布 (%,,n=3)Tab.3 Cell cycle of U937 after beging treated with different concentrations of apigenin for different amount of time(%,,n=3)

表3 芹菜素作用24 h后U937细胞的周期分布 (%,,n=3)Tab.3 Cell cycle of U937 after beging treated with different concentrations of apigenin for different amount of time(%,,n=3)
注:与对照组相比,*P<0.05
芹菜素/(μmol·L -1)G0/G1 S G2/M 060.49±6.70 38.91±6.28 0.60±0.4520 53.29±0.58 35.19±1.85 11.52±2.20*40 52.15±2.46 30.56±1.83 18.43±1.14*60 39.87±5.41 27.31±5.59 29.34±0.68*

图2 芹菜素作用24 h后U937细胞的周期分布Fig.2 Cell cycle of U937 after beging treated with different concentrations of apigenin for 24 h
2.4 芹菜素对U937细胞凋亡的影响 与对照组相比,随着药物浓度的升高,细胞凋亡率逐渐增高(P<0.05),并在一定范围内有浓度依赖性 (P<0.05,表4,图3)。
表4 不同浓度芹菜素作用24 h对U937细胞凋亡率的影响(%,,n=3)Tab.4 Apoptotic rates of U937 cells after beging treated with different concentrations of apigenin for 24 h(%,,n=3)

表4 不同浓度芹菜素作用24 h对U937细胞凋亡率的影响(%,,n=3)Tab.4 Apoptotic rates of U937 cells after beging treated with different concentrations of apigenin for 24 h(%,,n=3)
注:与对照组相比,*P<0.05
芹菜素/(μmol·L-1) 凋亡率/%3.42±1.1320 5.66±0.60*40 7.90±0.26*60 10.86±0.940*
2.5 芹菜素对SALL4及Wnt/β-catenin通路下游靶基因c-Myc、CCND1表达的影响 随着芹菜素浓度的升高,SALL4、c-Myc、CCND1的表达量逐渐下降。与对照组相比,差异有统计学意义 (P<0.05,表5,图4)。经Pearson相关性分析,SALL4与c-Myc、CCND1表达量正相关,相关系数分别为0.882和0.662,差异有统计学意义 (P<0.05)。
表5 Real-time PCR检测芹菜素作用36 h后SALL4、c-Myc、CCND1 mRNA的相对表达量 (,n=3)Tab.5 Determination of relative expression of SALL4,c-Myc and CCND1 mRNA by real-time PCR(,n=3)

表5 Real-time PCR检测芹菜素作用36 h后SALL4、c-Myc、CCND1 mRNA的相对表达量 (,n=3)Tab.5 Determination of relative expression of SALL4,c-Myc and CCND1 mRNA by real-time PCR(,n=3)
注:与对照组相比,*P <0.05,**P <0.01
芹菜素/(μmol·L -1)2 - ΔΔ Ct SALL4 C-MYC CCND101.00±0.12 1.00±0.04 1.00±0.0820 0.76±0.06* 0.71±0.04* 0.51±0.13**40 0.53 ±0.06** 0.48 ±0.04* 0.36 ±0.05**60 0.37±0.08** 0.24±0.09* 0.35±0.09**
2.6 芹菜素对SALL4、Bcl-2和Caspase-3蛋白表达的影响 芹菜素处理U937细胞36 h后,SALL4、Bcl-2蛋白表达水平降低,Caspase-3表达升高,与对照组相比,差异有统计学意义 (P<0.05)(图5)。

图3 芹菜素作用24 h后U937细胞的凋亡率Fig.3 Apoptotic rates of U937 cells after beging treated with different concentrations of apigenin for 24 h

图4 real-time PCR检测各组细胞SALL4、c-Myc、CCND1 mRNA的相对表达量Fig.4 Determination of relative expression of SALL4,c-Myc and CCND1 mRNA in various groups by realtime PCR
3 讨论
化疗是儿童急性白血病和其他恶性肿瘤的主要治疗手段,大剂量化疗可以产生更强的肿瘤细胞凋亡作用;然而化疗药物的毒副作用及耐药问题严重困扰着临床治疗。芹菜素作为一种天然植物成分,因其高效、低毒、无诱变性等特点,逐渐成为新兴的研究热点。本实验结果显示,20、40、60 μmol/L的芹菜素都表现出抑制U937细胞增殖的能力,且随着药物浓度的升高和时间的延长,抑制作用逐渐增强,呈现出明显的时间和剂量依赖性。本研究还发现芹菜素能够通过调控凋亡相关蛋白Bcl-2和Caspase-3诱导细胞凋亡,印证了Budhraja的研究结果[8]。细胞增殖和凋亡的动态平衡是维持机体正常状态的重要条件,肿瘤的形成就是由于恶性细胞增殖加快、凋亡受阻,打破了这种动态平衡所致。本研究的结果提示芹菜素能够通过抑制肿瘤细胞增殖和诱导凋亡,恢复正常的生理平衡,从而起到抗肿瘤的作用。

图5 芹菜素处理后各组细胞SALL4、Bcl-2和Caspase-3的蛋白表达水平Fig.5 Protein expression levels of SALL4,Bcl-2 and Caspase-3 in U937 cells in various groups after apigenin treatment
细胞周期是一个复杂有序的生理过程,对维持机体正常功能具有重要作用,许多化疗药物就是通过作用于特定的细胞周期发挥作用的,如阿糖胞苷主要作用于S期,长春新碱特异地作用于M期。在细胞周期的调控过程中,从G0期能否进入S期、从G2期能否进入M期是两个关键点。若能阻断细胞从某一时相进入下一时相,导致细胞蓄积在特定时相,此时再给予该时相特异性药物就能够增强对肿瘤细胞的杀伤作用。本研究通过流式细胞术检测芹菜素对U937细胞周期的影响,发现不同浓度的芹菜素处理细胞后,引起G2/M期的细胞增多,说明芹菜素对细胞周期的阻滞作用发生在G2/M期,与文献报道一致[11-12]。推测如果把芹菜素与G2/M期特异性化疗药物联合应用,既可以增强化疗药物对肿瘤细胞的杀伤性,增加化疗药物的敏感性,又可以减少化疗药物的用量,降低药物的毒副作用。
SALL4是果蝇Spalt的同源基因,在维持胚胎干细胞的多能性及自我更新中起着重要作用,其突变可导致畸形的发生,如Okihiro综合征和IVIC综合征[13-15]。在正常造血发育中,SALL4主要表达于CD34
+的造血干/祖细胞,随着细胞的分化成熟,其表达量逐渐降低,在成熟造血细胞中几乎不表达,而在白血病细胞中表达升高[10],提示SALL4可能参与了白血病的发生。有研究认为SALL4可能通过与β-catenin结合,激活白血病自我更新的重要通路 Wnt/β-catenin 信号通路[9]。c-Myc和 CCND1是Wnt通路中重要的下游靶基因。c-Myc是早期发现的原癌基因,控制细胞的增殖和分化,与肿瘤的发生密切相关。CCND1编码的CYCLIN-D1是细胞周期调节的重要因子,过表达可以促进细胞增殖。通过RNA干扰技术抑制SALL4的表达后发现,β-catenin 和 c-Myc、CCND1 的表达随之下调[11],提示阻断SALL4可以抑制Wnt信号通路的传导,从而可能抑制肿瘤的发生。关于芹菜素对SALL4基因及Wnt/β-catenin信号通路的作用,此前尚未见报道。本研究通过荧光定量PCR及Western blot等技术检测了芹菜素对SALL4及Wnt通路下游因子c-Myc、CCND1表达的影响,发现芹菜素能下调SALL4、c-Myc、CCND1的表达,且 SALL4与 c-Myc、CCND1有明显相关性,提示芹菜素可能通过抑制SALL4表达,阻断Wnt/β-catenin信号通路发挥其抗白血病作用。
综上所述,芹菜素对U937细胞有抑制增殖、诱导凋亡的作用。其机制可能与抑制SALL4基因的表达,阻断Wnt/β-catenin信号通路,调控凋亡相关蛋白Bcl-2、Caspase-3的表达有关。
[1]Patel D,Shukla S,Gupta S.Apigenin and cancer chemoprevention:progress,potential and promise(review)[J].Int J Oncol,2007,30(1):233-245.
[2]陈况况,章宏慧,陈健初.芹菜素对癌细胞作用机理的研究进展[J].食品工业科技,2013,34(3):392-395.
[3]潘雪刁,杨周萍,杨志英,等.芹菜素对人肺癌NCI-H460细胞增殖及凋亡的影响[J].南方医科大学学报,2013,33(8):1137-1140.
[4]苑林宏,夏 薇,赵秀娟,等.芹菜素通过抑制PKB/Akt激酶活性诱导人胃癌细胞凋亡[J].科学通报,2007,52(13):1523-1528.
[5]杜俊瑶,辛 彦.芹菜素对人卵巢癌细胞系CAOV3细胞增殖周期的影响[J].中国实用妇科与产科杂志,2008,24(6):456-458.
[6]姚善华,胡自力,邓新军,等.芹菜素诱导膀胱癌细胞株BIU-87凋亡及机制的研究[J].重庆医科大学学报,2010,35(8):1194-1197.
[7]Jayasooriya R G,Kang S H,Kang C H,et al.Apigenin decreases cell viability and telomerase activity in human leukemia cell lines[J].Food Chem Toxicol,2012,50(8):2605-2611.
[8]Budhraja A,Gao N,Zhang Z,et al.Apigenin induces apoptosis in human leukemia cells and exhibits anti-leukemic activity in vivo[J].Mol Cancer Ther,2012,11(1):132-142.
[9]Ma Y,Cui W,Yang J,et al.SALL4,a novel oncogene,is constitutively expressed in human acute myeloid leukemia of AML and induces AML in transgenic mice[J].Blood,2006,108(8):2726-2735.
[10]Cui W,Kong N R,Ma Y,et al.Differential expression of the novel oncogene,SALL4,in lymphoma,plasma cell myeloma,and acute lymphoblastic leukemia[J].Mod Pathol,2006,19(12):1585-1592.
[11]Zhu Y,Mao Y,Chen H,et al.Apigenin promotes apoptosis,inhibits invasion and induces cell cycle arrest of T24 human bladder cancer cells[J].Cancer Cell Int,2013,13(1):54.
[12]Yin F,Giuliano A E,Law R E,et al.Apigenin inhibits growth and induces G2/M arrest by modulating cyclin-CDK regulators and ERK MAP kinase activation in breast carcinoma cells[J].Anticancer Res,2001,21(1A):413-420.
[13]Al-Baradie R,Yamada K,St Hilaire C,et al.Duane radial ray syndrome(Okihiro syndrome)maps to 20q13 and results from mutations in SALL4,a new member of the SAL family[J].Am J Hum Genet 2002,71(5):1195-1199.
[14]Paradisi I,Arias S.IVIC syndrome is caused by a c.2607delA mutation in the SALL4 locus[J].Am J Med Genet A,2007,143(4):326-332.
[15]郭 野,陈 倩,崔 巍.RNA干扰技术抑制急性白血病细胞THP-1中SALL4基因表达的研究[J].中华检验医学杂志,2010,33(12):1202-1207.
