北京市保健食品企业标准现状及对策研究
2014-10-31北京市保健品化妆品技术审评中心100053佘遥于春媛刘东红
北京市保健品化妆品技术审评中心(100053)佘遥 于春媛 刘东红
保健食品的质量标准由原卫生部、国家食品药品监督管理总局(以下简称国家有关部门)组织行业内相关专家进行技术审评,内容符合相关法律法规及强制标准,结构统一,格式规范,对指导保健食品生产企业生产经营具有重要意义。但由于历任保健食品审批、监管部门均不是当时的食品标准主管部门,因此上述保健食品质量标准的技术审查部门、备案和监管部门不统一,在很大程度上影响了保健食品的监管工作。由省级食品药品监督管理部门负责保健食品企业标准备案工作,能保证由国家有关部门组织技术审评并予以认可的保健食品质量标准或技术要求(以下简称认可的标准)与企业标准相应内容的一致性,从而规范保健食品的生产、经营行为。
1 保健食品企业标准和批准证书的关系
1.1 保健食品企业标准 根据《中华人民共和国食品安全法》(以下简称《食品安全法》)的要求,所有食品都应符合相应的食品安全国家标准或地方标准,没有食品安全国家标准或地方标准,应制定食品安全企业标准。保健食品虽然是一类经过审批的特殊食品,但由于《食品安全法》及其条例实施以来,尚未出台《保健食品监督管理条例》,因此现阶段保健食品的标准还应按照《食品安全法》的规定管理,保健食品生产企业应制定企业标准,作为该产品的食品安全企业标准执行。
1.2 保健食品批准证书 保健食品注册先后由原卫生部、国家食品药品监督管理总局负责,期间上位法由《食品卫生法》过渡为《食品安全法》。因曾出台了《保健食品注册管理办法(试行)》(以下简称《注册管理办法》)并发布了一系列技术审评要求文件,所以保健食品批准证书的形式也存在很大的不同。根据形式的区别,可将保健食品批准证书分为三类:无附件类(I类)、有主要质量标准类(II类)和有技术要求类(III类)。
1.2.1 无附件类(I类) 此类型是保健食品批准证书最初的形态,由于批准此类证书时,保健食品注册工作尚处于起步阶段,因此证书上载明的内容少,缺少监管必须的质量标准或技术要求,甚至部分批准证书存在缺少个别原料等问题,批准证书也未设定有效期。
1.2.2 有主要质量标准类(II类) 此类型是《注册管理办法》实施后保健食品批准证书的形态。与I类批准证书相比,增加了说明书、主要质量标准等内容,并设定了5年的有效期。
1.2.3 有技术要求类(III类) 此类型是《关于印发保健食品产品技术要求规范的通知》发布后保健食品批准证书的形态。与II类批准证书相比,增加了理化、微生物检测方法等内容。
1.3 保健食品批准证书与企业标准内容的异同 保健食品企业标准内容一般包括范围(即原料和工艺环节)、规范性引用文件、技术要求、检测方法、检验规则、标签、标志、运输、贮藏、保质期等。其中包含在批准证书上的内容应与批准证书一致。三类批准证书与企业标准主要异同见附表1。
2 北京市保健食品企业标准现状
通过对北京市食品药品监督管理局已核发的生产类食品卫生许可证情况估算,2013年5月1日前已备案的北京市保健食品企业标准约有700余份。为调查北京市保健食品企业标准的现状,北京市保健品化妆品技术审评中心收集了486份2013年5月1日前已备案的北京市保健食品企业标准(约占总数的54%),并对其进行分析。

附表1 三类批准证书主要异同

附表2 北京市保健食品企业标准技术要求与批件不一致的情况
附表3 北京市保健食品企业标准出厂检验项目制定情况
附表4 北京市保健食品企业标准备案情况一览表
2.1 技术要求中存在的问题 2013年4月~5月,北京市保健品化妆品技术审评中心从收集的486份已备案的标准中选取了143份批准证书附件中带有主要质量要求或技术要求的(II类、III类批准证书)标准,对备案的标准与批准证书附件(以下简称批件)上的相应内容进行对比。其中完全一致的有77份,剩余的66份在原辅料、工艺描述、感官指标、功效/标志性成分指标、理化指标、微生物指标、原辅料质量标准、检验方法等方面不同程度的存在121处不一致,见附表2。
由附表2可见,尽管II类、III类批准证书已将主要质量标准或技术要求连同批准证书一同批准,但依然有大量品种在实际生产经营中改变了国家有关部门审评并认可的标准。
从科学性和严谨性上来看,由国家有关部门认可的标准能够更好地保障保健食品的安全性与功能性,但由于《保健食品管理办法》中未制定保健食品生产者擅自改变产品的质量标准的罚则,故而没有定论。而备过案的企业标准是质量监督部门认可且符合《中华人民共和国标准化法》(以下简称《标准化法》)、《食品安全法》要求的企业生产经营的合法依据,法律关系清晰,却不能保证其内容的科学性和严谨性。这种差异给保健食品监管部门在日常监管中造成了很大困扰。
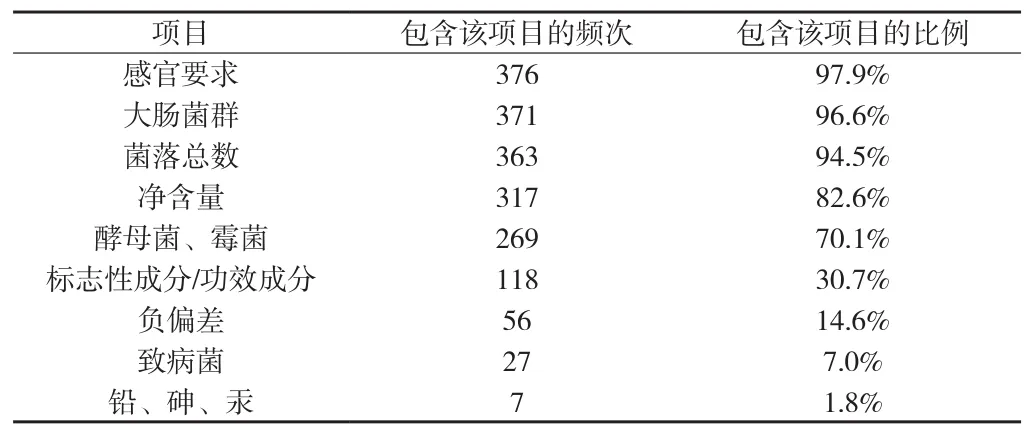
2.2 检验规则中存在的问题 2013年7月北京市保健品化妆品技术审评中心从收集的486份已备案的标准中选取了384份制定了完整的检验规则,对其检验规则进行了统计。结果显示,北京市保健食品企业标准检验规则中的组批规则、抽样规则、出厂检验项目和型式检验频率等都有较大差异。其中,组批规则、抽样规则、型式检验频率因无法律法规或强制性标准的规定,在呈现较大差异性的情况下,无明显的规律。国家强制性标准《保健食品良好生产规范》(GB 17405-1998)中规定了必须逐批次对保健食品成品进行感官、功效因子或主要功效成份、卫生及质量指标的检验,不合格者不得出厂。而统计结果显示,97.9%的企业标准中出厂检验项目包含了感官要求,仅有30.7%的企业标准中出厂检验项目包含了功效/标志性成分指标,结果见附表3。
根据《标准化法》的规定,企业标准应严于国家标准,在既有国家标准又有企业标准的情况下,应执行企业标准。但实际上,在统计的384份企业标准中仅出厂检验项目一项指标就有近七成企业标准不符合国家强制标准。这种情况下,监管人员难以判定企业标准是否准确。
3 北京市保健食品企业标准备案现状
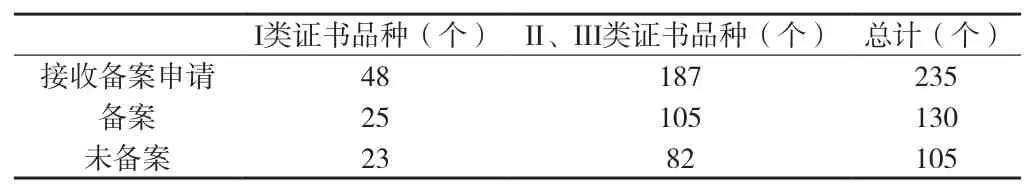
2013年5月1日~2013年12月1日,北京市食品药品监督管理局共接收北京市保健食品企业标准备案申请235份,其中予以备案的130份。见附表4。
北京市保健食品企业标准备案是一个服务类项目,凡符合备案要求的备案申请,都应受理并予以备案。而附表4显示,在接收的235份备案申请中,有45%的申请不符合备案要求,尚未予以备案。未予以备案的申请主要原因是企业标准内容不符合要求,主要包括以下几方面。
3.1 企业标准与国家有关部门认可的标准内容不一致 自1997年原卫生部开始审批保健食品以来,北京市保健食品企业的企业标准一直都在质量监督部门备案,企业会根据生产经营的实际需要随时修改企业标准。附表4结果显示,至少46.2%的企业已经更改了国家有关部门认可的标准内容,但并未向食品药品监督管理部门申请办理保健食品质量标准变更。实际上,企业必须先向食品药品监督管理部门申请办理保健食品质量标准变更,并在国家食品药品监督管理总局批准该变更申请后再办理保健食品企业标准备案。
3.2 国家有关部门认可的标准不符合现行的强制规定 保健食品作为一类特殊的食品,其部分原料标准、大部分理化指标及检测方法、全部微生物指标及检测方法、部分功效/标志性成分指标及检测方法应符合食品安全国家标准和GB16740的要求,部分原料标准、小部分理化指标及检测方法、部分功效/标志性成分指标及检测方法应符合《中华人民共和国药典》(以下简称《药典》)的要求[1],另有部分提取物原料标准、功效/标志性成分指标及检测方法则需由国家有关部门指定。1997年~2013年期间,绝大部分与保健食品有关的食品安全国家标准及《药典》都经历了多次修订,因此存在部分国家有关部门认可的标准不符合现行的强制规定的情况。常见于理化、微生物、功效/标志性成分指标及检测方法不符合现行食品安全国家标准,普通硬胶囊保健食品崩解时限不符合《药典》的要求等。根据国家食品药品监督管理总局食品安全监管三司《关于保健食品监督管理相关问题的复函》(食药监食监三便函[2013]137号)的有关内容,此类情况应办理保健食品质量标准变更。除上述有明确解决方案的情况外,国家有关部门认可的标准不符合《关于含辅酶Q10保健食品产品注册申报与审评有关规定的通知》(国食药监许[2009]566号)等原国家食品药品监督管理局发布的审评规定的及原批准的保健功能不符合现行27项保健功能的情况应如何办理,国家食品药品监督管理总局尚无明确规定。
3.3 国家有关部门认可的标准与保健食品批准证书内容不一致 此类情况常见于I类批准证书产品,如原料名称不一致,原料数量不一致,功效成分指标不一致等。申请人需额外提供保健食品注册时提交的配方、工艺等材料证明不一致的原因,并以保健食品批准证书内容为准办理备案。若申请人提供的材料依然无法证明不一致的原因,须函请国家食品药品监督管理总局核实情况。
4 分析与对策
4.1 已备案标准不符合国家有关部门认可的标准 目前,负责备案的部门是质量监督部门、省级卫生行政部门或省级保健食品监督管理部门。造成至少46.2%已备案的企业标准不符合国家有关部门认可的标准的根本原因为部分不法企业利用了各级监管部门间衔接的漏洞,擅自改变国家有关部门认可的标准,并通过备案使之具有了法律地位。因此,解决该问题的对策之一是为标准备案主管部门开辟信息化平台等渠道,使其可以在很大程度上确保备案的企业标准符合国家有关部门认可的标准,同时填补因多方管理造成的漏洞。
4.2 已备案标准不符合现行法律、法规、强制性标准的规定
4.2.1 已备案标准不符合GB 17405的规定北京市保健食品企业大多规模小,检验技术人员及设备无法满足检验功效/标志性成分指标的需求,这是造成约70%的产品出厂不检功效/标志性成分指标的直接原因。此外,也有部分企业虽然具备检验功效/标志性成分的能力,但因为产品是以多种维生素、矿物质为功效/标志性成分的,逐批检验会造成库存积压,因此未制定逐批出厂检验功效/标志性成分指标的检验规则。从2013年发布的《食品生产通用卫生规范》(GB 14881-2013)和在全球范围内广受认同的HACCP体系内容来看,过程控制的重要性要远远大于成品检验。因此不在出厂时逐批检验技术指标,不应成为判定生产过程不符合要求的依据。同时,国家标准的制定也必须考虑企业实施的能力,要确保合理可行。因此,建议在GB 17405修订时,删除对出厂检验的硬性规定的条款。
4.2.2 已备案标准不符合其他规定 申请人应按照现行法律、法规、强制性标准的规定及时复审,并根据复审结果及时修订已备案的企业标准。各级食品药品监督管理部门、保健食品检验机构也应在监督执法、检验时督促申请人及时办理企标修订。
4.3 申请人主观上不愿办理保健食品质量标准变更 按照《保健食品注册管理办法(试行)》的规定,申请办理保健食品质量标准变更需要进行三批样品的稳定性试验。由于完成试验和行政审批需要一定的时间。因此,申请人主观上不愿办理变更。相应的对策是对因现行法律、法规、强制性标准等规定而改变原辅料标准、检验方法,缩小功效/标志性成分含量区间,扩大不适宜人群、缩小适宜人群、增加注意事项等更改批准证书及其附件内容的,应允许其免做科学性论证,直接予以变更。对其他需要改变质量标准的情况,应允许申请人只做与该次变更有关的指标的稳定性试验,节省申请人的办理变更的时间成本。
5 建议
随着监管队伍逐渐壮大,极大地保障了保健食品行业的健康发展,但也因为监管部门和上位法的频繁变动,使得保健食品行业也存在历史遗留问题,而这些问题无法单纯通过企业标准备案来解决,还需国家食品药品监督管理总局通过出台相应法规、开展相应专项工作解决。
5.1 加强保健食品相关法规、标准的建设
5.1.1 法律法规建设 《中华人民共和国食品安全法》正在进行新一轮的修订。根据征求意见稿的内容,保健食品再次明确了其食品的地位。《保健食品监督管理条例》作为保健食品监管的直接依据,经过多次修改和征求意见,在《食品安全法》开始新一轮修订的时候依然没有出台。现阶段保健食品监管的依据为《保健食品管理办法》,其罚则的上位法《食品卫生法》已经废止,只能套用《食品安全法》等相关条款,对统一食品药品监督管理部门的执法尺度造成了一定的影响。因此,应尽快出台《保健食品监督管理条例》,为保健食品监管提供统一的依据并解决《保健食品管理办法》中可能存在的与现行规定的矛盾。
5.1.2 标准建设 《保健(功能)食品通用标准》(GB 16740)和《保健食品良好生产规范》(GB 17405)分别是1997和1998年实施的,标准中引用的文件、术语都已发生了较大变化,应尽快修订。还应引导科研机构、生产企业及社会团体积极制定适用于保健食品原辅料、检测方法、检验规则的国家标准或行业标准。
5.2 明确《注册管理办法》实施前批准的品种的变更途径 现行的《注册管理办法》第三十四条规定,变更申请是指申请人提出变更保健食品批准证书及其附件所载明内容的申请。由于《注册管理办法》实施前批准的保健食品批准证书不含附件,因此国家食品药品监督管理总局应明确此类品种变更质量标准时是否需要按照《注册管理办法》的规定办理。
5.3 开展“清理换证”专项工作 《注册管理办法》实施前批准的批件,存在辅料及功效/标志性成分信息不完整、保健功能名称与现行功能名称不一致、不包含工艺及技术要求等问题,其中原料信息不完整、部分功效/标志性成分含量未制定上限等已与现行的强制标准不符。因此,必须尽快贯彻《食品安全法》中对声称具有特定保健功能的食品实行严格监管的精神。
