地骨皮醇提液对LPS诱导的大鼠肾脏系膜细胞MCP-1表达的影响
2014-07-02洪秀芳施云福叶真段淑芳
洪秀芳施云福叶 真段淑芳
1浙江医院 杭州 310013 2浙江省立同德医院
3浙江中医药大学附属第一医院 4浙江中医药大学附属第二医院
地骨皮醇提液对LPS诱导的大鼠肾脏系膜细胞MCP-1表达的影响
洪秀芳1施云福2叶 真3段淑芳4
1浙江医院 杭州 310013 2浙江省立同德医院
3浙江中医药大学附属第一医院 4浙江中医药大学附属第二医院
目的观察地骨皮醇提液对脂多糖(LPS)诱导的大鼠肾脏系膜细胞(HBZY-1)单核细胞趋化因子(MCP-1)表达的影响。方法常规培养HBZY-1细胞,将细胞分为正常对照组、单独LPS作用组、药物预处理(低、中、高浓度)+LPS作用组。ELISA法测定细胞上清MCP-1含量,RT-PCR法检测细胞因子MCP-1mRNA表达。结果LPS能够显著提高HBZY-1细胞MCP-1释放量(P<0.01),地骨皮醇提液预处理后,MCP-1含量降低(P<0.05,P<0.01)。LPS能明显激活MCP-1mRNA表达(P<0.01),地骨皮醇提液预处理过后,能明显降低MCP-1mRNA表达(P<0.05,P<0.01)。结论地骨皮醇提液能够抑制LPS诱导的大鼠肾脏系膜细胞(HBZY-1)MCP-1mRNA的表达。
大鼠;肾脏;系膜细胞;MCP-1;地骨皮;LPS
糖尿病肾病(diabetic nephropathy,DN)是糖尿病常见和严重的微血管并发症之一,也是导致慢性肾衰竭(chronic renal failure,CRF)常见病因之一[1-3]。目前临床治疗CRF的主要手段有血液透析和肾移植,但两者均会给患者及社会带来沉重的经济负担,因此,如何延缓或阻止糖尿病肾病的发生发展,有着重大的医学意义。地骨皮具有凉血除蒸、清肺降火、生津止渴作用,被广泛用于消渴症(糖尿病)的治疗[4-5]。本实验通过观察地骨皮醇提液对LPS诱导的大鼠肾脏系膜细胞MCP-1表达的影响,探讨地骨皮醇提液对糖尿病肾病的防治作用及相关机制。
1 材料与方法
1.1 材料与试剂 细胞株HBZY-1(大鼠肾脏系膜细胞)购自上海复蒙基因生物科技有限公司,常规传代保存。地骨皮提取液由浙江医学科学院药物研究所提取。脂多糖:美国Sigma公司产品。DMEM高糖(25mmol/L)培养液美国GIBCO公司产品。新生牛血清(超级):杭州四季青生物工程材料有限公司产品。胰酶、EDTA:上海生工生物工程有限公司产品。3-(4,5-二甲基-2-噻唑)-2,5-二苯基溴化四氮唑盐(MTT):粉剂,上海生工生物工程有限公司产品。RTPCR试剂盒:PrimeScriptTM RT-PCR Kit:Invitrogen公司产品。MCP-1引物、β-Actin:Invitrogen公司产品。ELISA试剂盒:美国ADL公司产品。Tag酶:TAKARA宝生物工程(大连)有限公司产品。
1.2方 法
1.2.1实验分组 常规培养HBZY-1细胞,按每个培养皿3×106将细胞分为正常对照组、单纯LPS作用组、不同浓度药物处理+LPS作用组。①正常对照组:换用含2%胎牛血清的新鲜DMEM高糖培养基(25mmol/L)。②单纯LPS作用组:换用含2%胎牛血清的新鲜DMEM高糖培养基后按10μg/mL加入LPS。③地骨皮醇提液处理+LPS作用组:换用含2%胎牛血清新鲜的DMEM高糖培养基后,分组如下:地骨皮醇提液0.2mg/mL处理+LPS作用组;地骨皮醇提液0.4mg/mL处理+LPS作用组;地骨皮醇提液0.8mg/mL处理+LPS作用组。选取处于对数生长期的HBZY-1细胞,先用不同浓度(0.2mg/mL、0.4mg/mL和0.8mg/mL)地骨皮醇提液预处理细胞4h,然后按照LPS 10μg/mL处理HBZY-1细胞,置于37℃、5% CO2及饱和湿度条件下的培养箱内培养,培养24h,1000rpm×5min离心收集细胞,用PBS洗涤细胞3次,用于各项实验。各组细胞分别设3个平行对照。
1.2.2指标检测 ①MCP-1测定:将已经实验分组并予以药物干预24h的细胞取其上清,通过ELISA法检测细胞上清中MCP-1表达量。②MCP-1 mRNA测定:HBZY-1细胞生长至80%~90%融合后,换用2%新生牛血清DMEM高糖培养基(25mmol/L)同步培养6h后,除正常对照组和单纯LPS作用组外,其余三组加入不同浓度的地骨皮醇提液预孵育4h,除正常对照组外,其余各组按照10μg/mL加入LPS,作用24h,RT-PCR半定量法测定细胞内MCP-1mRNA表达。
1.3统计学方法 应用SPSS17.0统计软件包。计量资料以均数±标准差()表示,组间比较采用单因素方差分析(One-Way ANOVA),以P<0.05为具有统计学意义。
2 结 果
2.1地骨皮醇提液对MCP-1的影响 正常组HBZY-1细胞也会分泌MCP-1,但在LPS诱导下HBZY-1细胞MCP-1分泌量明显增加(P<0.01),经过地骨皮醇提液作用后能显著抑制细胞MCP-1分泌量(P<0.05,P<0.01),其中以0.4mg/mL地骨皮醇提液组作用最为显著(P<0.01),见图1。
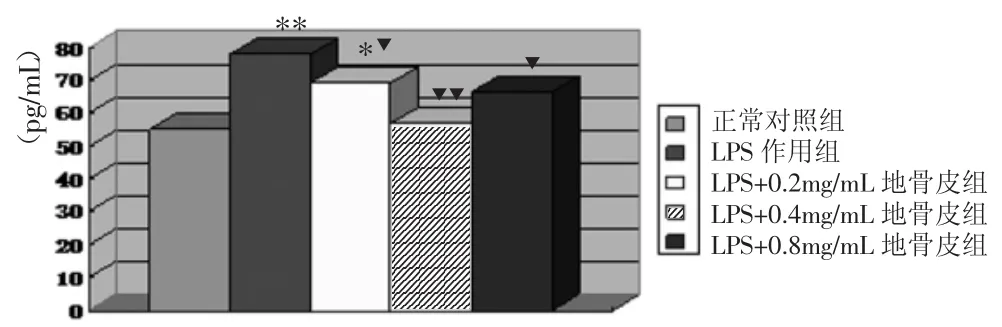
图1 各组HBZY-1细胞分泌MCP-1比较
2.2地骨皮醇提液对MCP-1 mRNA表达的影响
与正常对照组比较,LPS诱导下的HBZY-1细胞MCP-1 mRNA表达增加(P<0.01);地骨皮醇提液作用后能显著抑制细胞MCP-1mRNA的表达(P<0.05,P<0.01),其中以0.4mg/mL地骨皮组醇提液的抑制作用最为明显(P<0.01),见表1。
表1 各组HBZY-1细胞MCP-1mRNA表达比较()
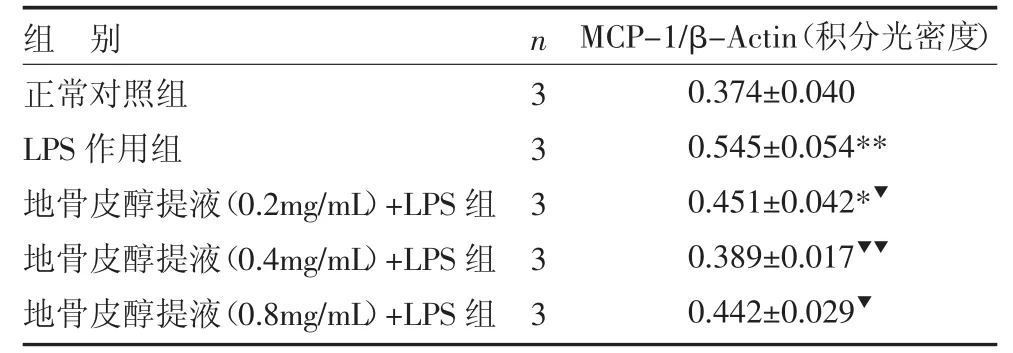
表1 各组HBZY-1细胞MCP-1mRNA表达比较()
注:与正常对照组比较,*P<0.05,**P<0.01;与LPS作用组比较,▼P<0.05,▼▼P<0.01
?
3 讨论
MCP-1属于趋化因子家族,是一些分子量相对较低的蛋白质。MCP-1可由体内多种细胞产生,包括系膜细胞、内皮细胞、平滑肌细胞、单核细胞等,具有趋化并激活单核细胞的功能。正常肾组织多种细胞(如系膜细胞)均能分泌MCP-1,微量MCP-1趋化少量的巨噬细胞吞噬有害物质,从而发挥正常免疫防御作用[6]。当肾组织受到刺激后,其MCP-1mRNA及蛋白质的表达明显增高,趋化并激活大量单核巨噬细胞,活化的巨噬细胞可以通过释放蛋白水解酶和氧活性物质导致肾小球结构损伤,并可释放改变肾小球功能的细胞因子而致肾小球结构重塑[7]。MCP-1还能剂量依赖性地增加白介素-6(interleukin-6,IL-6)和细胞间黏附分子(intercelluar adhesion molecule,ICAM)在肾小管上皮细胞(tubular epithelial cell,TECs)的表达和分泌,ICAM和IL-6可进一步促进单核巨噬细胞在肾组织浸润[8]。MCP-1还以自分泌或旁分泌的方式直接刺激肾小球系膜细胞上调转化生长因子-β1(transforming growth factor-β1,TGF-β1)的表达[9],加速糖尿病肾病肾小球硬化及肾间质纤维化。
地骨皮为茄科落叶灌木植物枸杞Lycium chinensis Mill或宁夏枸杞Lycium barbarum L的干燥根皮,味甘,性寒,归肺、肝、肾经,具有凉血止血、清热退蒸、清泄肺热、清热滋阴、清热解毒的功效,符合2型糖尿病“清热润燥,养阴生津”的治疗大法。临床上常用其单味或复方治疗糖尿病及其并发症。动物实验证明[10]地骨皮能够降低四氧嘧啶所致糖尿病大鼠的血糖,促进肝糖原合成,促进胰岛β细胞分泌胰岛素。研究证明[11-12]地骨皮除降糖作用外,还有降血压、降血脂、清除氧自由基、保护血管内皮细胞、增强机体免疫功能、拮抗炎症反应等作用。本实验前期实验证实[13-14]地骨皮提取液可以降低2型糖尿病肥胖大鼠的体质量,能够改善其糖脂代谢紊乱、保护大鼠肝脏、肾脏,增加胰岛素敏感性。降低血清炎症因子IL-6、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)的水平[15],抑制胰岛素抵抗的低度炎症反应以改善胰岛素抵抗。并发症的研究方面,发现地骨皮提取液可以抑制核因子受体-кB(nuclear factor,NF-кB)的表达[16],降低血清炎症因子水平,减轻过度的炎症反应,明显改善肾脏病理和肾功能。
本研究显示,地骨皮醇提液能抑制高糖环境下LPS致炎后大鼠肾脏系膜细胞MCP-1的表达,这可能是地骨皮防治糖尿病肾病的分子机制之一,但有待进一步研究。
[1]Al-Rohani M.Causes of chronic renal failure at one center in Yemen[J].Saudi Journal of kidney diseases and transplantation,2003,14(1):80-83.
[2]Afshar R,Sanavi S,Salimi J.Epidemiology of chronic renal failure in Iran:a four year single-center experience[J].Saudi journal of kidney dieases and transplantation,2007,18(2):191-194.
[3]Catherine L,James A,Barbara W,et al.Neuropathy among the diabetes control and complications trial cohort 8 years after trial completion[J].Diabetes Care,2006,29:340-344.
[4]国家药典委员会.中华人民共和国药典(2005版)[S].第8版.北京:化学工业出版社,2005:82.
[5]孟协中,席金萍,雷擎宇.中药地骨皮有效成分研究的新进展[J].宁夏医学院学报,1999,21(5):387.
[6]Ruster C,Wolf G.The role of chemokines and chemokine receptors in diabetic nephropathy[J].Front Biosci,2008,13:944-955.
[7]Kiyici S,Erturk E,Budak F,et al.Serum monocyte chemoattractant protein-1 and monocyte adhesion molecules in type 1 diabetic patients with nephropathy[J].Arch Med Res,2006,37(8):998-1003.
[8]Viedt C,Dechend R,Fei J,et al.MCP-1 induces inflammatory activation of human tubular epithelial cells:involvement of the transcription factors,nuclear factor-kappaB and activating protein-1[J].J Am Soc Nephrol,2002,13(6):1534-1547.
[9]Cheng J,Diaz Encarnacion MM,Warner GM,et al.TGF-beta1 stimulates monocyte chemoattractant protein-1 expression in mesangial cells through a phosphodiesterase isoenzyme 4-dependent process[J].Am J Physiol Cell Physiol,2005,289(4):959-970.
[10]汤峰,马小平,陈源根,等.高糖对人类肾小球系膜细胞的影响[J].中华肾脏病杂志,1998,14(3):163-166.
[11]邱红渝,刘晓惠,屈燧林,等.高糖浓度对人肾小球系膜细胞的作用[J].重庆医学,1999,28(6):412-413,443.
[12]魏日胞,陈香美.高糖促进肾小球系膜细胞纤维连接蛋白合成的实验研究[J].解放军医学杂志,2002,27(1):30-31.
[13]王东,叶真,倪海祥,等.地骨皮提取液对2型糖尿病肥胖大鼠糖脂代谢影响的实验研究[J].中华中医药学刊,2010,28(1):210-213.
[14]Ye Z,Huang Q,Ni HX,et al.Cortex Lycii Radicis extracts improve insulin resistance and lipid metabolism in obesediabetic rats[J].Phytotheer Res,2008,22(12):1665-70.
[15]叶真,倪海祥,黄琦,等.地骨皮提取液对糖尿病肥胖大鼠血清炎症因子及抗氧化功能的影响[J].中华临床医师杂志(电子版),2007,1(5):52-55.
[16]杨莉,叶真.地骨皮对2型糖尿病大鼠肾病的防治作用与机制研究[J].中华中医药学刊,2008,26(10):2172-2175.
Effects of Cortex Lycii on the Expression of Monocyte Chemotactic Protein 1 in Murine Renal Mesangial Cells Induced by Lipopolysaccharide
HONG Xiufang1,SHI Yunfu2,YE Zhen3,DUAN Shu-fang4. 1 Zhejiang Hospital, Hangzhou(310013),China;2 Tongde Hospital of Zhejiang Province;3 First Affiliated Hospital of Zhejiang Chinese Medical University;4 Second Affiliated Hospital of Zhejiang Chinese Medical University
ObjectiveTo investigate the effect of ethanol extract of Cortex Lycii on monocyte chemotactic protein 1(MCP-1)expression in lipopolysaccharide(LPS)-induced murine renal mesangial cells(HBZY-1).MethodsHBZY-1 cells were conventionally cultured and divided into three groups:normal cell group,LPS-treated alone group,and Cortex Lycii+LPS-treated group.In a high-glucose condition,HBZY-1 cells were preincubated with different concentrations(0.2,0.4,and 0.8 mg/mL)of Cortex Lycii for 4h and then LPS of 10 μg/mL was added into 3 Cortex Lycii groups and LPS-treated alone group for another 24h.The release amount of MCP-1 in supernatant was detected by ELISA.The expression of MCP-1 mRNA was determined by RT-PCR.ResultsLPS markedly increased the release amount of MCP-1 in supernatant of HBZY-1 cells,but after treated with Cortex Lycii,the amount of MCP-1 decreased(P<0.01).LPS evidently activated the expression of the MCP-1 mRNA in HBZY-1 cells(P<0.01),but the pretreatment with Cortex Lycii decreased the expressions of MCP-1 mRNA(P<0.05,P<0.01).ConclusionCortex Lycii can inhibit the expression of MCP-1 mRNA in HBZY-1 cells induced by LPS.
rats;kidney;mesangial cells;MCP-1;Cortex Lycii;LPS
2013-08-15
