液化法酿造燕麦黄酒工艺条件优化
2014-04-24任贵兴
刘 浩,任贵兴*
(中国农业科学院 作物科学研究所,北京 100081)
燕麦(Avena sativaL.)又名莜麦,为禾本科(Gram-ineae)、早熟禾亚科(Pooideae)、燕麦属(Avena),一年生草本植物,是古老的饲草、饲料及粮食作物[1-2]。按照外稃的性状可分为有稃型的皮燕麦与无稃型的裸燕麦两类,我国以种植裸燕麦为主。燕麦籽粒食用为主,通常认为裸燕麦的营养价值比皮燕麦更高[3]。燕麦是营养与医疗保健价值较高的谷物,蛋白质含量很高,富含可溶性膳食纤维、β-葡聚糖、酚酸、蒽酰胺(avenanthramides)、类黄酮、维生素E等化合物[4]。如此丰富的营养与功能成分使得燕麦及其制品有多种生物活性,如降血脂[5]、降血糖[6]、抗氧化[7]、免疫增强[8]等。燕麦食用加工历史悠久,主要是以燕麦谷物早餐等形式出现[1]。在我国,大部分燕麦用于制粉,进而制作燕麦传统食品(如莜面、栲栳栳)、燕麦面包与饼干[9]等。近年来含有或使用燕麦作为主要原料制作的谷物饮料、豆浆、酸奶等饮品也有出现[10-12]。
黄酒酿造历史悠久,传统酿造工艺历经几千年的不断改进和完善已达到很高的水平,但仍然存在生产周期长、原料利用率不高、人工劳动强度大等缺点。黄酒酿造新工艺在传统工艺的基础上进行改进。液化法是黄酒酿造新工艺的其中一种,基本过程是将原料粉碎后使用酶制剂和微生物进行液化、糖化、发酵,该工艺对于原料的选择范围更广、利用率更高,此外还具有醪液流动性可控、易于机械化生产等优点[13-14]。液化法用于杂粮酒酿造已有相关报道,如苦荞酒[15]、薏米酒[16]、紫薯酒[17]等。
本研究以炒制并磨碎的裸燕麦为原料,以葡萄糖当量值、还原糖含量、固形物含量等作为综合评价指标,通过单因素试验与正交试验对液化法酿造燕麦黄酒的液化、糖化、主发酵工艺条件进行优化,旨在为燕麦黄酒的工业化生产提供参考。
1 材料与方法
1.1 材料与试剂
裸燕麦:取自河北省张家口市农业科学院;耐高温α-淀粉酶(40 000 U/g)、糖化酶(100 000 U/g)均为食品级:江苏瑞阳生物科技有限公司;黄酒活性干酵母、甜酒曲:安琪酵母股份有限公司;氢氧化钠、酒石酸钾钠均为分析纯:西陇化工股份有限公司;3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)、无水亚硫酸钠(分析纯):国药集团化学试剂有限公司;重蒸酚、葡萄糖(分析纯):上海Sigma-Aldrich公司。
1.2 仪器与设备
GTJ-368滚筒式电加热炒货机:青岛德维机械制造有限公司;WK-400A试验室小型高速粉碎机:山东青州精诚机械有限公司;PB602电子天平(感量0.01 g)、PB203电子天平(感量0.001 g):METTLER TOLEDO集团;3FG-01B电热恒温干燥箱:湖北省黄石市医疗器械厂;TD25-WS多管架自动平衡离心机:湘仪离心机仪器有限公司;4802UV/VIS分光光度计:尤尼柯(上海)仪器有限公司;RP-300B人工气候箱:中国南京恒裕电子仪器厂。
1.3 方法
1.3.1 分析方法
还原糖的测定采用DNS法[18]:待测液4 500 r/min离心5 min,取上清液稀释至适宜倍数待测;葡萄糖标准曲线的制备,配制不同葡萄糖含量的反应液,再加入3,5-二硝基水杨酸(DNS)试剂3.5 mL,轻摇混匀,沸水浴10 min显色,冷却后用纯净水定容至20 mL,颠倒混匀。在波长540 nm处比色,以去离子水为空白,测出各管的吸光度值。以吸光度值为纵坐标,葡萄糖含量为横坐标,绘制葡萄糖标准曲线,得到回归方程,计算还原糖含量。
固形物含量的测定参照GB/T 13662—2008《黄酒》中总固形物的测定方法执行,略有改动。吸取稀释至合适倍数的试样5 mL于已知干燥至质量恒定的蒸发皿中,放入(103±2)℃的电热干燥箱中烘干4 h,取出称质量(g),按照下式计算固形物含量。

葡萄糖当量值(dextrose equivalent,DE)值[19]的计算公式:

酒精度、非糖固形物、总糖、总酸、氨基酸态氮、pH值、氧化钙、β-苯乙醇、铅、微生物含量的测定均按照GB/T 13662—2008《黄酒》中的测定方法执行。
1.3.2 传统方法与液化方法酿造燕麦黄酒对比试验设计
分别采用北方黄酒传统酿造工艺与液化工艺进行初步试验,选取籽粒饱满、无霉变、无虫蛀的燕麦,除去杂质,润麦调节水分至25%,平衡12 h。在200~220 ℃炒制20 min,冷却干燥12 h。粉碎机粉碎过40目标准筛,备用。
传统工艺:
炒制燕麦米→浸米12 h→蒸煮→接种→30 ℃前酵→16 ℃后酵→压榨→酒样
液化工艺:
炒制燕麦米→粉碎→加水混匀→耐高温α-淀粉酶液化→糖化酶糖化→接种→30 ℃前酵→16 ℃后酵→压榨→酒样。
两种酿造方法的加水量一致,前发酵每隔12 h 测定一次相对失质量(测定前充分搅拌醪液使气体散出,相对失质量为醪液初始质量减去时间节点时的测定质量),并测定压榨后酒样的酒精度、总糖含量与固形物含量。
1.3.3 燕麦黄酒液化与糖化工艺优化试验设计
液化醪液的DE值控制一般在15%~20%[19-20]。液化DE值低,料液易老化、黏度大、难于操作,也不利于糖化;液化程度过高不利于糖化过程酶与底物形成络合结构,影响催化效率。
液化时间对液化程度的影响,分别称取经过预处理的燕麦粉,料水比1∶3.5混匀,依照酶活与燕麦粉质量之比5 U/g的量加入耐高温α-淀粉酶,混匀后升温至95 ℃分别液化10 min、20 min、30 min、40 min、50 min、60 min,稀释后4 500 r/min离心取上清液,测定还原糖含量与固形物含量,计算DE值。耐高温α-淀粉酶添加量对液化程度的影响试验,酶活与燕麦粉质量之比分别为3 U/g、4 U/g、5 U/g、6 U/g、8 U/g、10 U/g。液化温度对液化程度的影响试验,温度分别为80 ℃、85 ℃、90 ℃、95 ℃、100 ℃。
根据单因素试验所得结果选择合适的水平范围,使用L9(34)正交表,以DE值为指标设计3因素3水平的正交试验确定最优条件组合。
1.3.4 燕麦黄酒糖化工艺优化试验设计
时间对糖化效果的影响:依照酶活与燕麦粉质量之比80 U/g的量加入糖化酶,混匀,60 ℃分别糖化30 min、60 min、90 min、120 min、150 min、180 min、210 min、240 min,稀释后4 500 r/min离心取上清液,测定还原糖含量与固形物含量,计算DE值。糖化酶添加量对糖化效果的影响:酶活与燕麦粉质量之比分别按50 U/g、60 U/g、70 U/g、80 U/g、90 U/g、100 U/g、110 U/g的量加入糖化酶。温度对糖化效果的影响:温度分别为40 ℃、45 ℃、50 ℃、55 ℃、60 ℃、65 ℃、70 ℃、75 ℃。正交试验设计同液化工艺优化。
1.3.5 燕麦黄酒主发酵工艺优化试验设计
据相关文献报道,主发酵时间多集中于3 d[15-17],本试验适当延长发酵时间至5 d,以消耗更多的糖分并促进香气成分的产生。
调整燕麦粉与水的质量之比1∶2.5、1∶3.0、1∶3.5、1∶4.0、1∶4.5,接种酵母量为燕麦粉质量的0.15%,30 ℃分别发酵5 d,醪液4 500 r/min离心取上清液,测定酒精度。酵母接种量对主发酵结果的影响:接种酵母量为燕麦粉质量的0.10%、0.15%、0.20%、0.25%、0.30%。温度对主发酵结果的影响:发酵温度为25 ℃、27 ℃、30 ℃、33 ℃、35 ℃。在单因素试验基础上,使用L9(34)正交表,以酒精度为指标设计正交试验确定最优条件组合。
1.3.6 数据处理方法
测定试验均重复两次,结果为平均值的方式表示。使用OEA3.1软件进行正交试验设计,SAS 9.1进行数据处理。
2 结果与分析
2.1 传统方法与液化方法酿造燕麦黄酒对比试验
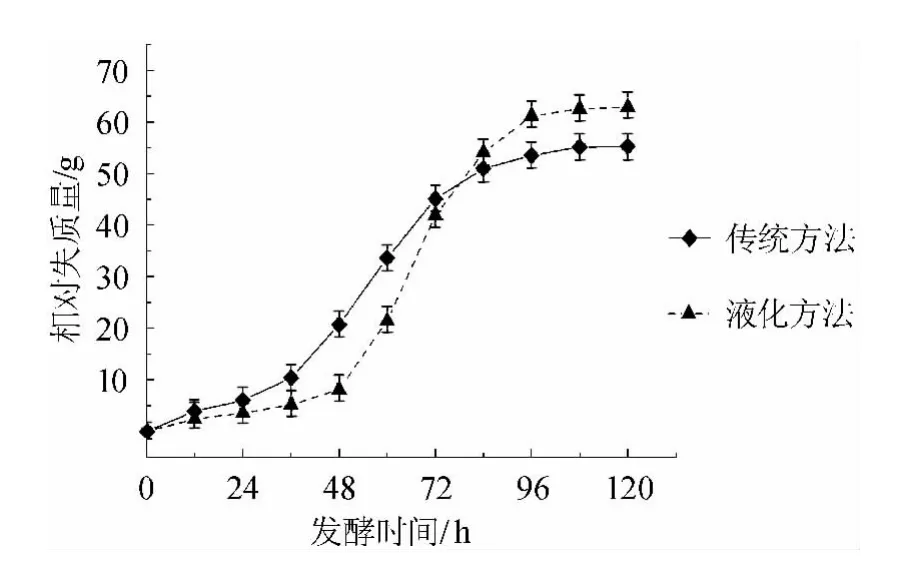
图1 传统方法与液化方法的发酵曲线Fig.1 Fermentation curves of traditional method and liquefaction method
前发酵过程中醪液的相对失质量测定结果见图1,醪液的相对失质量能表征发酵的速度与最终原料利用率。由图1可以看出,液化法起初的发酵速度较慢,这可能是因为前处理过程中淀粉糖化、液化程度较高,使得醪液糖度较高,对发酵母增殖起到抑制作用。但抑制作用解除后,液化发酵速率明显加快(图1中段),且高于传统方法。从终点的相对失质量来看,液化法酿造对原料的利用率要比传统方法高。同时对两种方法得到的酒样测定结果表明,液化法酒样的酒精度(12.6±0.1)%vol与总固形物(52.8±2.0)g/L含量明显高于传统方法(11.1±0.3)%vol,(47.0±0.8)g/L,但液化法酒样总糖含量(19.6±0.3)g/L却低于传统方法(23.7±0.4)g/L,这说明液化法酿造黄酒有更高的原料利用率。
2.2 液化法酿造燕麦黄酒最佳液化工艺条件的确定
2.2.1 液化时间对液化程度的影响
液化时间对液化程度的影响结果见图2。由图2可知,液化开始时首先是淀粉酶分解直链淀粉产生寡糖,此酶促反应速度较快。而后淀粉酶作用于支链淀粉,同时使得部分寡糖水解,但此时酶解产物的积累与1,6-糖苷键相对比例的增大会使得酶促反应速度下降[21]。由图2可以看出,还原糖含量的增加速度比干物质含量增加的速度要快,30 min时DE值达到最大,但是此时的还原糖含量却没有达到最大值。而当40 min以后DE值虽稍有降低,但还原糖的含量平稳,干物质量略有升高。因此选择30~50 min作为较优液化时间。

图2 液化时间对液化程度的影响Fig.2 Effect of time on liquefaction degree
2.2.2 耐高温α-淀粉酶添加量对液化程度的影响
耐高温α-淀粉酶添加量对液化程度的影响结果见图3。由图3可知,在酶促反应中,底物浓度足够高时,酶促反应速度随着酶添加量的增加而提高[22]。由图3可知,随着酶添加量的增大,还原糖与干物质含量均有升高。当液化醪液化程度(DE值)控制在15%~20%时,利于后续液化与发酵。酶添加量>5 U/g时,DE值上升过快,不利于生产控制。因此选择3~5 U/g作为较优淀粉酶添加量。
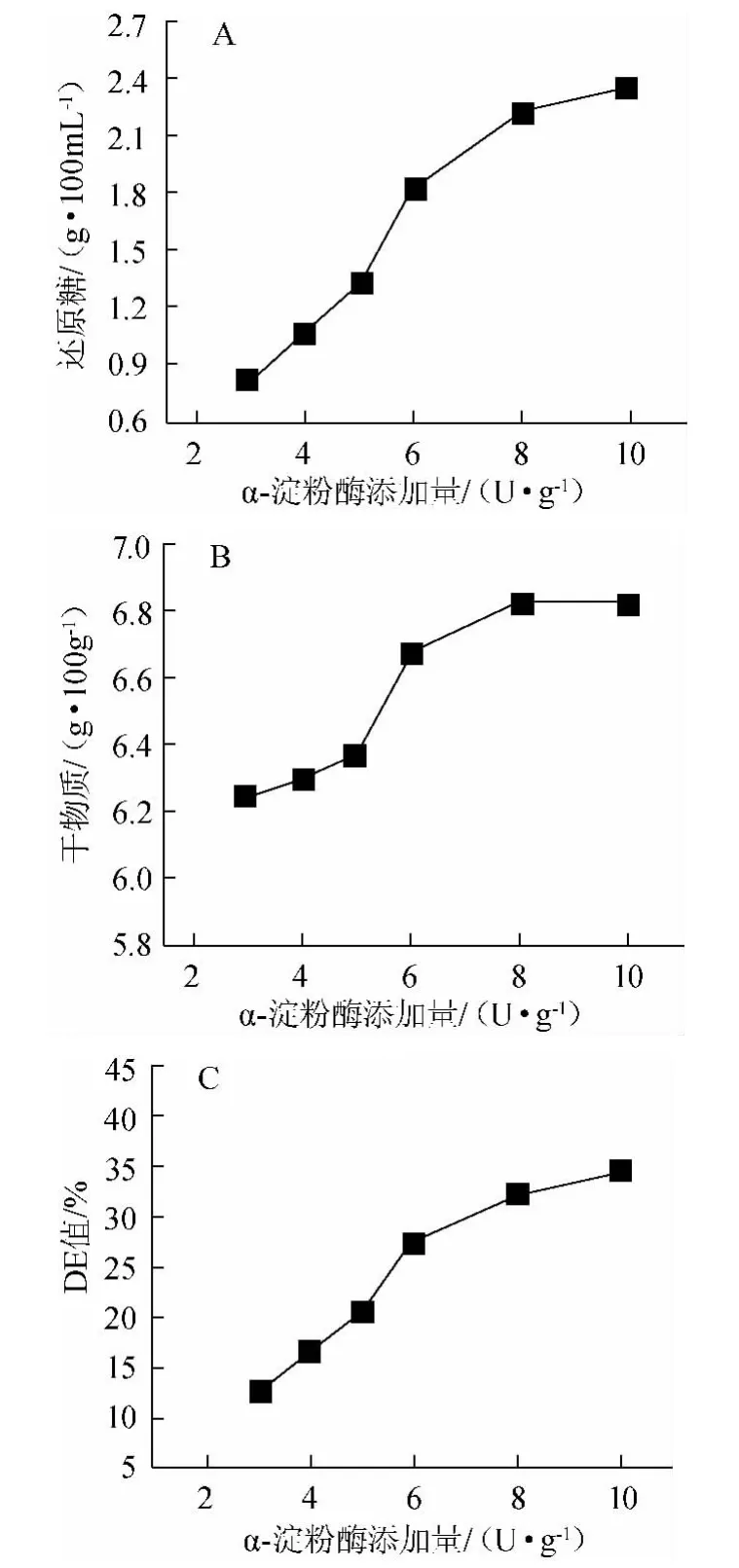
图3 耐高温α-淀粉酶酶添加量对液化程度的影响Fig.3 Effect of thermostable α-amylase addition on liquefaction degree
2.2.3 液化温度对液化程度的影响
液化温度对液化程度的影响见图4。由图4可知,在一定温度内,酶促反应速度随温度的升高而增快,至最适反应温度后,继续升高温度会造成部分酶的失活,使反应速度下降[22]。由图4可知,在温度>95 ℃后还原糖含量有所降低;但干物质含量随着温度的升高而增大;在95 ℃时DE值最高,因此得到最适液化温度为90~100 ℃。
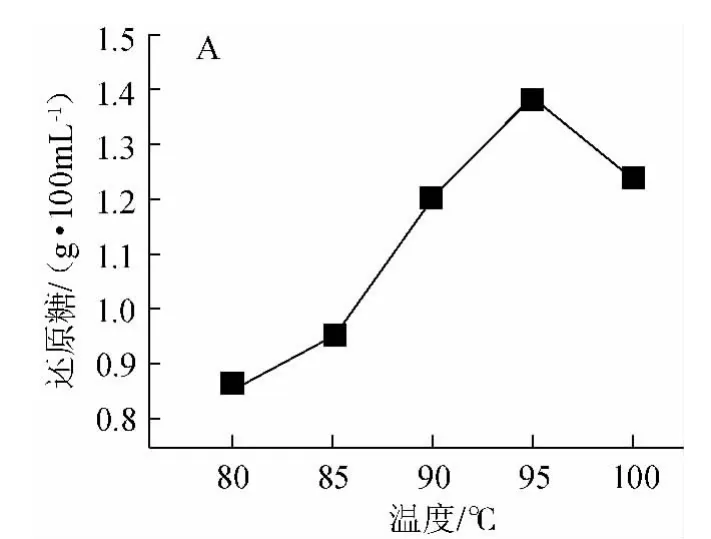
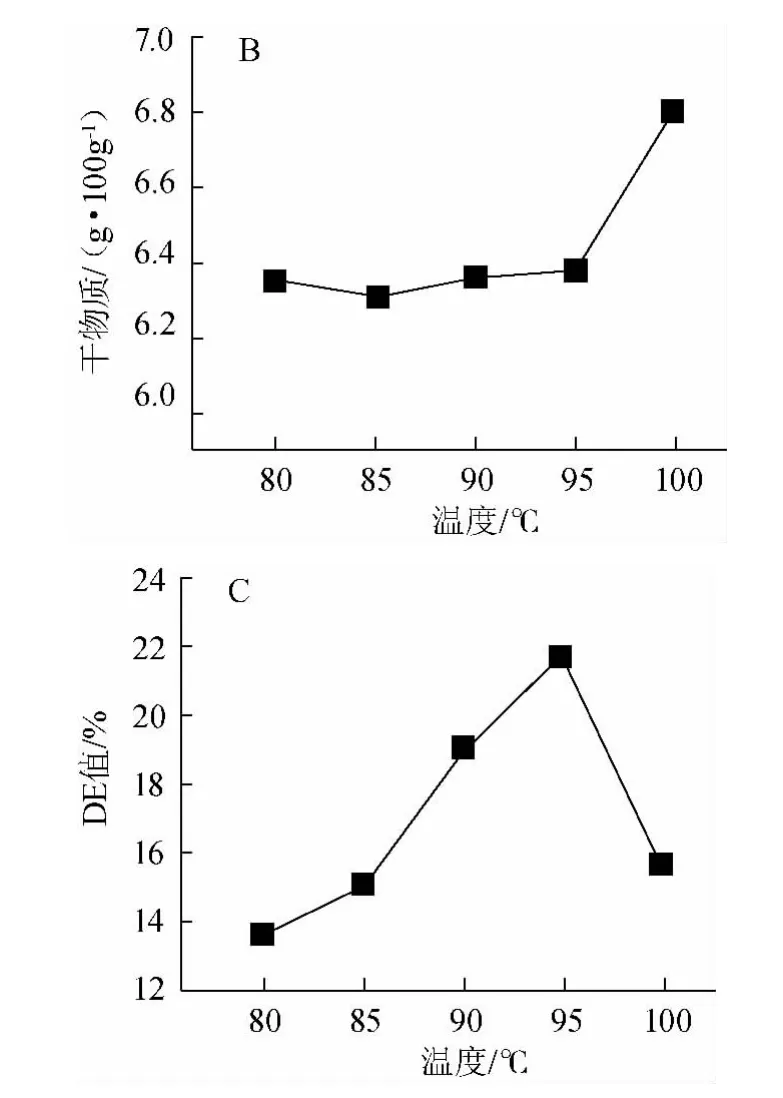
图4 温度对液化程度的影响Fig.4 Effect of temperature on liquefaction degree
2.2.4 液化条件正交试验优化
根据单因素试验所得结果选择合适的水平范围,使用L9(34)正交表,以DE值为指标设计正交试验确定最优液化条件组合。其试验设计与结果见表1,方差分析见表2。
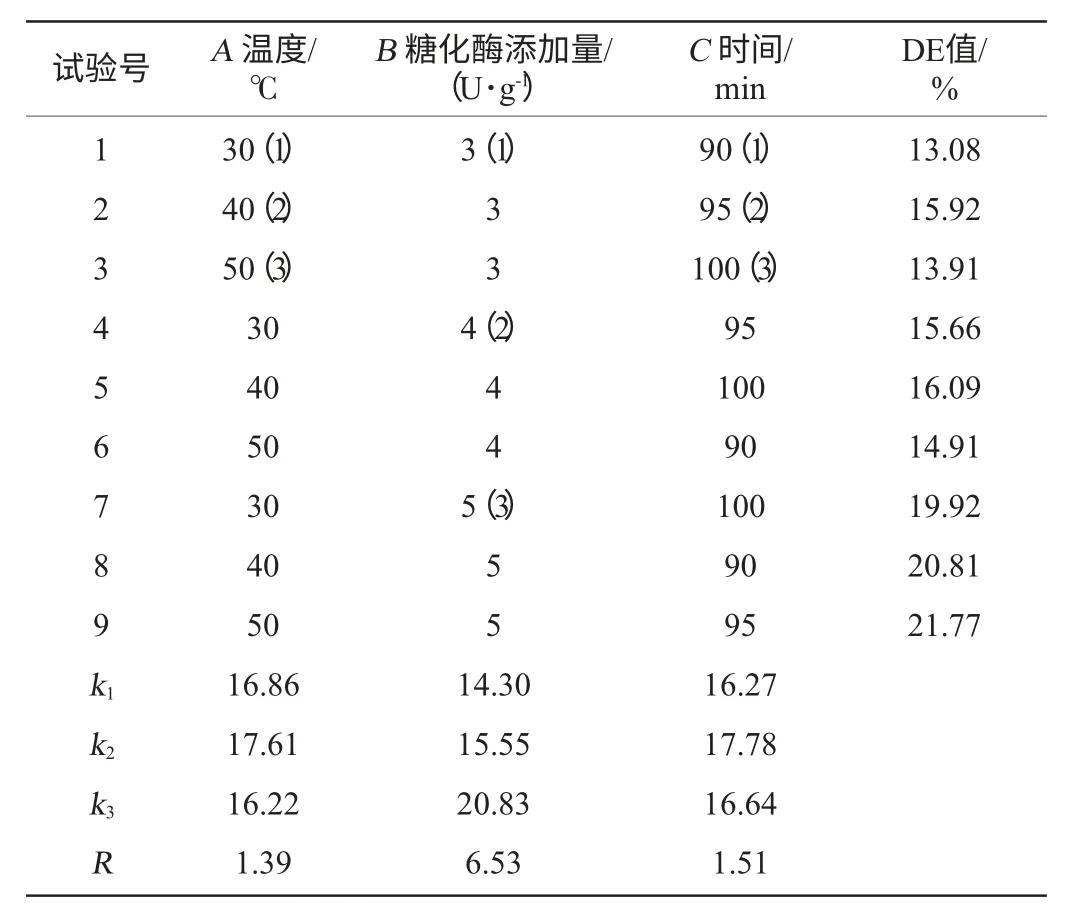
表1 液化条件优化正交试验设计与结果Table 1 Design and results of orthogonal test for liquefaction conditions optimization
由表1与表2可以看出,液化条件对于液化程度的影响均显著(P<0.05),主次顺序为酶添加量>温度>时间。由正交试验得到的最佳组合为A2B3C2。即液化温度95 ℃、液化酶添加量5 U/g、液化时间40 min,在此条件下进行验证试验,DE值为21.96%。
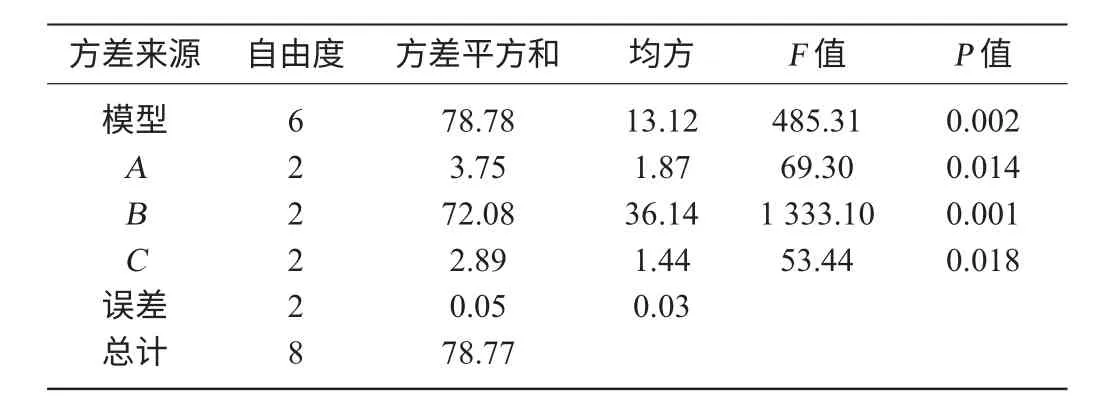
表2 液化正交试验结果方差分析Table 2 Variance analysis of liquefaction orthogonal tests results
2.3 液化法酿造燕麦黄酒最佳糖化工艺条件的确定
2.3.1 糖化时间对糖化程度的影响
糖化时间对糖化效果的影响见图5。由图5可知,150 min之前糖化醪的还原糖含量随时间的推移而升高,在150 min后变化不大,趋于平缓,180 min后基本达到稳定。DE值的变化趋势与之类似。为保证糖化质量,选取120~180 min作为较优糖化时间。
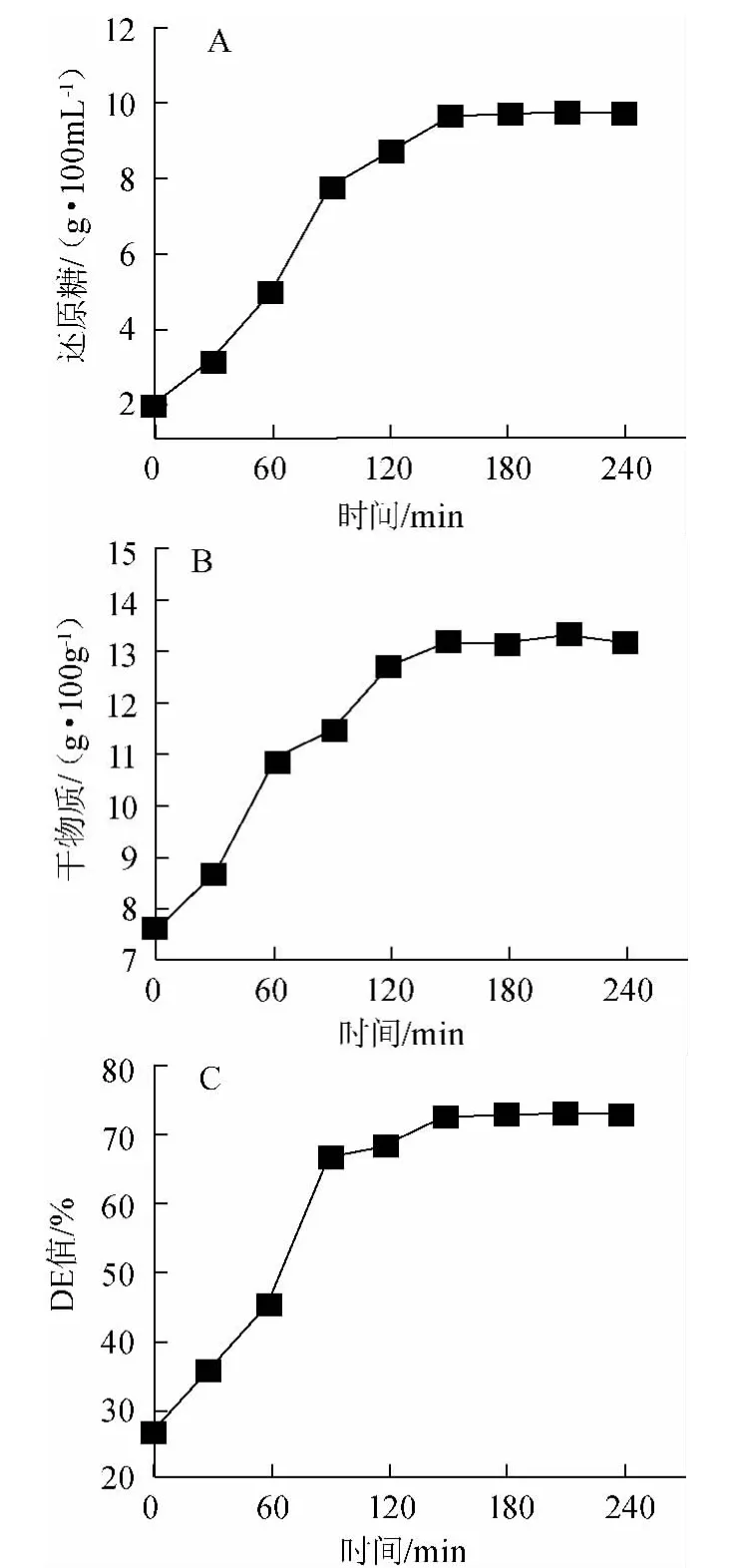
图5 糖化时间对糖化效果的影响Fig.5 Effect of time on the saccharification
2.3.2 糖化酶添加量对糖化程度的影响
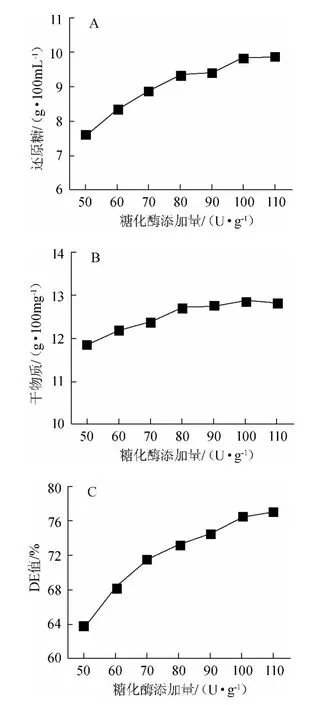
图6 糖化酶添加量对糖化效果的影响Fig.6 Effect of glucoamylase addition on the saccharification
糖化酶添加量对糖化程度的影响见图6。由图6可知,底物浓度足够高时,酶促反应速度与酶添加量存在正相关关系。糖化酶添加量为110 U/g时,与糖化酶添加量100 U/g时相比,DE值略有升高但还原糖含量没有明显差异,同时兼顾成本因素,确定80~100 U/g为较优糖化酶添加量。
2.3.3 温度对糖化程度的影响
温度对糖化程度的影响见图7。温度能显著影响酶促反应,在适宜的温度范围内,酶促反应随着温度的升高加快,至最适反应温度时到达最快。若温度继续升高,会导致酶失活,使得酶促反应速度降低。由图7可知,还原糖含量、干物质含量与DE值在温度≤65 ℃范围内逐渐升高,但>65 ℃后糖化酶失活严重,三个指标均降低,均因此确定最适反应温度为60~70 ℃。
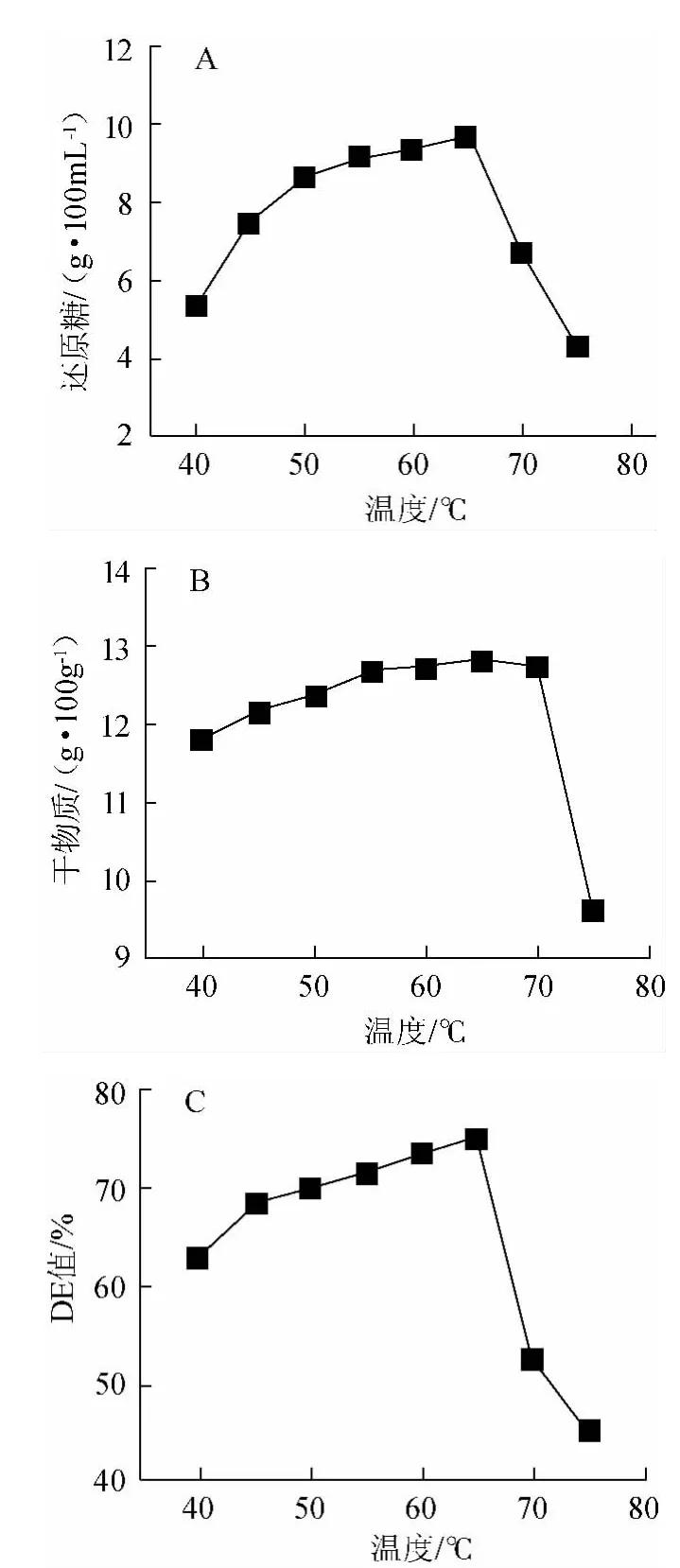
图7 糖化温度对糖化效果的影响Fig.7 Effect of temperature on saccharification
2.3.4 糖化条件优化正交试验
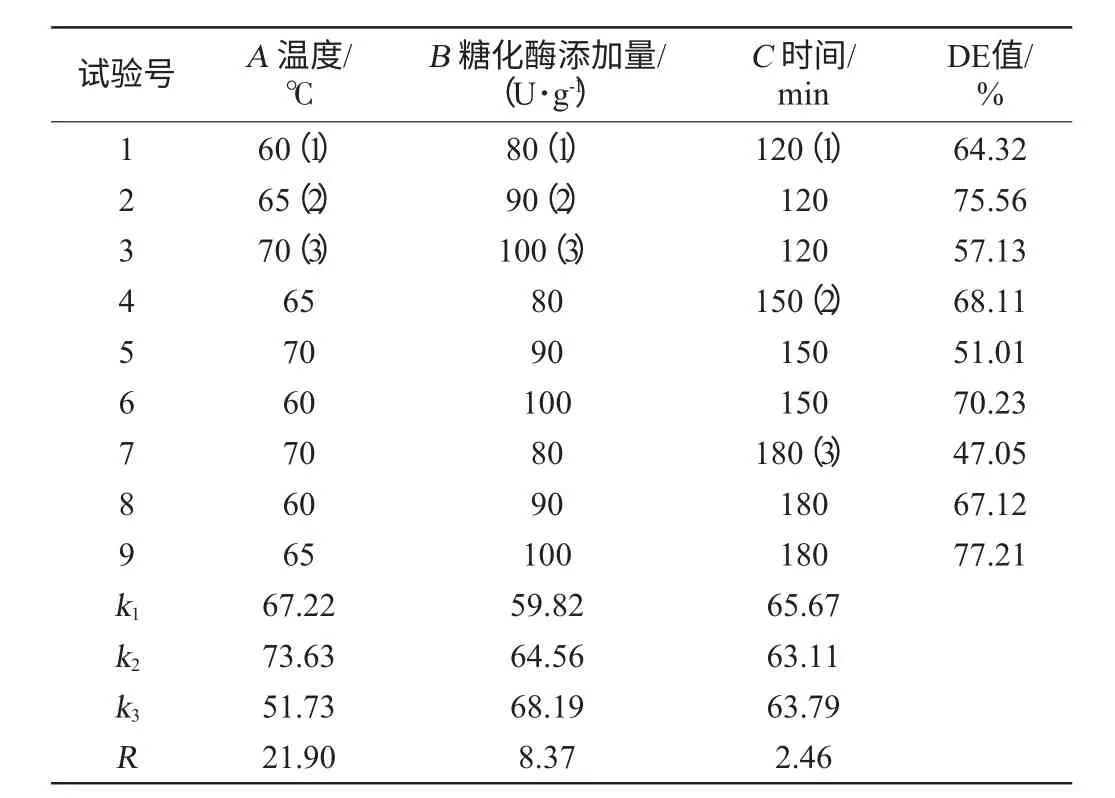
表3 糖化条件优化正交试验设计与结果Table 3 Design and results of orthogonal test for saccharification conditions optimization
根据单因素试验所得结果选择合适的水平范围,使用L9(34)正交表,以DE值为指标设计正交试验确定最优糖化条件组合。试验设计与结果见表3,方差分析见表4。
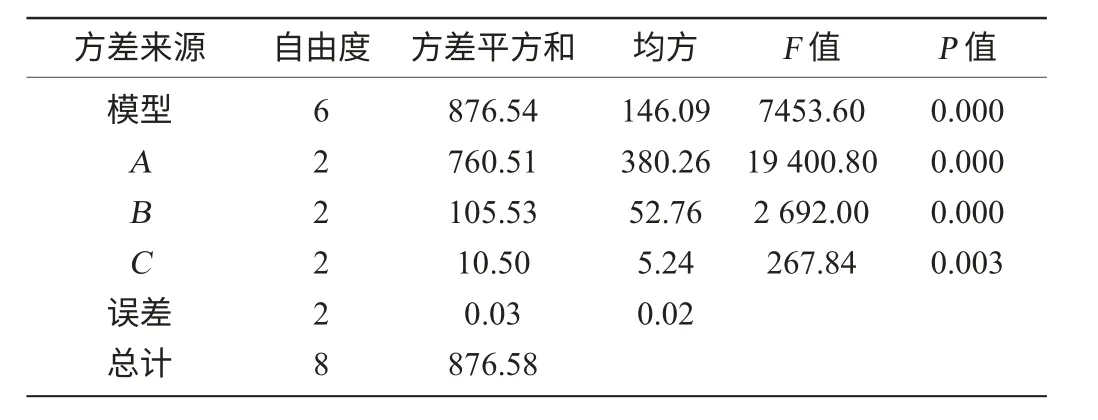
表4 糖化条件正交试验结果方差分析Table 4 Variance analysis of saccharification orthogonal tests results
由表3、表4可以看出,糖化条件对糖化程度均有极显著的影响(P<0.01),主次顺序为温度>糖化酶添加量>时间。由正交试验直观分析得到的最佳组合为A2B3C3。即温度65 ℃,糖化酶添加量100 U/g,时间180 min,此时DE值为77.21%。
2.4 主发酵条件优化正交试验
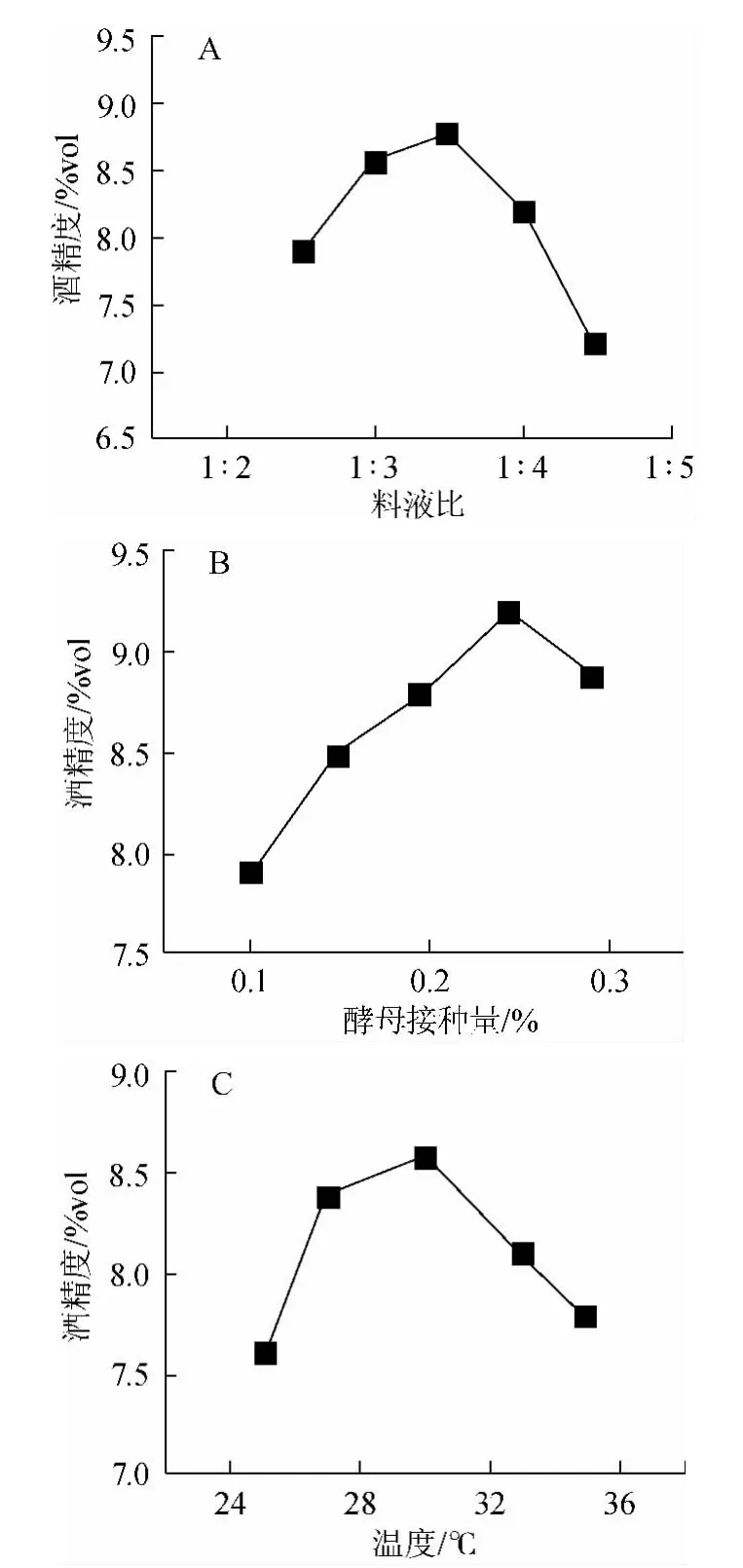
图8 料液比(A)、酵母接种量(B)与发酵温度(C)对酒精度的影响Fig.8 Effect of material to water ratio(A),yeast inoculum(B) and fermentation temperature(C) on alcohol content
2.4.1 主发酵条件优化单因素试验
主发酵条件优化单因素试验结果见图8。随着料液比、酵母接种量和温度的增加,酒精度均呈先上升后下降的趋势。由图8可知,料液比对醪液酒精度有明显影响。加水量较少时,酒精度较低,是因为发酵程度不够,原料未得到充分利用,酒精转化效率低。加水量较多时,由于稀释作用,酒精度也很低,因此确定最佳料液比为1∶3.5;酵母接种量对酒精度的影响极为明显。酵母接种量较少,原料不能充分发酵;酵母接种量过大则会使得酵母繁殖过快,将部分糖用于自身生长,使酒精度偏低,因此确定最佳酵母接种量为0.25%;当温度较低时,酵母代谢与繁殖均会很慢。当温度很高时,酵母代谢与繁殖速率过快,这会导致酵母老化。因此确定最佳主发酵温度为30 ℃。
2.4.2 主发酵条件优化正交试验结果
根据单因素试验所得结果,以酒精度为指标设计正交试验确定主发酵最优条件组合。试验设计与结果见表5,方差分析见表6。
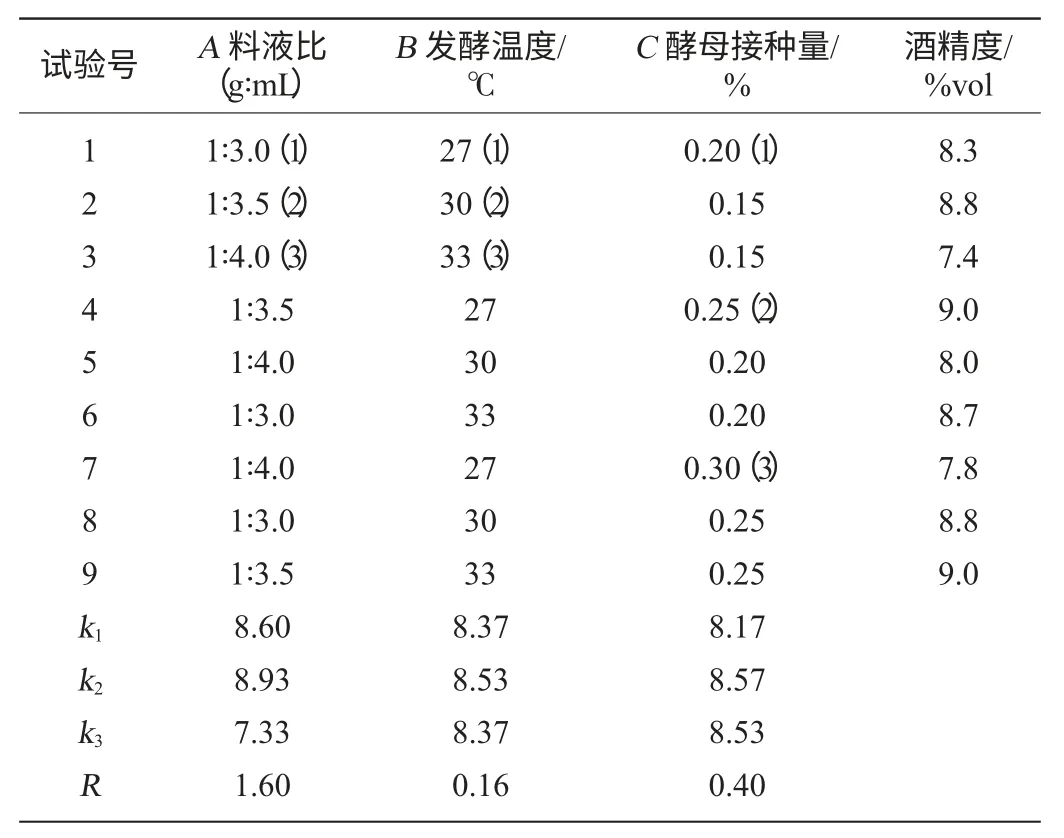
表5 主发酵条件优化正交试验设计与结果Table 5 Design and results of orthogonal test for main fermentation conditions optimization
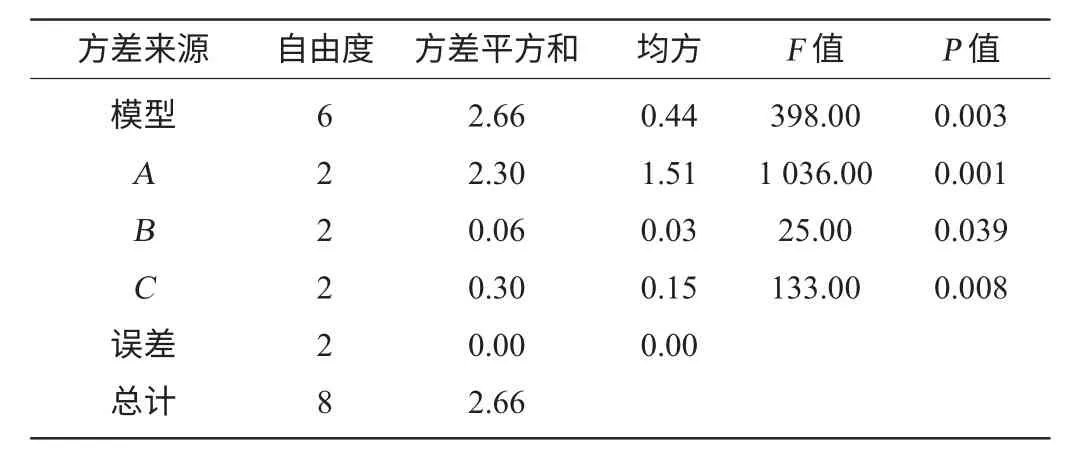
表6 主发酵条件正交试验结果方差分析Table 6 Variance analysis of main fermentation orthogonal tests result
由表5、表6可以看出,料液比、酵母接种量与发酵温度对酒精度均影响显著(P<0.05),其中料液比和酵母接种量达到了极显著水平(P<0.01),影响大小顺序为料液比>酵母添加量>温度。分析得到最佳条件组合为A2B2C2,即料液比1∶3.5、酵母添加量0.25%、发酵温度30 ℃,在此条件下进行验证试验,酒精度为9.2%vol,发酵结束后的残糖量为10.19 mg/mL。
2.5 最佳工艺条件下燕麦黄酒酿造试验结果
最佳酿造工艺条件下,再经过16 ℃、30 d的后发酵,压榨得到的燕麦黄酒呈橙黄色,清亮透明,口味醇和爽口,但有区别于普通稻米黄酒的燕麦发酵特殊香气。具体品质指标测定结果及国标范围见表7。由表7可知,在最佳工艺条件下,黄酒酒样分析结果符合国家标准的各项要求。
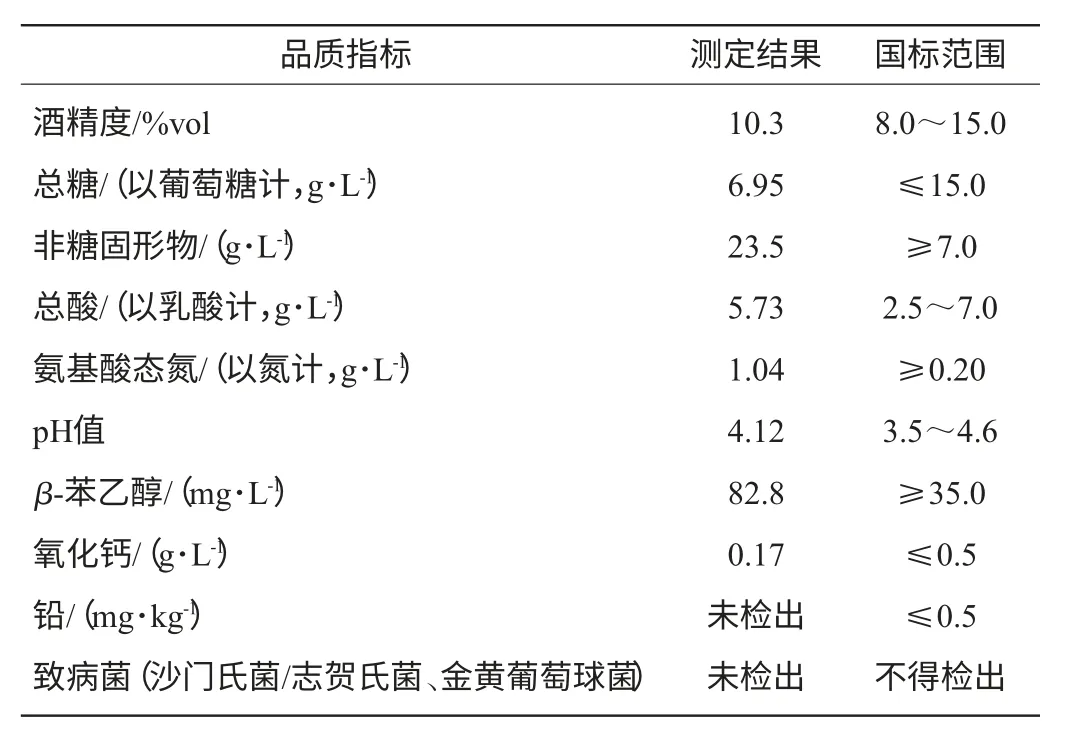
表7 最佳工艺条件下燕麦黄酒品质指标Table 7 Basic quality indicators of Chinese oat rice wine under the optimal conditions
3 结论
通过单因素与正交试验确定了燕麦黄酒的最佳工艺条件,即最佳液化工艺条件为耐高温α-淀粉酶添加量为5 U/g、液化温度95 ℃、液化时间40 min;最佳糖化条件为糖化酶添加量100 U/g、糖化温度65 ℃、糖化时间180 min;最佳主发酵工艺条件为料液比1∶3.5、发酵温度30 ℃、酵母添加量为0.25%、发酵时间5 d。在此条件下,16 ℃稳定30 d后得到燕麦黄酒。酒样分析结果符合国家标准的各项要求。本研究及结果可为燕麦黄酒工业化生产提供理论依据。
[1]周素梅,申瑞玲.燕麦的营养及其加工利用[M].北京:化学工业出版社,2009.
[2]XU J G,TIAN C R,HU Q P,et al.Dynamic changes in phenolic compounds and antioxidant activity in oats (Avena nudaL.) during steeping and germination[J].J Agr Food Chem,2009,57(21):10392-10398.
[3]BIEL W,BOBKO K,MACIOROWSKI R.Chemical composition and nutritive value of husked and naked oats grain[J].J Cereal Sci,2009,49(3):413-418.
[4]SINGH R,DE S,BELKHEIR A.Avena sativa(Oat),a potential neutraceutical and therapeutic agent:an overview[J].Criti Rev Food Sci Nutr,2013,53(2):126-144.
[5]TRUSWELL A S.Cereal grains and coronary heart disease[J].Eur J Clin Nutr,2002,56(1):1-14.
[6]TAPPY L,GÜGOLZ E,WÜRSCH P.Effects of breakfast cereals containing various amounts ofβ-glucan fibers on plasma glucose and insulin responses in NIDDM subjects[J].Diabetes care,1996,19(8):831-834.
[7]XU W,ZHANG Z W,WU B,et al.Genetic diversity in naked oat(Avena nuda)germplasm revealed by AFLP markers[J].Acta Agronomica Sinica,2009,35(12):2205-2212.
[8]BOISNIC S,BRANCHET M C,ERMOSILLA V.Healing effect of a spray containing Rhealba oat colloidal extract in an in vitro reconstitution model of skin[J].Int J Tissue React,2004,27(3):83-89.
[9]胡新中.燕麦食品加工及功能特性研究进展[J].麦类作物学报,2005,25(5):122-124.
[10]任长忠,胡新中.中国燕麦产业发展报告2010[M].西安:陕西科学技术出版社,2011.
[11]汪建国,沈玉根,黄炎远,等.燕麦红曲黄酒的研制[J].中国酿造,2013,32(2):152-154.
[12]涂 璐,王爱莉,李再贵.燕麦红曲黄酒多酚含量及抗氧化性研究[J].中国酿造,2012,31(1):43-45.
[13]谢广发.黄酒酿造技术[M].北京:中国轻工业出版社,2010.
[14]王 梅,赵光鳌,帅桂兰,等.液化法酿造黄酒的研究[J].酿酒,2003,29(2):93-95.
[15]陈佳昕,赵晓娟,吴 均,等.液态法苦荞酒工艺条件的优化[J].食品科学,2013,34(20):180-192.
[16]郭克娜,姜璐璐,阚建全.薏米酒发酵前淀粉液化及糖化条件的优化[J].食品科学,2013,34(5):197-201.
[17]杨雅利,阚建全,沈海亮,等.紫甘薯酒发酵工艺条件的优化[J].食品科学,2012,33(3):157-162.
[18]韩德权,章佳佳.DNS 法在普鲁兰多糖发酵液中糖测定的研究[J].食品工业科技,2008(2):285-286.
[19]吴秀媛.啤酒酿造过程所用辅料大米糊化,液化工艺研究[J].啤酒科技,2006(4):55-56.
[20]颜怀伟.大米直接磨浆酶液化酸糖化主发酵提取酒精生产燃料酒精方法:中国,CN1958804 B[P].2010-06-23.
[21]张国权,史一一,魏益民,等.荞麦淀粉耐高温α-淀粉酶液化工艺条件研究[J].中国粮油学报,2009,23(3):73-77.
[22]郭 勇.酶工程[M].北京:科学出版社,2009.
