自然发酵乳及传统开菲尔粒中酵母菌的多样性研究
2014-03-11李艳,范佳
李 艳,范 佳
(1.河北科技大学生物科学与工程学院,河北石家庄 050018;2.河北省发酵工程技术研究中心,河北石家庄 050018)
自然发酵是借助于环境中的微生物使牛乳发酵,将糖与蛋白质等物质转化为乳酸、酒精等其他风味物质。自然发酵中的酵母菌不仅对乳糖的利用和蛋白质的分解起重要的作用,同时可与乳酸菌有共生作用产生丰富的氨基酸与醇类物质[1]。开菲尔粒是开菲尔的传统发酵剂,是多种微生物的互生体系,主要由乳酸菌、酵母菌和醋酸菌等构成[2]。乳酸菌分解乳糖产生葡萄糖和半乳糖,促使酵母菌生长而引起乙醇发酵并产生CO2
[3];酵母菌的生长繁殖为乳酸菌和醋酸菌的生长起促进作用。开菲尔粒特殊的菌群构成赋予了开菲尔制品特殊的口感和香气风味特征[4]。开菲尔制品中含有50%的黏性多糖(m(葡萄糖)∶m(半乳糖)=1∶1)、少量脂肪、蛋白质、水和其他成分[5]。开菲尔粒中酵母菌的种类和数量致使发酵乳制品的品质不同,当乳糖发酵型酵母菌数达到105CFU/m L时,才能赋予乳制品特有的乳酒风味。2000年,GADAGA等从津巴布韦传统发酵乳中分离出酿酒酵母、假丝酵母等多种酵母菌[6]。2010年,FADDA等从撒丁岛山羊乳中分离出诞沫假丝酵母[7]。目前,中国对于发酵型乳制品微生物的研究大多为乳酸菌,研究可发酵低度乳酒酵母菌的文献较少。本研究是从自然发酵乳和内蒙古牧区传统发酵剂开菲尔粒中分离筛选酵母菌,并进行酵母菌的形态聚类和分子鉴定,探寻酵母菌的多样性和主要菌群的种属类型,为筛选可发酵低度乳酒的酵母菌奠定基础。
1 实验材料与方法
1.1 实验原材料
1.1.1 原料
1)市售鲜牛乳:购于河北省石家庄市南栗村农户;
2)商品灭菌乳:购于河北科技大学大学商城国大超市,分别由伊利、蒙牛和君乐宝乳业公司生产;
3)开菲尔粒:取自内蒙古牧区牧民家中,4℃冰箱贮存于灭菌牛乳中。
1.1.2 培养基
YEPD 培养基,WL培养基[8]。
1.1.3 试剂
TaqDNA聚合酶,d NTP,限制性内切酶HinfⅠ,HaeⅢ和CofⅠ,合成引物:引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)均购于上海生工生物工程技术服务有限公司。
1.2 仪器与设备
YXQ-LS-50SII立式压力蒸汽灭菌器(上海博迅实业有限公司医疗设备厂);SW-CJ-1BU洁净工作台(苏州安泰空气技术有限公司);DP-200生化培养箱(广东省医疗器械厂);QL-901漩涡振荡器(江苏海门市其林贝尔仪器制造有限公司);S1000 PCR扩增仪、XR+凝胶成像分析仪(北京元业伯乐科技发展有限公司);DYY-8C型稳压稳流电泳仪、DYCP-310水平式电泳槽(北京市六一仪器厂);XS-212-202双目显微镜(JMOEC)配有单反相机D5100(尼康映像仪器销售有限公司)。
1.3 实验方法
1.3.1 样品预处理与酵母菌的分离
1.3.1.1 自然发酵乳的制备与酵母菌的分离
以鲜牛乳为对照样,分别将商品灭菌乳和鲜牛乳各20 m L置于100 m L三角瓶内进行发酵为1号样;用柠檬酸调节p H值至4.5后再发酵为2号样;用柠檬酸调节p H值至4.5并添加2 g蔗糖后再发酵为3号样。发酵条件为28℃,3~4 d。分别取发酵后的样品1 m L进行10倍梯度稀释,取稀释梯度为10-3~10-5的稀释菌液0.2 m L(菌落数控制在30~300 CFU/m L)涂布于YEPD培养基中,28℃恒温培养24~48 h[9],每个样品做3个平行。依据菌落观察挑取不同形态的酵母菌再划线于新鲜的WL培养基上,进行纯化培养,将分离得到的酵母菌用25%(体积分数)甘油冷冻保藏于-20℃冰箱,备用。
1.3.1.2 开菲尔粒的活化与酵母菌分离
开菲尔粒→加入灭菌牛乳→28℃培养24 h→过滤→再加入灭菌牛乳→28℃培养24 h,连续活化3次[10]。
取活化增殖培养后的开菲尔粒1 g,于10 m L无菌生理盐水中研磨,再取1 m L样品进行10倍梯度稀释,取稀释梯度为10-4~10-6稀释菌液0.2 m L(菌落数控制在30~300 CFU/m L)涂布于YEPD培养基中,28℃恒温培养24~48 h,每个稀释度做3个平行。酵母菌分离和纯化的方法与自然发酵乳相同。
1.3.2 酵母菌的形态聚类分析
酵母菌的形态聚类采用菌落形态和细胞显微形态结合分析的方法。将冷冻保藏的酵母菌取出活化,再将单菌落划线于WL培养基上28℃培养4 d。依据菌落和细胞形态的不同特征予以区分。菌落特征包括:菌落形态、色泽、湿润程度、表面是否光滑、边缘是否整齐等。细胞显微特征包括:细胞形状、大小、生长繁殖方式、是否有假菌丝等。
1.3.3 酵母菌的分子鉴定
1.3.3.1 酵母菌DNA提取
酵母菌DNA提取采用SDS裂解法[11]。
1.3.3.2 酵母菌5.8S r DNA-ITS区PCR扩增及反应程序
PCR反应体系(50μL):引物ITS1 (5′-TCCGTAGGTGAACCTGCGG-3′)、引物ITS4(5′-TCCTCCGCTTATTGATATGC-3′)各2μL;d NTP 1μL;Colorless Go Taq Reaction Buffer 10μL;TaqDNA 聚合酶0.35μL;模板DNA 1μL;双蒸水33.65μL。
PCR反应程序:95℃预变性7 min;95℃变性1 min,52℃退火2 min,72℃延伸2 min,循环35次;再72℃延伸10 min。
PCR扩增产物用质量分数(下同)2%琼脂糖凝胶电泳检测,控制电压在70 V。
1.3.3.3 酵母菌5.8S r DNA-ITS区PCR扩增产物限制性内切酶酶切
将酵母菌5.8S r DNA-ITS区PCR扩增产物利用3种限制性内切酶HinfⅠ,HaeⅢ和CofⅠ进行酶切。
酶切反应体系(20μL):10×Buffer 2μL,PCR产物8μL,限制性内切酶1μL,双蒸水9μL。
酶切反应条件:37℃水浴2.5 h。
PCR扩增产物用2%琼脂糖凝胶电泳检测,控制电压在90 V。
1.3.3.4 酵母菌5.8S r DNA-ITS区序列分析
将酶切后的酵母菌5.8S r DNA-ITS区域PCR产物送至上海生工生物工程技术服务有限公司,委托其进行基因序列测定。
1.3.4 数据处理
双向基因序列测序结果经过拼接后,在Genbank核酸序列数据库中通过Blast(http://www.ncbi.nlm.nih.gov/blast/Blast.cgi)进行同源序列搜索,比较提交菌株与已知序列菌株的相似程度,以相似度大于99%时确定其属和种,初步确定酵母菌株的分类学地位。
2 结果与分析
2.1 样品预处理与酵母菌的分离
从鲜牛乳、自然发酵乳和开菲尔粒中共分离得到130株酵母菌,其中鲜牛乳和自然发酵乳中分离到87株,开菲尔粒中分离到43株,分别占各自所分离总微生物菌数的2.86%和6.64%,开菲尔粒中酵母菌所占比例明显高于自然发酵乳,结果见表1。
由表1可见,依据初步形态观察,从开菲尔粒中分离出的酵母菌形态完全不同于鲜牛乳和自然发酵乳。从开菲尔粒中分离出的4种形态酵母菌,在鲜牛乳和自然发酵乳中都没有分离到。而从鲜牛乳和自然发酵乳中分离出的6种形态酵母菌在开菲尔粒中也没有分离到。说明酵母菌的存在与原料和环境有密切关系。
开菲尔粒本身是发酵剂,经活化后,所含微生物处于活跃状态,便于酵母菌的分离和筛选。鲜牛乳直接分离和经过自然发酵后分离到形态5,6,7三种形态的酵母菌,仅占总菌数的1.23%~2.70%。调节鲜牛乳的p H值和含糖量,使营养成分和培养条件更适宜酵母菌的生长,分离到形态7的酵母菌,说明该菌在鲜牛乳中基数较少,经过发酵富集后才被分离。从理论上讲,灭菌乳在任何条件下都应该分离不到微生物,但事实是自然发酵的灭菌乳样品中都分离到了各种微生物,特别是经过调整p H值和加糖后自然发酵培养的2号和3号样所分离到的酵母菌形态类型和数量的确比直接培养分离的1号样菌数多,形态也更丰富,酵母菌所占比例从0到13.89%。对此可以有2点解释,一是在销售环节灭菌乳的贮存条件导致微生物滋生;二是自然发酵过程中,环境微生物的侵入或样品中极少量微生物因营养和培养条件的改善使菌数和种类增加。
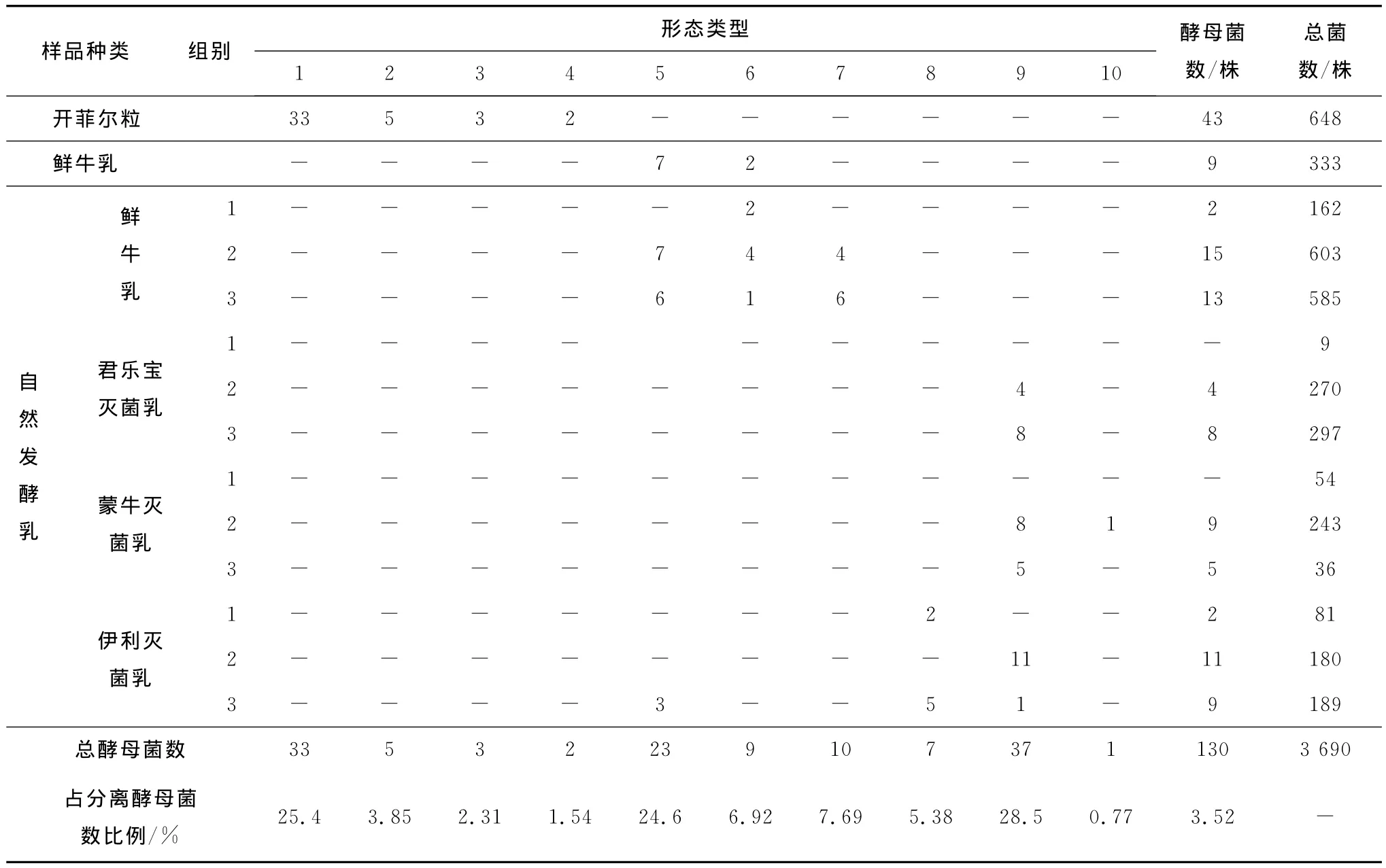
表1 开菲尔粒和自然发酵乳中分离的酵母菌数量统计Tab.1 Separation of the yeast quantity statistics in kefir grains and natural fermented dairy
2.2 酵母菌的形态聚类分析
酵母菌的形态鉴别通常用WL培养基。因为培养基中含有溴甲酚绿指示剂,不同种类的酵母菌在 WL培养基上生长的菌落颜色和形态不同,基于此再结合显微镜下酵母菌细胞形态的特点,可以将酵母菌进行初步形态聚类[12]。本研究依据菌落特征和显微镜下细胞特征[13]对所分离的130株酵母菌进行了形态聚类,初步分为10种形态类型,形态描述和酵母菌株数见表2。
由表2可看出,酵母菌均以出芽方式繁殖,细胞大小不一。开菲尔粒中含有4种形态的酵母菌,菌落形态不同,但在显微镜下观察细胞形态,形态1,2和4有相似处,均有少量假菌丝形成,与卢鑫研究的一株马克斯克鲁维酵母菌[14]的显微形态类似,王和平等鉴定的克鲁维酵母菌的显微形态中也有少量假菌丝[15]。初步判定形态1,2和4为马克斯克鲁维酵母。形态1的酵母菌数在开菲尔粒中占有绝对优势,为优势菌株。形态5和形态9的酵母菌分别是鲜牛乳自然发酵和灭菌乳自然发酵筛选出的优势菌株。
2.3 酵母菌的分子鉴定
2.3.1 酵母菌株5.8S r DNA-ITS区RFLP分子鉴定图谱
在WL培养基初步形态聚类的基础上,利用5.8S r DNA-ITS区进行RFLP分子鉴定。因为酵母菌的核糖体5.8S r DNA及两侧的转录间隔区(ITS)具有显著的种间差异性[10],可以作为鉴别酵母菌的分类依据[16]。从10种形态的酵母菌中每个形态随机各选1株进行5.8S-ITS区基因扩增,PCR扩增产物电泳图见图1。
由图1可以看出,10种形态的酵母菌经PCR产物电泳分析后分成5类,均在450~900 bp之间。其中形态1,2,4,6的PCR条带一致,均在750 bp;形态3,9和10的PCR条带一致,均在650 bp;形态5,7,8的条带各不相同,分别是880,560,450 bp。为了将10种形态酵母菌完全区分开,故将PCR产物用3种限制性内切酶HinfⅠ,HaeⅢ和CofⅠ进行酶切做进一步分析,酶切产物电泳图见图2。

表2 开菲尔粒和自然发酵牛乳中酵母菌的形态特征Tab.2 Colony morphology of yeast isolates in kefir grains and natural fermented dairy
由图2可以看出,经过3种酶切分析后,共得到种6种酶切类型。其中形态3和形态9,10的HinfⅠ和HaeⅢ这两种内切酶条带不同。形态1,2,4,6酵母菌的酶切图谱仍然一致,虽在WL培养基上形态表征不同,但经过5.8S r DNA-ITS区RFLP分析后具有相同的PCR产物及酶切条带,则初步鉴定其为同一类酵母菌。形态表现的不同是因为菌株所处生长时期和个体差异所致。其余4种不同形态的酵母菌WL培养基聚类分析结果与5.8S rDNAITS区RFLP分析鉴定结果基本一致。
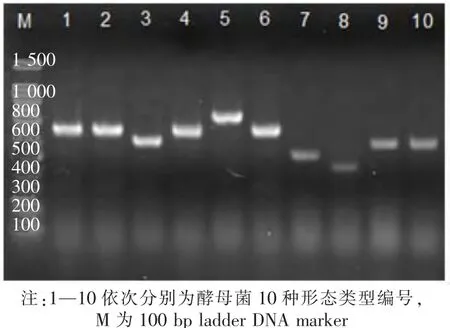
图1 5.8S r DNA-ITS区PCR扩增产物电泳图谱Fig.1 PCR amplification pattern of 5.8S rDNA-ITS region of yeast isolates
2.3.2 酵母菌株5.8S r DNA-ITS区PCR扩增产物及酶切产物大小分析
根据酵母菌5.8S r DNA-ITS区PCR扩增产物及3种限制性内切酶酶切产物电泳图,通过Image Lab软件进行处理,结合软件自动读带,读取清晰强度较高的电泳条带分子量大小[17]。不同形态类型的酵母菌株5.8S-ITS区域RFLP分析结果及鉴定结果见表3。
本研究对5.8S r DNA-ITS序列分析结果作进一步测序鉴定,即将每一分子类型酵母菌随机挑选一株,共6株进行测序分析。即将其PCR扩增产物委托上海生工生物工程技术服务有限公司进行基因测序,结果见表4。并将测序序列登陆 GeneBank数据库(http://www.ncbi.nlm.nih.gov/blast/Blast.cgi),进行BLAST相似性比对[18],以相似度大于99%确定其种属,测序结果见表4。
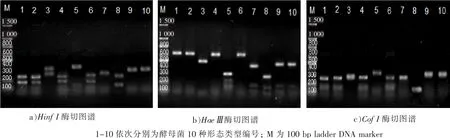
图2 酵母菌5.8S r DNA-ITS区扩增产物限制性酶切图谱Fig.2 Restriction analysis pattern of PCR amplified 5.8S r DNA-ITS region of yeast

表3 5.8S r DNA-ITS区扩增产物大小及酶切片段大小Tab.3 Amplification product size and enzyme fragment size of 5.8S r DNA-ITS region

表4 酵母菌5.8S r DNA-ITS区序列分析结果Tab.4 Sequence analysis results of 5.8S r DNA-ITS region of yeasts
从表4可以看出,经过初步的形态学鉴定和后续的5.8S r DNA-ITS区分子生物学鉴定后,原10种菌落形态酵母菌现分为6种分子类型,归属于6个属的6个种,分别为马克思克鲁维酵母菌(K.marxianus)、隐球酵母菌(Cryptococcussp.)、酿酒酵母菌(S.cerevisiae)、热带假丝酵母菌(C.tropicalis)、陆生伊萨酵母菌(I.terricola)和季也蒙毕赤酵母菌(P.guilliermondii)。
开菲尔粒中分离到的4种形态的酵母菌鉴定为2种分子类型。鲜牛乳和自然发酵乳中分离到的6种形态的酵母菌鉴定为5种分子类型。最值得讨论的是形态1,2,4和6,它们分别来自于开菲尔粒和鲜牛乳自然发酵,菌落特征和细胞显微特征完全不同,但是分子类型相同,或许是因为分子鉴定的方法中所涉及到的基因片段相同,它们存在着亚种或菌株水平的区分。
在GenBank数据库中下载相关菌株序列[19],利用MEGA4生物学软件的Neighbor-Joining连接法构建系统发育树[20],同时进行1 000次Bootstrap检验。系统发育树上在同一分支的酵母其同源关系最近,同时从聚类结果可以看出各酵母的种属名称及各自的分类情况。构建的系统发育树如图3所示。
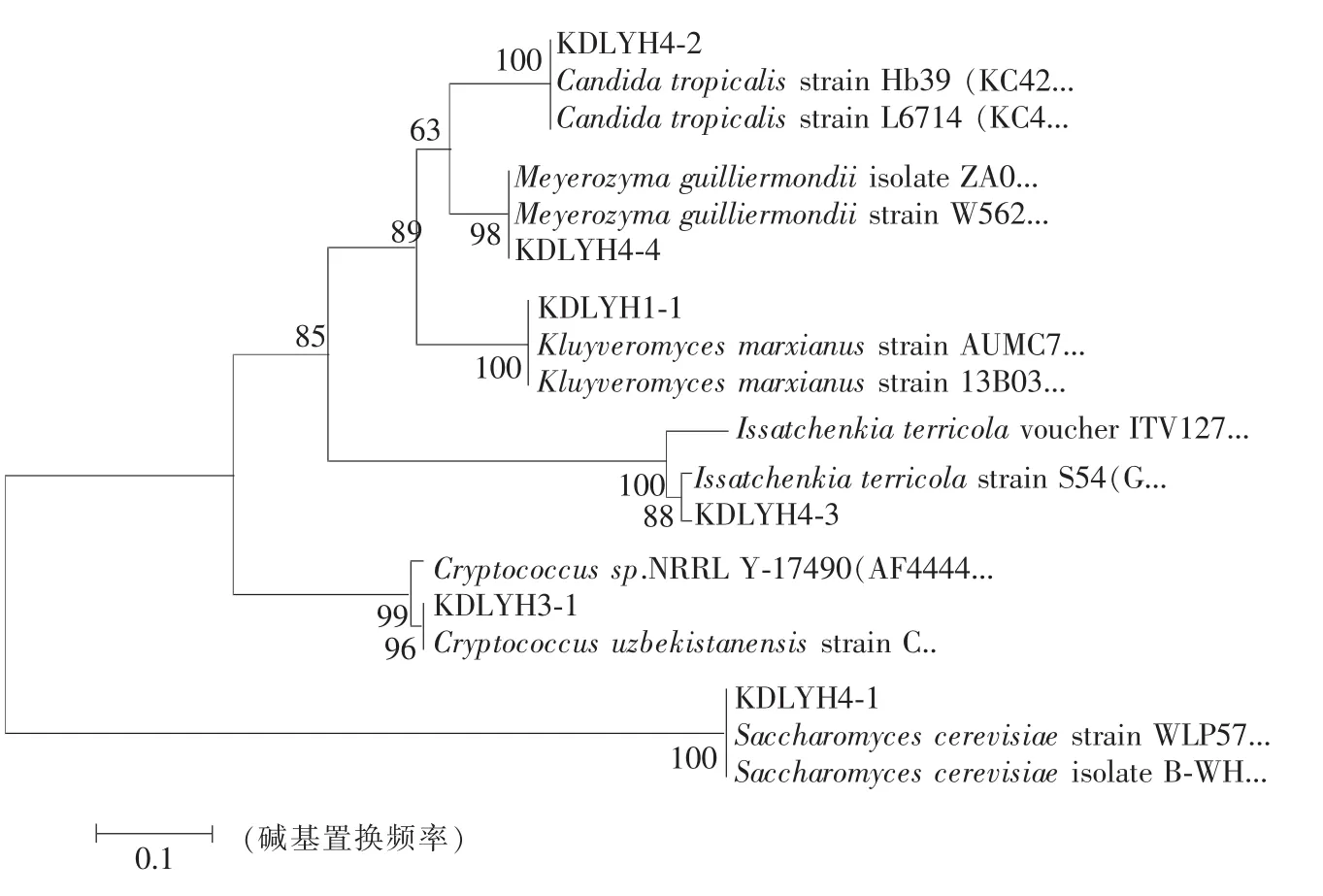
图3 基于5.8S r DNA-ITS区序列和Neighbor-Joining法构建的系统发育树Fig.3 Phylo genetic tree based on the 5.8S r DNA-ITS region domain sequences
自然发酵乳和传统开菲尔粒中以K.marxianus,S.cerevisiae和P.guilliermondii数量最多。其中K.marxianus为重要菌群,占总酵母菌数的38%,在开菲尔粒和自然发酵乳中均分离到,为乳糖发酵型酵母菌[21],可利用牛乳中的乳糖发酵产生CO2和具有保健功能的脂肪酸等活性物质[22]。尹艳军从汉森公司提供的开菲尔粒中也分离到了K.marxianus,并比较了其与酿酒酵母的发酵性能[23],该菌在生长繁殖和代谢过程中,产生促进其他细菌生长的生长素类物质[24],因而在开菲尔粒中,它不仅促进微生物之间的共生作用而且在提高特殊风味和香气方面也起到重要作用。S.cerevisiae是非乳糖发酵型酵母,主要源自鲜牛乳自然发酵,占筛选总酵母菌的18%,主要利用葡萄糖发酵产生酒精,并具有很好的耐酒精性。将K.marxianus和S.cerevisiae按比例混合作为发酵低醇度乳酒的发酵剂,不仅酒精含量高而且还具有很好的风味。
3 结 论
本研究从自然发酵乳及内蒙古牧区传统开菲尔粒中分离纯化出130株酵母菌,形态学聚类为10种形态类型,5.8S r DNA-ITS区域PCR扩增产物RFLP分析后得到6种分子类型。经测序、登录Genbank进行Blast同源性比对鉴定出6种分子类型的酵母菌分别为马克思克鲁维酵母菌(K.marxianus)、隐球酵母菌(Cryptococcussp.)、酿酒酵母菌(S.cerevisiae)、热带假丝酵母菌(C.tropicalis)、陆生伊萨酵母菌(I.terricola)和季也蒙毕赤酵母菌(P.guilliermondii)。其中马克思克鲁维酵母菌、酿酒酵母菌和季也蒙毕赤酵母菌为优势菌群,具有酿造低醇度发酵乳制品的潜力。
本研究将传统酵母菌形态聚类与分子鉴定相结合,分离筛选出具有发酵低纯度乳酒潜质的酵母菌,为进一步进行工业化应用研究奠定基础,对生产具有不同口感和类型的低醇度发酵乳制品具有重要意义。
/References:
[1] 王洪志.奶啤生产中乳酸菌对酵母菌发酵作用的研究[J].中国酿造,2009,28(6):134-136.WANG Hongzhi.Effect of lactic acid bacteria on yeast fermentation in the milk beer production[J].China Brewing,2009,28(6):134-136.
[2] 林晓珊,吴 虹,杨汝德.中华开菲尔共生菌的分离与鉴定[J].现代食品科技,2009,25(10):1233-1235.LIN Xiaoshan,WU Hong,YANG Rude.Screening and identification of Chinese kefir symbiotic bacterias[J].Modern Food Science and Technology,2009,25(10):1233-1235.
[3] 梁萌萌,张柏林,赵紫华,等.几株益生乳杆菌耐药性的研究[J].河北工业科技,2011,28(4):250-253.LIANG Mengmeng,ZHANG Bailin,ZHAO Zihua,et al.Study on antibiotic resistance of probiotic lactobacillus[J].Hebei Journal of Industrial Science and Technology,2011,28(4):250-253.
[4] WITTHUHN R C,SCHOEMAN T,BRITZ T J.Characterisation of the microbial population at different stages of Kefir production and Kefir grain mass cultivation[J].International Dairy Journal,2005,15(4):383-389.
[5] GRØNNEVIK H,FALSTAD M,NARVHUS J A.Microbiological and chemical properties of Norwegian kefir during storage[J].International Dairy Journal,2011,21(9):601-606.
[6] GADAGA T H,MUTUKUMIRA A N,NARVHUS J A.Enumeration and identification of yeasts isolated from Zimbabwean traditional fermented milk[J].International Dairy Journal,2000,10(7):459-466.
[7] FADDA M E,VIALE S,DEPLANO M,et al.Characterization of yeast population and molecular fingerprinting of Candida zeylanoides isolated from goat's milk collected in Sardinia[J].International Journal of Food Microbiology,2010,136(3):376-380.
[8] 杨 莹,徐艳文,薛军侠,等.WL营养琼脂对葡萄酒相关酵母的鉴定效果验证[J].微生物学杂志,2007,27(5):75-78.YANG Ying,XU Yanwen,XUE Junxia,et al.Validate the identification effect of WL nutrient agar on wine yeast[J].Journal of Microbiology,2007,27(5):75-78.
[9] ROMANO P,RICCIARDI A,SALZANO G,et al.Yeasts from Water Buffalo Mozzarella,a traditional cheese of the Mediterranean area[J].International Journal of Food Microbiology,2001,69(1/2):45-51.
[10] ÁLVAREZ-MARTÍN P,FLÓREZ A B,LÓPEZ-DÍAZ T M,et al.Phenotypic and molecular identification of yeast species associated with Spanish blue-veined Cabrales cheese[J].International Dairy Journal,2007,17(8):961-967.
[11] 杨美景,陈小波,赵静静,等.赤霞珠葡萄自然发酵过程中酵母菌的分离与鉴定[J].食品与发酵工业,2011,37(7):22-27.YANG Meijing,CHEN Xiaobo,ZHAO Jingjing,et al.Identification of yeasts fermentation of isolated from spontaneous cabernet sauvignon[J].Food and Fermentation Industries,2011,37(7):22-27.
[12] 张 彬,韩俊华,蒋丹丹,等.降解胆固醇马红球菌F21-1的分离、鉴定及其特性研究[J].河北工业科技,2008,25(1):5-9.ZHANG Bin,HAN Junhua,JIANG Dandan,et al.Isolation,identification of a new Rhodococcus equi F21-1 with cholesterol degrading activity and study on its characteristic[J].Hebei Journal of Industrial Science &Technology,2008,25(1):5-9.
[13] 王 蕊,高 翔.酸牛乳酒中酵母菌的分离鉴定及生长特性研究[J].食品科学,2009,30(17):225-229.WANG Rui,GAO Xiang.Separation,identification and growth characteristics of yeast strains from Kefir milk[J].Food Science,2009,30(17):225-229.
[14] 卢 鑫.引起酸奶涨包的马克思克鲁维酵母的分离鉴定及特性研究[D].保定:河北农业大学,2009.LU Xin.Study on Isolation,Identification and Properties of Kluyveromyces Marxianus from Deteriorative Yogurt[D].Baoding:Hebei Agricultural University,2009.
[15] 王和平,王锂韫,李少刚,等.类开菲尔粒中乳酸菌和酵母菌的分离鉴定及生物学特性[J].中国乳品工业,2004,32(12):3-6.WANG Heping,WANG Liyun,LI Shaogang,et al.Isolation and identification of lactic bactria and yeasts from Kefir-like grains[J].China Dairy Industry,2004,32(12):3-6.
[16] OSORIO-CADAVID E,CHAVES-LÓPEZ C,TOFALO R,et al.Detection and identification of wild yeasts in Champús,a fermented Colombian maize beverage[J].Food Microbiology,2008,25(6):771-777.
[17] 李 艳,卢 君,张利中,等.沙城龙眼葡萄自然发酵过程相关酵母生物多样性研究[J].食品科学,2009,30(21):237-240.LI Yan,LU Jun,ZHANG Lizhong,et al.Yeast biodiversity in longan grapes during spontaneous fermentation process[J].Food Science,2009,30(21):237-240.
[18] 卢 君.沙城产区龙眼葡萄相关酵母菌生物多样性研究及优良酵母菌种的筛选[D].石家庄:河北科技大学,2010.LU Jun.Diversity of Yeast of Longan Grape in Shacheng Region and Screening of the Excellent Yeast Strains[D].Shijiazhuang:Hebei University of Science and Technology,2010.
[19] STADIE J,GULITZ A,EHRMANN M A,et al.Metabolic activity and symbiotic interactions of lactic acid bacteria and yeasts isolated from water Kefir[J].Food Microbiology,2013,35(2):92-98.
[20] MU Zhishen,YANG Xujin,YUAN Hongli.Detection and identification of wild yeast in Koumiss[J].Food Microbiology,2012,31(2):301-308.
[21] GUILLAMÓN J M,SABATÉJ,BARRIO E,et al.Rapid identification of wine yeast species based on RFLP analysis of the ribosomal internal transcribed spacer(ITS)region[J].Archives of Microbiology,1998,169(5):387-392.
[22] ESTEVE-ZARZOSO B,BELLOCH C,URUBURU F,et al.Identification of yeasts by RFLP analysis of the 5.8S rRNA gene and the two ribosomal internal transcribed spacers[J].International Journal of Systematic Bacteriology,1999,49(Pt 1):329-337.
[23] 尹艳军.乳酒酵母的筛选鉴定和低醇乳酒的研制[D].无锡:江南大学,2005.YIN Yanjun.Breast Milk Wine Yeast Screening and Low Alcohol Wine[D].Wuxi:Jiangnan University,2005.
[24] PANESAR R,PANESAR P S,SINGH R S,et al.Production of lactose-hydrolyzed milk using ethanol permeabilized yeast cells[J].Food Chemistry,2007,101(2):786-790.
