关中奶山羊隐性乳房炎病原菌的分离鉴定
2013-08-14姚运亮田婷婷许君艳李前瑞陈德坤
姚运亮,田婷婷,许君艳,李 杰,李前瑞,陈德坤
(西北农林科技大学动物医学院,陕西杨凌712100)
陕西省关中地区是我国奶山羊的重点养殖地区[1]。奶山羊养殖过程中,乳房炎是影响奶山羊养殖效益的疾病之一,给奶山羊养殖造成较为严重的经济损失,也给羊奶产品带来了潜在的食品质量安全风险[2]。奶山羊乳房炎可分为临床乳房炎和隐性乳房炎,临床乳房炎易于诊断,一旦发现可以采取有效措施进行治疗[3]。然而,隐性乳房炎患畜的乳房和乳汁外观均无明显变化,很难引起饲养管理人员的注意,往往不能及时采取有效的预防、诊断和治疗措施,随着病程的进行则发展为临床型乳房炎[4]。所以,及早诊断奶山羊隐性乳房炎,对奶山羊健康生产具有重大的意义。
为了解陕西省富平县奶山羊隐性乳房炎的发病情况和引起隐性乳房炎的主要病原菌种类,为防治奶山羊隐性乳房炎提供依据。我们对陕西省富平县的3个大型关中奶山羊养殖场和5个养殖集中村的关中奶山羊进行了乳汁抽样检测和病原菌的分离与鉴定,现将结果报告如下。
1 材料与方法
1.1 材料
普通琼脂平板,绵羊血琼脂平板,麦康凯琼脂平板,含10mL/L血清的LB液体培养基,均按常规方法制备;奶山羊隐性乳房炎诊断液,实验室制备;细菌生化微量鉴定管,杭州天和微生物试剂有限公司产品。
1.2 方法
1.2.1 乳房炎检测及乳样采集 本研究于2011年6月至10月对陕西富平县的奶山羊主要养殖场和养殖集中村进行了隐性乳房炎随机抽样检测和隐性乳房炎阳性样品的采集。乳房炎检测前,首先用湿毛巾将泌乳羊乳房擦洗干净,弃去前两把奶,然后取2mL羊奶加入等量的奶山羊隐性乳房炎诊断液,反复摇匀,观察并记录诊断结果。对检测阳性的乳区,先用温水清洗乳房,再用1g/L的新洁尔灭消毒乳头,最后用高压灭菌过的纸巾将乳头擦干,再次弃掉前两把奶,然后采集此隐性乳房炎阳性的乳汁5mL~10mL于灭菌的离心管中,标记样品。
1.2.2 病原菌的分离 摇匀乳样后,取40μL涂布接种于血平板上,37℃温箱培养24h~48h后,观察菌落形态特征,挑取单个菌落接种于含有10mL/L血清的LB液体培养基中,37℃恒温空气浴摇床振培过夜。
1.2.3 病原菌的鉴定 将增菌后菌液接种于普通琼脂平板、绵羊血琼脂平板、麦康凯琼脂平板,37℃温箱培养24h~48h。观察平板细菌生长情况,根据菌落的形态特点,挑取典型菌落涂片,革兰染色,镜检。
1.2.4 球菌的鉴定 将所有的球菌做触酶试验,取触酶试验阳性的菌株做凝固酶试验、葡萄糖发酵试验和甘露醇发酵试验;取触酶试验阴性的菌株做各种醇、糖、苷类的发酵试验[5]。
1.2.5 杆菌的鉴定 将所有的杆菌做IMViC试验、麦芽糖的发酵试验。
2 结果
2.1 分离菌株的培养观察结果
分离菌株的菌落主要有如下3个特点:①类菌株在普通琼脂平板上形成湿润、光滑、隆起、黄色或乳白色、中等大小的圆形菌落,在绵羊血琼脂平板形成湿润、光滑、隆起的较大的菌落,并能呈明显的β溶血;②类菌株在普通琼脂平板上不生长,在绵羊血琼脂平板上形成淡灰色、隆起、闪光、黏稠的小菌落并能产生α或β溶血;③类菌株在普通琼脂平板上形成圆形凸起、光滑、湿润、半透明、灰白色的大菌落,在绵羊血琼脂平板上部分菌株有溶血现象,在麦康凯琼脂平板上形成红色菌落。
2.2 染色镜检结果
革兰染色后显微镜下观察结果:①类细菌呈革兰阳性,圆形,排列成葡萄串状;②类细菌呈革兰阳性,圆形或卵圆形,排列成链状或成双存在;③类细菌呈革兰阴性,杆状,两端钝圆,散在或成对存在。
2.3 生化反应结果
根据以上细菌的培养特性和形态特征,初步判定:①为葡萄球菌,②为链球菌,③为大肠埃希菌。此3种菌的生化特性结果见表1、表2、表3。

表1 葡萄球菌的生化特性鉴定结果Table 1 Biochemical characterization of Staphylococcus

表2 链球菌的生化特性鉴定结果Table 2 Biochemical characterization of Streptococcus

表3 大肠埃希菌的特性鉴定结果Table 3 Biochemical characterization of Escherichia coli
2.4 细菌分离鉴定结果
对364份隐性乳房炎阳性样品中所分离出的337株病原菌进行细菌的分离鉴定得出如下结果:凝固酶阴性葡萄球菌186株,金黄色葡萄球菌50株,大肠埃希菌61株,乳房链球菌24株,猪链球菌9株,蜡样芽胞杆菌5株,克雷伯菌1株,巴氏杆菌1株,各种细菌所占比例见图1。
3 讨论
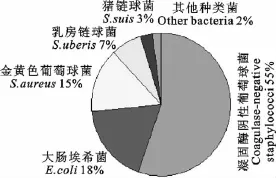
图1 细菌分离鉴定结果Fig.1 The results of Bacteria Separated and Identified
凝固酶阴性葡萄球菌以前很少被认为是乳房炎病原菌[6],但SupréK 等[7]报道显示,引起奶山羊隐性乳房炎的病原菌中,凝固酶阴性的葡萄球菌占25%~93%,金黄色葡萄球菌占3%~37%,在凝固酶阴性的葡萄球菌中,最主要的是表皮葡萄球菌,木糖葡萄球菌,产色葡萄球菌,模仿葡萄球菌和山羊葡萄球菌。分析认为,凝固酶阴性的葡萄球菌是动物体表和环境中的常在菌,这类细菌很容易通过挤奶工人的手或未彻底消毒的挤奶机而在挤奶的过程中感染动物的乳腺,引起乳腺炎的发生[8-9]。本研究结果显示,凝固酶阴性的葡萄球菌是引起奶山羊隐性乳房炎的主要病原菌,占到所分离病原菌总量的55%。
乳房链球菌、无乳链球菌和猪链球菌同样也是乳房炎病原菌[10]。本研究中分离到的链球菌经生化鉴定结果显示只有乳房链球菌和猪链球菌两种。猪链球菌虽然也能够引起奶山羊乳房炎的发生,但根据Pisoni G等[11]的报道,它并不是引起奶牛和奶山羊乳房炎的主要致病菌。本研究之所以分离到了较多的猪链球菌,我们推测,这可能与奶山羊养殖户不重视管理,将奶山羊与其他动物混养在一起,造成动物之间的交叉感染有关。链球菌一直都被认为是引起动物急性、慢性乳房炎的病原菌之一[12]。其感染乳腺以后不产生明显的免疫反应,机体很难自动清除此类病原菌,目前也没有可靠的多价菌苗进行预防[13]。因此,对于链球菌引起的乳房炎的预防还需要从改善养殖环境入手。
另外,本试验还分离出了5株蜡样芽胞杆菌、1株巴氏杆菌和1株克雷伯菌。蜡样芽胞杆菌感染机体引起乳腺炎的报道在20世纪七八十年代有所报道[14-15],但近年来没见到类似报道。因此,本试验中所分到的蜡样芽胞杆菌,并不能确定一定是乳腺内的致病菌,也有可能是土壤中的芽胞污染乳样所致。巴氏杆菌和克雷伯菌都可以引起乳腺炎,但都不是主要的致病菌,无论是在奶山羊还是奶牛乳腺炎致病菌中的检出率都很低[16]。
国内外研究显示,有效的疫苗预防能够显著降低乳房炎的发生率[17-18]。目前,对于乳房炎疫苗的研究大多致力于金黄色葡萄球菌疫苗和大肠埃希菌疫苗的研究,然而本研究表明,凝固酶阴性葡萄球菌也是主要的病原菌。因此,本研究结果对于开发适合关中奶山羊隐性乳房炎的疫苗有着重要的指导意义。
[1] 祁艳霞,陈玉林,刘洪瑜,等.关中奶山羊基本情况调查[J].中国草食动物,2005,25(4):32-33.
[2] Koop G,van Werven T,Schuiling H J,et al.The effect of subclinical mastitis on milk yield in dairy goats[J].J Dairy Sci,2010,93(12):5809-5817.
[3] Moroni P,Vellere F,Antonini M,et al.Antibiotic susceptibility of coagulase-negative staphylococci isolated from goats’milk[J].Inter J Antimicr Agents,2004,23(6):637-640.
[4] McDougall S,SupréK,De Vliegher S,et al.Diagnosis and treatment of subclinical mastitis in early lactation in dairy goats[J].J Dairy Sci,2010,93(10):4710-4721.
[5] 路建彪,刘文强.奶牛乳房炎病原菌的分离与鉴定[J].中国兽医杂志,2007,43(1):62-63.
[6] Devriese L A,Dekeyser H.Prevalence of different species of coagulase-negative staphylococci on teats and in milk samples from dairy cows[J].J Dairy Res,1980(47):155-158.
[7] SupréK,Haesebrouck F,Zadoks R N,et al.Some coagulasenegative Staphylococcus species affect udder health more than others[J].J Dairy Sci,2011(94):2329-2340.
[8] Piessens V,De Vliegher S,Verbist B,et al.Intra-species diversity and epidemiology varies among coagulase-negative Staphylococcus species causing bovine intramammary infections[J].Vet Microbiol,2012(1):62-71.
[9] Pyorala S,Taponen S.Coagulase-negative Staphylococci——Emerging mastitis pathogens[J].Vet Microbiol,2009(134):3-8.
[10] Bergonier D,De Cremoux R,Rupp R,et al.Mastitis of dairy small ruminants[J].Vet Res Communicat,2003(34):689-716.
[11] Pisoni G,Zadoks R N,Vimercati C,et al.Epidemiological investigation of Streptococcus equi subspecies zooepidemicus involved in clinical mastitis in dairy goats[J].J Dairy Sci,2009(3):943-951.
[12] Guélat-Brechbuehl M,Thomann A,Albini S,et al.Crosssectional study of Streptococcus species in quarter milk samples of dairy cows in the canton of Bern,Switzerland[J].Vet Rec,2010(6):211-215.
[13] 粱瑞琴,刘 强.奶牛乳房炎链球菌的分离与鉴定[J].畜牧与饲料科学,2009,30(2):64-65.
[14] Schiefer B,Macdonald K R,Klavano G G,et al.Pathology of Bacillus cereus mastitis in dairy cows[J].Canadian Vet J Rev Vet Canadienne,1976(17):239-243.
[15] Perrin D,Greenfield J,Ward G E.Acute Bacillus cereus mastitis in dairy cattle associated with use of a contaminated antibiotic associated with use of a contaminated antibiotic[J].Can Vet J Rev,1976(17):244-247.
[16] Malinowski E,Lassa H,Klossowska A,et al.Etiological agents of dairy cows'mastitis in western part of Poland[J].Polish J Vet Sci,2006(9):191-194.
[17] Calzolari A,Giraudo J A,Rampone H,et al.Field trials of a vaccine against bovine mastitis.2.Evaluation in two commercial dairy herds[J].J Dairy Sci,1997,80(5):854-858.
[18] Leitner G,Krifucks O,Kiran M D,et al.Vaccine development for the prevention of staphylococcal mastitis in dairy cows[J].Vet Immunol Immunopathol,2011,142(1-2):25-35.
