PCV-2ORF2和PRRSV GP5双基因共表达重组腺病毒的构建及小鼠免疫试验
2013-08-14林初文
林初文
(山东省滨州畜牧兽医研究院,山东滨州256600)
猪呼吸系统疾病综合征(PRDC)是危害当前世界养猪业的一种重要疾病[1],猪圆环病毒2型(PCV-2)和及猪繁殖与呼吸综合征病毒(PRRSV)被认为是PRDC的病原体[2]。
PRRSV自1987年首次发现以来,已遍及世界各个养猪国家,给养猪业造成了灾难性的打击[3-5]。PCV-2呈现全球性流行[6],给世界养猪业造成了巨大经济损失[7-8]。猪场经常发生PCV-2和PRRSV混合感染的现象,混合感染常常加重疫情,增加死亡率[9]。
目前,对猪圆环病毒病(PCVD)的预防还没有很好的疫苗,预防接种和综合防控相结合的方法是防控猪繁殖与呼吸综合征(PRRS)的主要措施,弱毒苗以及灭活苗在PRRS的防控上尽管起到了一些作用,但不能杜绝PRRS的发生,因此各国都在研制PCVD和PRRS新型疫苗。PRRSV GP5基因编码病毒的糖基化囊膜蛋白诱导机体产生特异性中和抗体,因此很多PRRS新型疫苗均以GP5为靶抗原[10-11]。PCV-2ORF2基因编码病毒的主要结构蛋白Cap是主要的抗原蛋白[12]。以腺病毒作为表达载体,研制的新型基因工程疫苗有非常好的应用前景,腺病毒表达载体介导的基因具有病毒滴度高、感染细胞谱广、转移效率高、容易浓缩和贮存等很多优点[13]。研究表明,构建的猪瘟重组腺病毒[14]和西方马脑炎重组腺病毒[15]均具有良好的免疫效果。
本研究成功构建了表达PCV-2ORF2和PRRSV GP5基因的重组腺病毒rAd-gio,将其免疫小鼠,通过ELISA、病毒中和试验,测定小鼠的体液免疫水平,为PCV-2和PRRSV重组腺病毒二联基因工程苗的成功研制奠定了基础。
1 材料与方法
1.1 材料
293A细胞,PK-15细胞,Marc-145细胞,DH5α感受态细胞,含AdEasy-1的BJ5183大肠埃希菌感受态细胞,野生型腺病毒,pIRESneo真核表达载体,pShuttle-CMV穿梭载体,含PRRSV GP5基因的pcDNA3.1-GP5重组质粒和pcDNA3.1-ORF2重组质粒,猪抗PRRSV和PCV-2阳性血清,均为山东省滨州畜牧兽医研究预防兽医学与动物生物技术重点开放实验室保存;pMD18-T Vector,宝生物工程(大连)有限公司产品;Balb/c雌性小鼠,体重为15g/只~18g/只,购自山东中医药大学实验动物中心;RNA提取试剂Trizol BglⅡ,AMV反转录酶,dNTP,RNasin,T4DNA Ligase,SalⅠ,HindⅢ,XhoⅠ,Taq DNA聚合酶,购自上海生工生物工程技术服务有限公司;质粒提取试剂盒,DNA凝胶回收试剂盒,均购自宝生物工程(大连)有限公司;Lipofectamine 2000转染试剂,购自Invitrogen公司;HRP标记的山羊抗鼠IgG,购自武汉博士德生物工程有限公司;PacⅠ、PmeⅠ等限制性内切酶,购自NEB公司。
1.2 方法
1.2.1 引物的设计与合成 依据PCV-2ORF2、PRRSV GP5和pIRESneo载体上的IRES基因序列,使用Premier5.0软件设计引物,送上海生工生物工程技术服务有限公司进行合成。引物序列为:
GP5-f:5′-GCAGATCCCACCATGGTGGAGA AA-3′(BglⅡ);GP5-r:5′-ATGTCGACCTAAGGACGACCCC ATTG-3′(SalⅠ)。
IRES-f:5′-GAGTCGACGTCCAACTGCAGG TCGAGCAT-3′(SalⅠ);IRES-r:5′-ATCTCGAGTCCCCGTGGTTCG GGGGGCCTA-3′(XhoⅠ)。
ORF2-f:5′-GT CTCGAG ATGACGTGTCCAAGGAGG-3′(XhoⅠ);ORF2-r:5′-GCAAGCTTTTAAGGGTTAAGTGGGG-3′(HindⅢ)。
1.2.2 目的基因克隆和鉴定 分别将pcDNA3.1-ORF2、pIRESneo和pcDNA3.1-GP5作为模板扩增ORF2、IRES和 GP5基因,ORF2、IRES和 GP5基因扩增时的退火温度分别为70℃、57℃和55℃,分别将回收的PCR产物与pMD18-T载体连接,然后分别转化感受态DH5α,挑取阳性克隆,摇菌并提取质粒,将质粒进行酶切、测序筛选出重组质粒pMD18-ORF2、pMD18-IRES和pMD18-GP5。
1.2.3 重组腺病毒穿梭载体pGIO的构建 同时用SalⅠ/BglⅡ双酶切pMD18-GP5,回收GP5基因片段,将回收产物克隆到pShuttle-CMV穿梭载体上,通过卡那抗性筛选阳性重组质粒,将质粒酶切鉴定,成功构建pG重组穿梭质粒,将pMD18-ORF2和pMD18-IRES分别用HindⅢ/XhoⅠ和XhoⅠ/SalⅠ双酶切,回收得到ORF2和IRES目的片段,将其克隆到pG穿梭载体上,通过卡那霉素抗性筛选阳性质粒,再次酶切鉴定,构建出含GP5-IRESORF2片段的重组穿梭质粒pGIO。
1.2.4 重组腺病毒质粒pAd-GIO的构建 重组腺病毒穿梭质粒pGIO经PmeⅠ酶切线性化后,转化至含AdEasy-1的BJ5183大肠埃希菌感受态细胞。经卡那霉素抗性琼脂平板上筛选后,挑取小的克隆,小量制备质粒,经PacⅠ酶切鉴定后,得到了同源重组重组腺病毒质粒pAd-GIO。
1.2.5 重组腺病毒制备和稳定性鉴定 将重组腺病毒质粒pAd-GIO转化大肠埃希菌DH5α感受态,经氨苄青霉素抗性琼脂平板筛选后,挑取阳性克隆,大量制备质粒,将质粒用PacⅠ酶切线性化后,回收(3.5μg);用脂质体Lipofetamine 2000包裹回收产物,转染生长密度大约为65%的6孔细胞培养板上293A细胞,按照试剂盒内的说明书进行操作,同时设pAd-GIO环状质粒及脂质体转染作为对照。转染11d~15d后,细胞出现病变,收集细胞培养物,冻融3次,离心后吸取上清液,接毒、收毒依次传到第11代。分别提取不同代次细胞培养物的基因组,做PCR鉴定。
1.2.6 检测目的蛋白表达 将制备的重组腺病毒感染293A细胞,经过24h后,移去培养基,使用冷的PBS漂洗1次,用细胞刮刀收取细胞。每孔细胞加入50μL细胞裂解液后在冰上放置30min,在4℃以15 000r/min离心10min。将适量细胞裂解液样品进行SDS-PAGE和Western blot,方法参照文献[16]。
1.2.7 测定重组腺病毒TCID50将rAd-gio用DMEM维持液依次进行10倍梯度稀释后,分别接种长满293A单层细胞的96孔细胞培养板,每个稀释梯度重复接种8个孔,每个孔加入100μL。将加维持液的孔作为空白对照。在37℃、体积分数为5%的CO2培养箱中培养,每天观察细胞病变情况,用Reed-Muench方法算出TCID50。
1.2.8 动物免疫试验 将40只6周龄~周龄雌性Balb/c小鼠随机分为2组,每组20只。第1组小鼠采用背部皮下分点注射2.3×108.0TCID50重组病毒rAd-gio,2两周后加强免疫。第2组小鼠采用背部皮下分点注射107TCID50无外源基因的空腺病毒作阴性对照。首免2周和二免2、4、6周后,分别采集血清,用本实验室自行优化建立的方法检测其中的PCV-2和PRRSV的抗体和中和抗体,操作方法参照文献[17]。
2 结果
2.1 目的基因克隆及鉴定
扩增出的ORF2、IRES和GP5基因产物的大小分别为603、586、702bp(图1)。pMD18-GP5经SalⅠ和BglⅡ双酶切,得到2 700bp和603bp的两条带,pMD18-IRES经XhoⅠ和BglⅡ双酶切,得到2 700bp和1 189bp的两条带,pMD18-ORF2经HindⅢ和BglⅡ双酶切,得到2 700bp和1 891bp的2个条带。
2.2 重组腺病毒穿梭质粒的构建
重组腺病毒穿梭质粒pG经SalⅠ和BglⅡ双酶切,得到7 500bp和603bp的2个条带,重组腺病毒穿梭质粒pGI经XhoⅠ和BglⅡ双酶切,得到7 500bp和1 189bp的两条带,重组腺病毒穿梭质粒pGIO经HindⅢ和BglⅡ双酶切,得到7 500bp和1 891bp的2个条带(图2)。
2.3 重组腺病毒质粒的获得
将重组腺病毒质粒pAd-GIO使用PacⅠ酶切,能够得到30 000bp和4 500bp的两条带(图3),表明成功构建重组腺病毒质粒。
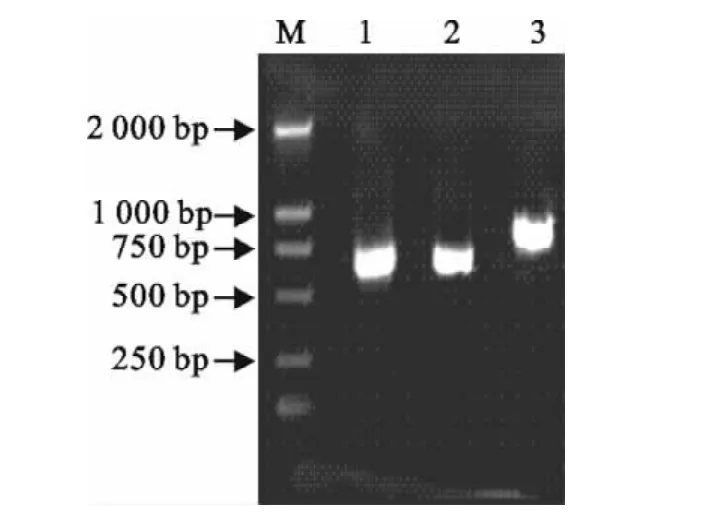
图1 目的基因扩增结果Fig.1 The PCR results of target genes
2.4 重组腺病毒的鉴定
293A细胞转染pAd-GIO后11d~15d发生病变。细胞变圆,核固缩,最后脱落;对照组细胞生长正常,收获的重组腺病毒命名为rAd-gio。收毒后传代11代,每代都做PCR鉴定,结果都能扩出目的条带。Western blot结果表明该腺病毒能正确表达PRRSV GP5(图4A)和PCV-2ORF2(图4B)蛋白,将该重组腺病毒在293A细胞连续传代到30代,pAd-GIO的滴度稳定,平均TCID50为10-9.0/mL。
2.5 动物免疫试验结果
间接ELISA结果表明,首免后2周即出现PRRSV特异性抗体,滴度可达1∶2 000,二免后2周达到1∶3 500,4周上升到1∶6 200,一直持续到试验结束(图5A),首免2周后即开始出现针对PCV-2的特异性抗体,抗体滴度为1∶350,二免2周后抗体滴度为1∶2 200,一直持续到试验结束(图5C)。
中和抗体结果表明,PRRSV特异性中和抗体出现较晚,首免2周后的小鼠没能检测到PRRSV特异性中和抗体,二免2周后,中和抗体滴度仅为1∶3,二免后4周和6周中和抗体滴度分别为1∶8和1∶11(图5B),而对照组却没能检测到PRRSV中和抗体。首免2周后所有小鼠PCV-2特异性中和抗体滴度均较低,二免2周后免疫组的中和抗体平均滴度为1∶13,4和6周时均为1∶15(图5D),而对照组却没能检测到PCV-2中和抗体。
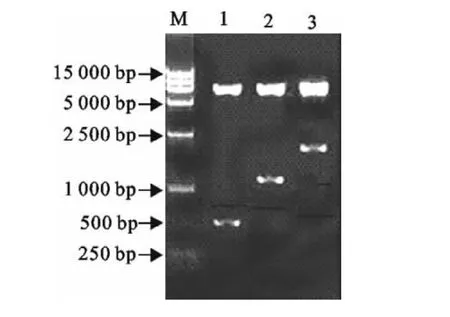
图2 重组穿梭质粒鉴定Fig.2 Identification of recombinant shuttle plasmids
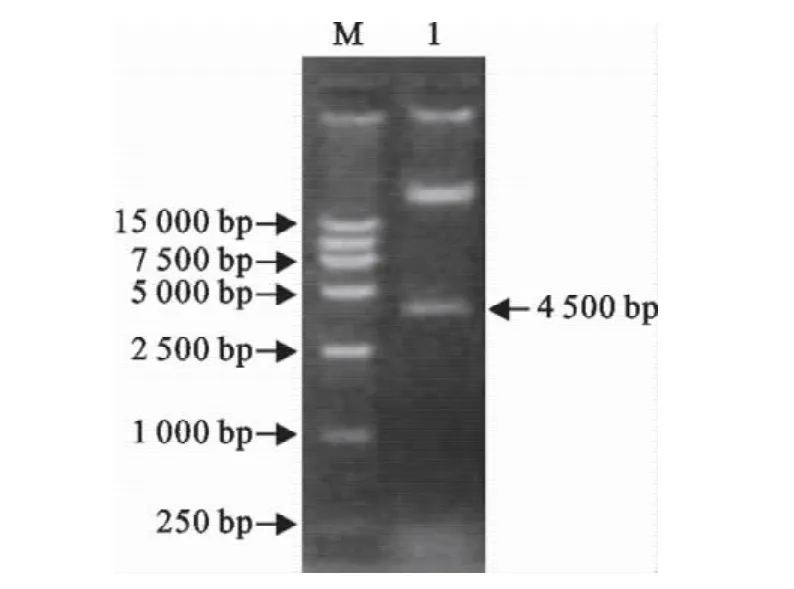
图3 重组腺病毒质粒鉴定Fig.3 Identification of recombinant adenoviral plasmid
3 讨论
随着规模化养猪业的发展,临床上出现的疾病越来越复杂,经常会出现多种疾病或病原混合感染的情况。其中以PCV-2和PRRSV混合感染的病例最多,在美国、西班牙、加拿大等国家有20%~60%的猪由于自然感染PCV-2和PRRSV从而引发疾病。最近几年我国的很多地区陆续出现猪同时感染PCV-2和PRRSV两种病毒的病例。虽然可以通过采用科学的饲养管理、改善饲养条件、降低饲养密度等方法减少其发生,但是不能有效预防此疾病。应用抗生素治疗此病的效果并不明显,猪一旦发病,很难被治愈,造成养猪业巨大的经济损失。尽管国内外学者对该病进行了大量研究,目前还没有有效的防控此病的方法,更没有商品化的疫苗。所以,研究有效预防此病的疫苗对于我国乃至世界养猪业都有非常重要意义。

图4 Western blot分析GP5和ORF2基因在293A细胞中的表达Fig.4 Western blot analysis of ORF2and GP5gene expression in 293Acells
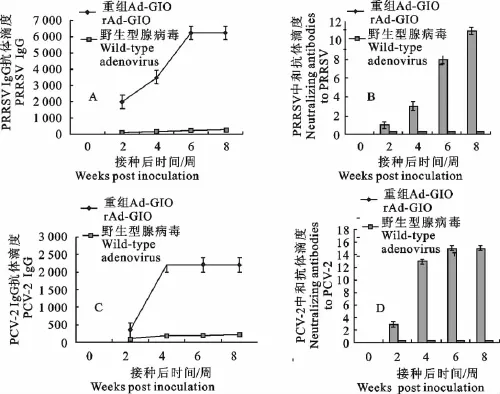
图5 免疫小鼠PRRSV、PCV-2特异性ELISA抗体和中和抗体检测结果Fig.5 ELISA assay for PRRSV and PCV-2specific antibodies and analysis of neutralization antibodies of sera in immunized mice
试验中采用的腺病毒载体系统是AdEasyTM系统[18],骨架载体质粒pAdEasy-1含有除El和E3基因外的腺病毒大部分DNA和人为添加的稀有酶切位点PacⅠ,大肠埃希菌BJ5183是一种用来做重组的细菌,菌体内有重组酶,可以使经PmeⅠ线性化含有目的基因的重组穿梭质粒和pAdEasy-1质粒发生同源重组。腺病毒包装受到很多外部因素的影响,如转染试剂与DNA的比例、所使用DNA的质量、包装细胞的生长状态等[19]。此外,在转染细胞时,最好每隔30min轻轻倾斜细胞培养皿,使腺病毒质粒DNA和细胞充分接触,从而提高转染效率。
小鼠免疫试验结果显示,小鼠接种重组腺病毒rAd-gio后能够产生针对PCV-2和PRRSV的特异性ELISA抗体和中和抗体,首免2周后和二免2、4、6周后,分别采取小鼠血清检测PCV-2与PRRSV的ELISA抗体和中和抗体,ELISA抗体检测结果表明,首免后2周即出现PRRSV特异性抗体,PRRSV和PCV-2抗体滴度分别到1∶2 000和1∶350,二免后抗体滴度进一步升高,二免后2周PRRSV和PCV-2抗体滴度分别到1∶3 500和1∶2 200,二免后4周PRRSV和PCV-2抗体滴度分别到1∶6 200和1∶2 200,并可一直持续到试验结束。中和抗体检测结果表明,在首免后2周免疫组中和抗体滴度均较低,二免后中和抗体效价逐渐升高,二免后4周PRRSV和PCV-2中和抗体水平分别达到1∶13和1∶8,二免后6周PRRSV和PCV-2中和抗体水平分别达到1∶15和1∶11。对照组没有检测到PRRSV和PCV-2特异性抗体。
本试验将PCV-2ORF2与PRRSV GP5基因串联重组到腺病毒表达载体中,并在293A细胞中成功包装成腺病毒,检测结果表明重组腺病毒能在293A细胞内表达ORF2和GP5蛋白。试验中选用的腺病毒表达载体已经进行了缺失E1(复制相关基因)和E3(毒性基因)基因人工改造,因此应用起来很安全。将该重组腺病毒免疫小鼠,用ELISA方法和病毒中和方法进行检测小鼠的体液免疫情况,结果显示重组腺病毒能诱导小鼠产生针对PCV-2和PRRSV的特异性ELISA抗体和中和抗体。将PRRSV GP5和PCV-2ORF2基因同时在同一载体中表达不仅可以一次完成免疫,避免反复免疫的麻烦,降低生产成本,减轻对动物造成的的免疫抑制,从而为预防PCV-2和PRRSV混合感染莫定了重要基础。
[1] 隋 慧,杨金生.猪繁殖与呼吸综合征和猪2型圆环病毒病二联核酸疫苗的构建及其免疫效力[J].安徽农业科学,2009,37(11):4991-4994.
[2] Harms P A,Halbur P G,Sorden S D,et al.Three cases of porcine respiratory disease complex associated with porcine circovirus type 2infection[J].J Swine Health Production,2002,10:33-38.
[3] Lunney J K,Benfield D A,Rowland R R.Porcine reproductive and respiratory syndrome virus:an update on an emerging and re-emerging viral disease of swine[J].Virus Res,2010,154(1-2):1-6.
[4] Zhou L,Yang H C.Porcine reproductive and respiratory syndromein China[J].Virus Res,2010,154(1-2):31-37.
[5] 沈武玲,乔自林,令世鑫,等.猪繁殖与呼吸综合征疫苗研究现状[J].动物医学进展,2012,33(1):117-120.
[6] 王宪文,王丽荣,姚四新,等.猪圆环病毒病的流行诊断和控制进展[J].中国兽医杂志,2012,48(4):60-61.
[7] 韩玉环,汤世坤,周双海,等.猪圆环病毒2型实时定量PCR检测方法的建立[J].北京农学院学报,2010,25(3):31-34.
[8] 陈 涛,闫若潜,谢彩华,等.猪圆环病毒2型ORF2基因的表达及活性研究[J].动物医学进展,2009,30(2):35-38.
[9] 王 林,吴发兴,吴美芹,等.PRRSV和PCV-2二重PCR检测方法的建立及初步应用[J].动物医学进展,2010,31(6):1-5.
[10] 杨柳絮,侯 磊,周 宇,等.PRRSVORF5基因和CSFVE2基因重组真核表达质粒的构建及小鼠免疫试验[J].动物医学进展,2009,30(6):4-9.
[11] 曾少灵,林庆燕,花群义,等.PRRSV云南A06株ORF5和ORF7基因的克隆与序列分析[J].动物医学进展,2010,31(3):12-17.
[12] 叶 芬,蔡家利.猪圆环病毒分子生物学研究进展[J].四川畜牧兽医,2010(10):26-28.
[13] 何 雷,张彦明,向 华,等.表达猪白介素2基因重组腺病毒的构建及其免疫增强作用[J].西北农业学报,2010,19(11):1-7.
[14] Sun Y,Liu D F,Wang Y F,et al.Generation and efficacy evaluation of a recombinant adenovirus expressing the E2protein of classical swine fever virus[J].Res Vet Sci,2010,88(1):77-82.
[15] Wu J Q,Barab N D,Chau D,et al.Complete protection of mice against a lethal dose challenge of western equine encephalitis virus aftter immunization with an adenovirus-vectored vaccine[J].Vaccine,2007,25(22):4368-4375.
[16] 李宏宇,孙 元,常天明,等.共表达猪繁殖与呼吸综合征病毒GP5基因和猪瘟病毒E2基因的重组腺病毒的构建及其在小鼠模型上的免疫原性分析[J].中国预防兽医学报,2010,32(3):161-166.
[17] 王先炜.猪圆环病毒2型人工感染和重组腺病毒基因工程疫苗研究[D].江苏南京:南京农业大学,2006.
[18] 陈邦党,马 翔,马依彤,等.细菌内同源重组法快速制备重组腺病毒[J].新疆医科大学学报,2009,32(12):1667-1669.
[19] Jinyong L,Zhong L D,Xiaoji L,et al.A protocol for rapid generation of recombinant adenoviruses using the AdEasy system[J].Nature,2007,10:1236-1247.
