利用固定化酶改善酸法大豆浓缩蛋白持水性和吸油性的研究
2011-11-06张春红
张春红,张 莹,赵 菲
(沈阳农业大学食品学院,辽宁沈阳110161)
利用固定化酶改善酸法大豆浓缩蛋白持水性和吸油性的研究
张春红,张 莹,赵 菲
(沈阳农业大学食品学院,辽宁沈阳110161)
利用固定化谷氨酰胺转胺酶(MTG)对酸法大豆浓缩蛋白(SPC)进行改性,并对改性SPC进行红外光谱分析。通过单因素和正交实验研究了MTG改性对SPC持水性和吸油性的影响。结果表明,当固定化MTG添加量1U/g,pH 6.0,50℃下反应2h时,改性后大豆浓缩蛋白的持水性和吸油性分别比对照提高了24.8%和64.5%;与大豆分离蛋白相比,其凝胶性和吸油性分别高出58.3%和27.0%,持水性则低8.0%。
酸法大豆浓缩蛋白,固定化MTG,改性,持水性,吸油性,红外光谱
众所周知,大豆浓缩蛋白和分离蛋白因其功能性良好被广泛应用于食品行业,两者在实际应用中既有相同点,又有许多不同点。相比较而言,大豆分离蛋白的蛋白质含量高,功能性好,但价格偏高;大豆浓缩蛋白的凝胶性优于分离蛋白,其持水性和吸油性稍差,但具有价格低的优势。MTG是一种蛋白质聚合酶,能够催化蛋白质分子之间发生交联反应。本文以酸法大豆浓缩蛋白为原料,以提高浓缩蛋白的持水性和吸油性为目的,采用固定化谷氨酰胺转胺酶进行改性,为扩大大豆浓缩蛋白的应用范围,提供一定的理论基础和实践经验[1-2]。
1 材料与方法
1.1 材料与仪器
大豆浓缩蛋白、大豆分离蛋白 山东新嘉华集团;谷氨酰胺转胺酶 江苏一鸣精细化工有限公司;壳聚糖 上海伯奥生物技术科技有限公司;牛血清蛋白 生化试剂;其他试剂 均为分析纯。
RVA-3D型快速粘度分析仪 澳大利亚Newport公司;傅立叶红外光谱仪 Thermo Nicolet Corporation,USA;PHS-3C精密pH计 上海雷磁仪器厂;UV2265紫外可见分光光度计 日本岛津;SH Y22A水浴恒温振摇器 江苏丹阳门科教仪器厂; TDL-5-A离心机 上海安亭仪器有限公司。
1.2 实验方法
1.2.1 固定化MTG的制备 壳聚糖→壳聚糖溶液+凝结剂→壳聚糖微球→戊二醛交联反应→清洗抽滤→载体→加酶反应→4℃过夜保存→抽滤清洗→固定化酶[3]
1.2.2 MTG酶活力的测定 采用比色法[4]。
1.2.3 固定化MTG添加量对酸法大豆浓缩蛋白持水性和吸油性的影响 配制底物浓度为10%的蛋白溶液,调节pH为7.0,分别加入1、5、10、15、20U/g的固定化MTG,50℃水浴2h。
1.2.4 固定化MTG作用温度对酸法大豆浓缩蛋白持水性和吸油性的影响 配制底物浓度为10%的蛋白溶液,调节pH为7.0,加入5U/g的固定化MTG,分别于40、45、50、55、60℃反应2h。
1.2.5 固定化MTG作用pH对酸法大豆浓缩蛋白持水性和吸油性的影响作用 配制底物浓度为10%的蛋白溶液,调节pH分别为5.5、6.0、6.5、7.0、7.5,加入5U/g的固定化MTG,50℃反应2h。
1.2.6 固定化MTG作用时间对酸法大豆浓缩蛋白持水性和吸油性的影响作用 配制底物浓度为10%的蛋白溶液,调节pH为6.0,加入5U/g的固定化MTG,50℃分别反应1.0、1.5、2.0、2.5、3.0h。
1.2.7 固定化MTG改性酸法大豆浓缩蛋白的正交实验设计 正交实验设计因素水平见表1。
1.2.8 蛋白质功能性的测定 蛋白质含量的测定:采用GB/T5009.5-2003;溶解性的测定:采用双缩脲比色法;凝胶性的测定:采用RVA-3D快速粘度分析仪;持水性和吸油性的测定:将1g样品放入蒸馏水或豆油中搅拌,2000r/min离心30min,测量上清液的体积。持水性和吸油性分别用1g样品所持水和油的克数表示;乳化性和乳化稳定性的测定:将1.5g样品,分散于30mL水中,加入30mL豆油,匀浆机中均质1min后于2000r/min离心5min。上述乳化液置于80℃水浴中加热30min后,自来水中冷却至室温,再于2000r/min离心5min。乳化性为乳化层高度与液体总高度之比,乳化稳定性为30min后乳化层高度与原始乳化层高度之比;起泡性和泡沫稳定性:将2g样品,悬浮于100mL水中,在匀浆机中均质2min,停止均质后立即量出泡沫总体积。将此样品静置30min后,量出下层析出液的体积。起泡性为均质停止时泡沫体积与原溶液体积之比,泡沫稳定性为静置30min后泡沫体积与均质停止时泡沫体积之比[5]。
1.2.9 FTIR分析 样品和KBr以1∶50的比例混合,扫描次数16,分辨率4。
2 结果与讨论
2.1 固定化MTG的操作稳定性
用pH6.0的缓冲液浸泡固定化MTG,在50℃放置2h(模拟与底物反应),重复测定固定化酶的酶活。从图1可以看出,固定化酶连续反应10次,酶活仍维持在75%以上。

图1 固定化MTG的操作稳定性
2.2 固定化MTG添加量对大豆浓缩蛋白持水性和吸油性的影响
由图2可知,随固定化MTG添加量的增大,持水性和吸油性呈先增大后减小的趋势,当加酶量为5U/g时,持水性和吸油性达到最大。分析原因可能是由于有限的底物浓度决定了有限的酰氨基和氨基的共价交联反应。因此,适宜的固定化MTG添加量为5U/g。

图2 加酶量对SPC持水性和吸油性的影响
2.3 固定化MTG作用温度对大豆浓缩蛋白持水性和吸油性的影响
由图3可知,随温度的升高,持水性和吸油性呈先增大后减小的趋势,当作用温度为50℃时,持水性和吸油性均达到最大。因此,适宜的反应温度为50℃。

图3 温度对SPC持水性和吸油性的影响
2.4 固定化MTG作用pH对大豆浓缩蛋白持水性和吸油性的影响
由图4可知,随pH的增大,持水性和吸油性呈先增大后减小的趋势,当作用pH为6.0时,持水性和吸油性均达到最大。分析原因可能是由于pH影响固定化MTG的空间构象、所带电荷量及活性基因的解离状态,从而影响固定化MTG的活力和蛋白质的功能性。因此,适宜的pH为6.0。

图4 pH对SPC持水性和吸油性的影响
2.5 固定化MTG作用时间对大豆浓缩蛋白持水性和吸油性的影响
由图5可知,随时间的延长,持水性和吸油性均呈增大的趋势,但2h后,持水性和吸油性的变化均不明显。因此,确定适宜的MTG反应时间为2h。
2.6 固定化MTG改性酸法大豆浓缩蛋白的正交实验
由表1可以看出,影响持水性的主次顺序为:反应温度>反应pH>固定化MTG添加量>反应时间,最佳处理组合为A2B2C2D1。影响吸油性的主次顺序为:反应温度>反应pH>反应时间>固定化MTG添加量,最佳处理组合为A1B2C2D2。综合考虑各因素对功能性的影响大小和经济效益,最终确定最佳处理组合为A1B2C2D2,即固定化MTG添加量1U/g,反应pH 6.0,50℃条件下反应2h。
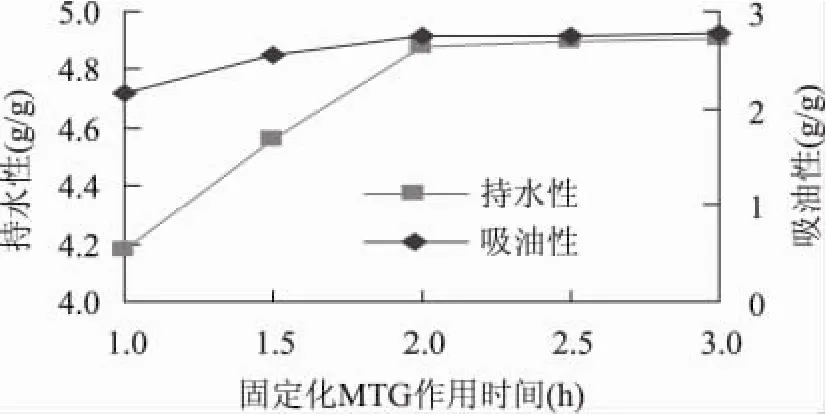
图5 时间对SPC持水性和吸油性的影响

表1 固定化MTG改性酸法大豆浓缩蛋白的正交实验结果
2.7 FTIR分析
从图6和图7中可看出,改性前SPC的特征吸收峰为:3289.26cm-1出现吸收峰是“酰胺 A吸收带”,即N-H的伸缩振动;1659.73cm-1出现“酰胺Ⅰ吸收带”,即C=O的伸缩振动;1532.33cm-1是“酰胺Ⅱ吸收带”,即C-N伸缩振动或N-H的弯曲振动; 1239.01cm-1为“酰胺Ⅳ吸收带”,即C-N伸缩振动或C-O的伸缩振动。经固定化MTG改性的大豆浓缩蛋白的酰胺的几个特征吸收带发生了变化: 3289.26cm-1和1532.33cm-1处的吸收向高波数位移,1659.73cm-1处的吸收向低波数位移,1239.01cm-1处吸收峰消失[6]。表明MTG只是对某些特殊氨基酸残基起作用,形成共价交联,对大多数氨基酸残基没有影响。同时验证了MTG通过改变大豆浓缩蛋白的微观结构,改变了大豆浓缩蛋白的功能性。
2.8 蛋白质功能性的比较
经MTG改性的大豆浓缩蛋白与未改性的大豆浓缩蛋白(对照)和分离蛋白功能性的比较见表2。

图6 改性前大豆浓缩蛋白FTIR谱图
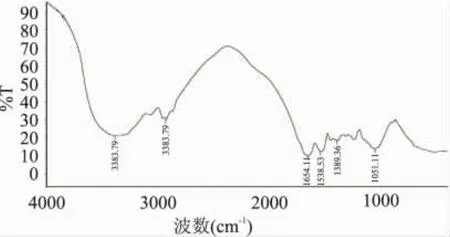
图7 MTG改性后大豆浓缩蛋白FTIR谱图
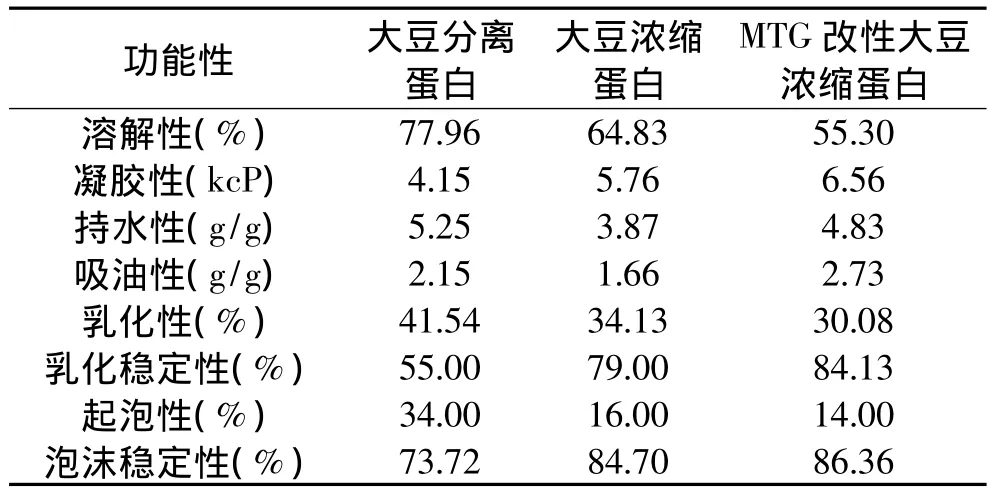
表2 MTG改性大豆浓缩蛋白与未改性的大豆浓缩蛋白和分离蛋白功能性的比较
从表2中可知,经MTG改性后,大豆浓缩蛋白的持水性和吸油性分别比对照提高了24.8%和64.5%;与大豆分离蛋白相比,凝胶性和吸油性分别高出58.3%和27.0%,持水性则降低8.0%。
3 结论
3.1 MTG改性酸法大豆浓缩蛋白的最佳条件为:固定化MTG添加量1U/g,pH 6.0,50℃下反应2h,此时大豆浓缩蛋白的持水性和吸油性分别为4.83g/g和2.73g/g,比对照提高了24.8%和64.5%。
3.2 与大豆分离蛋白相比,改性后酸法大豆浓缩蛋白的凝胶性和吸油性分别高出58.3%和27.0%,持水性则低8.0%。
[1]Allaoua Achouri,Wang Zhang.Effect of succinylation on the physicochemical properties of soy protein hydrolysate[J].Food Research International,2001,34:507-514.
[2]曲玲,张春红,刘长江.大豆分离蛋白的复合改性及其对某些功能性的影响[J].食品工业科技,2007,28(2):71-73.
[3]张春红,高慧楠,常南,等.以壳聚糖为载体固定化谷氨酰胺转氨酶的研究[J].食品科技,2009,34(12):33-35.
[4]唐传核,杨晓泉,陈中,等.微生物转谷氨酰胺酶(MTGase)的蛋白质底物催化特性及其催化机理研究(I)MTGase催化单底物蛋白质的聚合特性[J].食品科学,2003,24(5):19-24.
[5]江志炜,沈蓓英,潘秋琴.蛋白质加工技术[M].北京:化学工业出版社,2002:188-195.
[6]Preeti Lodha,Anil N Netravali.Thermal and mechanical properties of Environment friendly‘greenn’plastics from stearic acid modified soy protein isolate[J].Industrial Crops and Products,2005,21:49-64.
Study on promoting the water holding and oil absorption capacity of acid leached soy protein concentrate by immobilized transglutaminase
ZHANG Chun-hong,ZHANG Ying,ZHAO Fei
(College of Food,Shenyang Agriculture University,Shenyang 110161,China)
In this paper,acid leached soy protein concentrate(SPC)was modified by immobilized transglutaminase (MTG),and infrared spectrum was used to analyze SPC.The influence of MTG on water holding and oil absorption capacity was researched by single factor and orthogonal experiment.The results showed that when the addition of immobilized MTG was 1U/g,pH was 6.0,temperature was 50℃,time was 2h,the water holding and oil absorption capacity were 24.8%and 64.5%higher than unmodified SPC gel.The property and oil absorption capacity were increased 58.3%and 27.0%,water holding capacity decreased 8.0%compared with soy protein isolate.
acid leached soy protein concentrate;immobilized MTG;modification;water holding capacity;oil absorption capacity;infrared spectroscopy
TS201.2+5
A
1002-0306(2011)03-0208-04
2010-04-08
张春红(1968-),女,博士,副教授,主要从事植物蛋白质、酶工程方面的研究。
