前胡甲素对小鼠局灶性脑缺血的保护作用
2010-05-07杨武双滕伯刚杨立朝
杨武双,滕伯刚,杨立朝,周 宇,王 瑶,金 鑫
(1.厦门市中医院 神经外科,福建 厦门 361009;2.厦门大学 医学院 药学系,福建 厦门 361005)
前胡甲素(dl-praeruptorin A,Pd-Ia)是伞形科植物白花前胡根中提出的一种角型吡喃香豆精(angular,typepyranocoumarin)[1]。Pd-Ia作为一种钙阻滞剂和钾通道开放剂,对心肌缺血具有保护作用[2-3]。常天辉等[3-4]给心肌急性缺血再灌注(MIR)大鼠同时静脉注射Pd-Ia,能抑制血清IL-6水平,降低心肌凋亡刺激蛋白Fas、提高bcl-2/bax的比率,作用与硝苯地平接近。姜明燕等[5]对MIR大鼠心肌超微结构的影响进行观察,静脉注射白花前胡及Pd-Ia的MIR大鼠心肌纤维排列较为整齐,线粒体丰富,虽见轻度肿胀,但包膜完整,形态规则,染色质较均匀,亦提示其对心肌细胞有保护作用。涂欣等[6]采用大鼠局灶性脑中动脉缺血(MCAO)模型,给予白花前胡水醇提取物后,可明显降低模型大鼠血清中的IL-6、IL-8水平。董梦久等[7]发现白花前胡提取物能明显抑制MCAO大鼠脑组织中Caspase-3蛋白表达,提示前胡提取液对脑缺血再灌注损伤有保护作用。
由于前胡提取液对脑缺血再灌注损伤有保护作用,其主要成分Pd-Ia对心肌缺血的保护作用也已被证实,而心肌缺血与脑缺血的治疗机制又有相同之处。目前未见Pd-Ia对脑缺血再灌注损伤保护作用的报道,本实验建立小鼠脑缺血模型,探讨Pd-Ia对脑缺血损伤的保护作用及特点。
1 材料与方法
1.1 材料
1.1.1 动物 健康昆明种小鼠,♂,体重25~30 g,由厦门大学医学院实验动物中心提供,合格证号:SYXK(闽)2008-0003。自然光照周期饲养,术前12 h禁食,自由饮水。
1.1.2 药品及试剂 Pd-Ia(批号:090305,纯度>98%),上海融禾医药科技发展有限公司产品,临用前用含10%二甲基亚砜(DMSO)的生理盐水配置;2,3,5-三苯基氯化四氮唑(TTC),美国Amresco公司产品;丙二醛(MAD)测试试剂盒(批号:20081120)、超氧化物歧化酶(SOD)测试试剂盒(批号:20081120)均购自南京建成生物工程研究所;其余试剂均为市售分析纯。
1.1.3 仪器 SpectraMax M2型多功能酶标仪,美国分子仪器公司;DKZ-2型电热恒温振荡水槽,上海精宏实验设备有限公司。
1.2 方法
1.2.1 局灶性脑缺血/再灌注模型制备 参照Longa等[8]建立的方法制备小鼠右侧大脑MCAO模型。小鼠用10%水合氯醛(4mL/kg)腹腔注射麻醉,仰卧固定在手术台上。颈部正中切口,钝性分离颈总动脉,将头端用聚胺酯处理的直径为0.108 mm的尼龙丝线经颈总动脉切口插入颈内动脉,微遇阻力时即停止,线栓插入总长度自颈总动脉分叉部记为(1.6±0.1)cm。缺血1.5 h后拔除线栓,即恢复血供。动物术中及术后麻醉清醒前给予保温。动物苏醒后出现对侧肢体运动障碍即为模型制备成功。
1.2.2 动物分组与给药 实验小鼠随机分为5组:①假手术组:术前0.5 h腹腔注射溶媒(10%DMSO)10 mL/kg;②模型组:术前0.5 h腹腔注射溶媒(10%DMSO)10 mL/kg;③、④、⑤分别为Pd-Ia高、中、低剂量组,即缺血前0.5 h分别腹腔给予Pd-Ia 10,5,1 mg/kg。
另取实验小鼠随机分为6组:①假手术组:术前0.5 h腹腔注射溶媒(10%DMSO)10 mL/kg;②模型组:术前0.5 h腹腔注射溶媒(10%DMSO)10 mL/kg;③~⑧分别为缺血前0.5,1 h组、缺血同时组、再灌注同时、再灌后0.5 h组、再灌后1 h组在相应的时间点腹腔给予Pd-Ia 5 mg/kg。
1.2.3 神经功能缺失评分 参照Bederson等[9]建立的分级法于缺血再灌注24 h后对各组动物进行神经功能缺失评分。0:无症状;1:提尾时,损伤对侧前肢不能伸直;2:向损伤对侧推力下降;3:向损伤对侧转圈。
1.2.4 脑梗死灶体积及脑水肿的测定 采用小鼠脑片TTC染色法。小鼠于再灌注24 h后断头取脑,迅速置-18℃冷冻,15 min后取出在冰台上由前向后切成2.0 mm厚的切片5片,将切片立即置于1%TTC中避光37℃恒温孵育30 min。未受损的正常脑组织染色后呈红色,梗死组织不着色而呈白色。而后放入4%多聚甲醛中避光保存24 h,经数码相机拍照并输入电脑,应用图像处理与分析软件计算脑片梗死区域面积及两侧半球的面积,将每一脑片的梗死面积或半球面积乘以间隔的厚度(2 mm),再将各脑片数值相加,得到脑梗死体积及脑半球体积的近似值。用“(损伤侧脑半球体积-非损伤侧脑半球体积)/非损伤侧脑半球体积”来反映脑水肿程度。1.2.5 血清中SOD、MDA的测定 血清中SOD活性及MDA含量分别采用黄嘌呤氧化酶法和硫代巴比妥酸法进行测定,按照试剂盒说明书进行操作。
1.3 统计学处理
2 结 果
2.1 Pd-Ia对脑缺血小鼠神经功能缺失评分的影响
缺血再灌注后,小鼠出现明显的神经功能缺失症状,主要表现为提尾悬空时的强迫体态—左前肢紧贴躯体向左侧扭转以及运动时的追尾征—向左侧旋转或倾倒。Pd-Ia(5,10 mg/kg)缺血前0.5 h给药能显著减轻小鼠神经功能损伤(P<0.01);Pd-Ia(5 mg/kg)缺血前0.5 h、缺血同时、再灌注同时及再灌注后0.5 h给药,均可改善明显小鼠神经功能损伤(P<0.05或 P<0.01),结果见表1。
2.2 Pd-Ia对脑缺血小鼠脑梗死体积的影响
缺血再灌注后,小鼠缺血侧额顶叶皮层和皮层下区(纹状体,海马等)可见明显的苍白梗死灶。Pd-Ia(5,10 mg/kg)缺血前0.5 h给药能显著减小脑梗死体积(P<0.01),其中以5 mg/kg给药改善作用最明显,结果见表 1。Pd-Ia(5,10 mg/kg)缺血前0.5 h给药能显著降低大脑皮层梗死体积分别达73.48%和62.98%(P<0.01),而对皮层下区梗死体积只降低26.28%和1.92%(P>0.05),结果见表 2。Pd-Ia(5 mg/kg)不同时间点给药,在缺血前1,0.5 h、缺血同时、再灌注同时及再灌后0.5 h 5个时间点给药均能显著减小脑梗死体积(P<0.01),结果见表1。
表1 Pd-Ia对小鼠MCAO后神经功能缺失评分,脑梗死体积,脑水肿程度的影响(n=8,)Tab.1 Effects of Pd-Ia on neurological deficit score,infarct volum and brain edema after MCAO in mice(n=8,)

表1 Pd-Ia对小鼠MCAO后神经功能缺失评分,脑梗死体积,脑水肿程度的影响(n=8,)Tab.1 Effects of Pd-Ia on neurological deficit score,infarct volum and brain edema after MCAO in mice(n=8,)
与假手术组比较:1P<0.05,2P<0.01;与模型组比较:3P<0.05,4P<0.01 1P<0.05,2P<0.01 vs sham group;3P<0.05,4P<0.01 vs model group
组别 剂量/(mg/kg) 神经功能缺失评分 脑梗死体积/mm3 脑水肿程度/%假手术组 - 0.00±0.00 0.00±0.00 0.00±0.00模型组 - 2.80±0.692 188.00±44.192 16.70±3.552 Pd-Ia高剂量组 10 1.40±0.522,4 82.43±18.442,4 11.39±1.902,4 Pd-Ia中剂量组 5 1.20±0.522,4 71.43±20.182,4 10.46±3.202,4 Pd-Ia低剂量组 1 2.40±0.422 166.80±42.192 15.38±2.712缺血前1 h组 5 1.63±0.512 79.00±48.672,4 9.42±3.112缺血前0.5 h组 5 1.28±0.692,4 62.67±25.372,4 8.45±3.102,3缺血同时组 5 0.94±0.321,4 49.67±26.334 5.53±1.742,4再灌同时组 5 0.88±0.231,4 47.67±16.824 4.47±1.371,4再灌后0.5 h组 5 1.50±0.532,3 70.29±18.562,4 8.37±2.102,3再灌后1 h组 5 1.61±0.672 118.70±54.512 11.65±2.692
2.3 Pd-Ia对脑缺血小鼠脑水肿程度的影响
缺血再灌注后,小鼠损伤侧脑组织可见明显水肿,结果见表1。Pd-Ia(5,10 mg/kg)缺血前0.5 h给药能显著减轻脑水肿程度(P<0.01),且以5 mg/kg给药改善作用最明显。Pd-Ia(5 mg/kg)缺血前0.5 h、缺血同时、再灌注同时及再灌后0.5 h给药,均可减轻脑水肿程度(P<0.05或P<0.01),其中以再灌注同时给药效果最显著,与模型组比,其降低脑水肿程度达63.04%。
2.4 不同剂量Pd-Ia对脑缺血损伤小鼠血清中SOD活性和MDA含量的影响
与假手术组比较,缺血损伤组小鼠血清中SOD活性明显降低,MDA含量明显升高(P<0.01);与模型组比较,Pd-Ia(5,10 mg/kg)给药均能明显提高SOD活性,降低MDA含量(P<0.05或P<0.01),结果见表2。
表2 Pd-Ia对小鼠MCAO后皮层和皮层下区域梗死体积及血清中SOD活性和MDA含量的影响(n=8,)Tab.2 Effects of Pd-Ia on cortical and subcortical infarct volume,the activities of SOD and the contents ofMDA after MCAO in mice(n=8,)
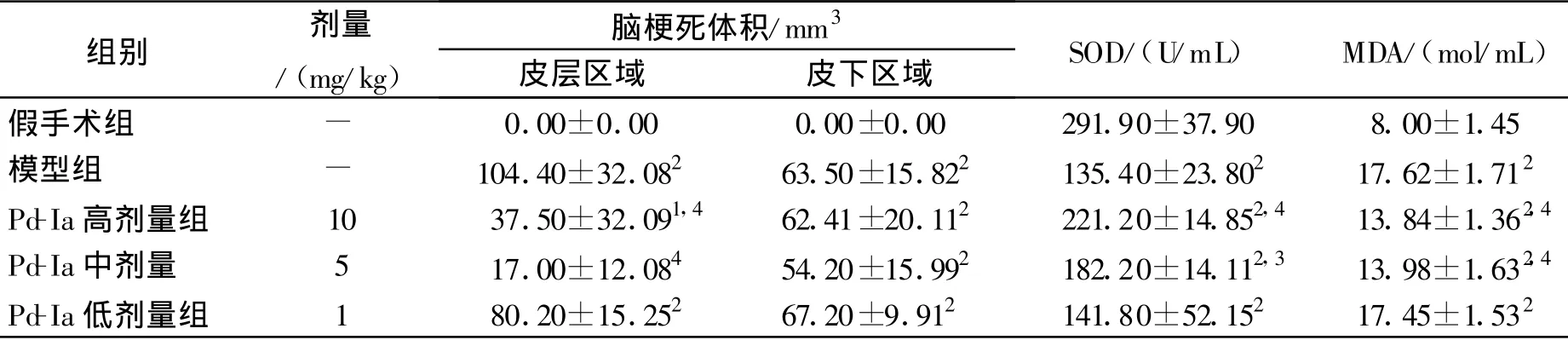
表2 Pd-Ia对小鼠MCAO后皮层和皮层下区域梗死体积及血清中SOD活性和MDA含量的影响(n=8,)Tab.2 Effects of Pd-Ia on cortical and subcortical infarct volume,the activities of SOD and the contents ofMDA after MCAO in mice(n=8,)
与假手术组比较:1P<0.05,2P<0.01;与模型组比较:3P<0.05,4P<0.01 1P<0.05,2P<0.01 vs sham group;3P<0.05,4P<0.01 vs model group
3 讨 论
本实验采用经典脑缺血模型—小鼠MCAO模型,观察了钙阻滞剂Pd-Ia对脑缺血损伤的作用及特点。实验结果显示,Pd-Ia对脑缺血损伤小鼠神经保护作用的有效剂量为5和10 mg/kg,小剂量(1 mg/kg)无保护作用。并发现剂量为5 mg/kg时的保护作用要比10 mg/kg时明显,提示在一定剂量范围内Pd-Ia的治疗效应随剂量增加而增大,但超过该限度,随着其剂量的增加,抗脑缺血的效应却不一定增强。Pd-Ia在脑缺血小鼠的用量应在5 mg/kg左右,此剂量抗脑缺血作用最明显。另外还发现Pd-Ia对脑缺血损伤的改善部位在皮层区域,而对皮层下区域没有改善作用。其原因可能是作为脑缺血中心部位的纹状体和海马损伤较为严重,药物难以改善;而位于缺血周边区的脑皮质区损伤较轻,药物可发挥明显的保护作用,是药物重点救治的部位。
另外,本实验还观察了Pd-Ia神经保护作用的时间窗。Pd-Ia在缺血前0.5 h、缺血同时及再灌注同时给药均能改善小鼠神经功能损伤,减小脑梗死体积和减轻脑水肿程度,其中以再灌注同时给药效果最显著;而在缺血前1 h只对脑梗死体积具有改善作用而不能减轻神经功能缺失和脑水肿程度。这些结果提示Pd-Ia抗脑缺血损伤具有较宽的治疗时间窗,最佳的救治时间点是再灌注同时。研究表明,脑缺血后,脑组织从可逆性损伤到不可逆性损伤转变的关键时期是恢复血供过程,而非缺血过程。因此,再灌注同时应是药物救治的关键时机[10]。本研究结果也表明Pd-Ia在再灌注同时给药,其抗脑缺血损伤效果最为显著,掌握好这一最佳的治疗时间点是Pd-Ia发挥脑缺血损伤后神经保护作用的关键。
实验结果表明,Pd-Ia能显著提高脑缺血损伤小鼠血清中SOD活性,减少氧自由基作用于膜脂质生成的MDA,故可增强内源性氧自由基的清除功能。这从侧面为Pd-Ia具有保护脑缺血损伤提供了理论依据。此外,Pd-Ia作为Ca2+通道阻滞剂和K+通道开放剂还有可能通过阻滞Ca2+内流使细胞Ca2+减少,继而减少因蛋白水解酶引起黄嘌呤氧化酶转化,减少活性氧的产生;通过激活ATP敏感性K+通道(K-ATP)抑制脑缺血时白细胞介导的氧自由基产生并减少自由脂肪酸等有害代谢物形成[11]。
综上所述,Pd-Ia具有抗脑缺血损伤作用,对小鼠治疗的最佳剂量为5 mg/kg,最佳治疗时间点是再灌注同时;Pd-Ia还可以提高脑缺血损伤小鼠血清中SOD活性,降低MDA含量。因此,提高脑缺血后的抗氧化水平等可能是Pd-Ia抗脑缺血损伤作用的机制之一。
[1]潘淳.中药前胡质量控制的研究概况[J].华夏医学,2004,17(5):862-864.
[2]常天辉,陈磊,姜明燕,等.白花前胡对麻醉开胸猫急性心肌梗死的影响[J].中国医科大学学报,2000,29(2):84-87.
[3]常天辉,刘晓阳,章新华,等.白花前胡及前胡甲素对心肌缺血再灌注大鼠IL-6水平及Fas、bax、bcl-2蛋白表达的影响[J].中国医科大学学报,2003,32(1):1-6.
[4]刘晓阳,常天辉.白花前胡甲素对急性缺血再灌注大鼠心肌及Fas蛋白及血清IL-6水平的影响[J].沈阳药科大学学报,2002,19(5):348-351.
[5]姜明燕,徐亚杰,杜震,等.大鼠急性心肌缺血/再灌注损伤时心肌超微结构的变化与白花前胡及前胡甲素的保护作用[J].沈阳药科大学学报,2004,21(1):59-61.
[6]涂欣,王晋明,周晓莉,等.白花前胡提取物对大脑中动脉梗塞大鼠IL-6及IL-8的影响[J].中国药师,2004,7(3):163-165.
[7]董梦久,涂晋文,周晓莉.复方前胡液对大脑中动脉缺血再灌注大鼠Caspase-3蛋白表达的影响[J].中国临床药理学与治疗学,2005,10(1):40-43.
[8]Longa E Z,Weinstein P R,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[9]Bederson J B,Pitts L H,Tsuji M,et al.Rat middle cerebral artery occlusion:evaluation of model and development of neurologic examination[J].Stroke,1986,7(3):472-476.
[10]Rothrock J F,Hart RG.Antithrombotic therapy in cerebrovascular disease[J].Ann InternMed,1991,115(11):885-895.
[11]姜明燕,徐亚杰,沈君.白花前胡及前胡甲素对大鼠急性心肌缺血/再灌注损伤时血清中SOD,MDA的影响[J].中国药学杂志,2002,37(8):623-324.
