马铃薯主栽品种抗马铃薯金线虫鉴定及抗性分子标记检测
2024-04-24黄立强江如朱波汁彭焕许翀宋家雄陈敏李永青黄文坤彭德良
黄立强,江如,朱波汁,彭焕,许翀,宋家雄,陈敏,李永青,黄文坤,彭德良
马铃薯主栽品种抗马铃薯金线虫鉴定及抗性分子标记检测
黄立强1,江如1,朱波汁1,彭焕1,许翀2,宋家雄2,陈敏2,李永青2,黄文坤1,彭德良1
1中国农业科学院植物保护研究所植物病虫害综合治理全国重点实验室,北京 100193;2云南省昭通市植保植检站,云南昭通 657000
【目的】马铃薯金线虫()是国际公认的重要检疫性有害生物,目前已在云南、贵州、四川3省7县(市)发生危害,产区内多个种薯基地受到传播威胁。通过西南地区马铃薯主栽品种对马铃薯金线虫的抗性鉴定、分子标记检测及田间抗性评价,明确已知抗病基因的分布情况,为该地区马铃薯金线虫应急防控、抗病品种合理布局和良种推广提供依据。【方法】利用云南马铃薯金线虫群体对15份马铃薯主栽品种进行室内盆栽接种,计算最终单株孢囊数和相对感病性,根据抗性等级划分标准进行抗性评价;同时利用57R和TG689分子标记鉴定抗马铃薯金线虫,以-胡萝卜素羟化酶基因的BCH分子标记为对照;并于2020年和2021年在云南省昭通市开展两年度的田间试验,在播种前和收获后分别采集土壤样品并分离孢囊,计算播种前初始群体密度(Pi)、最终群体密度(Pf)及平均繁殖系数(Pf/Pi)。马铃薯现蕾至始花期测定株高,收获时测定产量。【结果】15个马铃薯主栽品种中的云薯505、宣薯5号、会薯15号、会薯19号以及云薯304共5个品种为高抗品种,马铃薯金线虫基本不能在这些品种上繁殖;丽薯6号、宣薯6号为中感品种;其余8个为高感品种,尤其是会-2、丽薯15号以及宣薯8号的平均繁殖系数高于感病对照品种会薯16号(Pf/Pi=17.15)。两个基因鉴定分子标记结果大致相同,5个马铃薯品种,即云薯505、宣薯5号、会薯15号、云薯304和宣薯6号含。马铃薯金线虫的繁殖系数在田间抗/感马铃薯品种上具有显著性差异,抗性等级为9的高抗品种田间平均繁殖系数在2021年(0.04—0.12)和2022年(0.05—0.14)均<1.00,表明高抗品种种植后线虫田间群体密度有一定程度的降低。高感品种平均繁殖系数在2021年(1.18—2.75)和2022年(1.76—3.24)均>1.00,高感品种种植后田间线虫种群数量增加。不同品种间株高和产量差异显著(<0.05),5个高抗品种株高的均值在两年间均显著高于8个高感品种。宣薯5号、会薯15号和会薯19号产量最高,两年度分别为51.67—56.48和33.28—40.57 t·hm-2,会-2产量最低。【结论】西南混作区主栽马铃薯高抗品种对马铃薯金线虫具有优良抗性,主要携带抗病基因且能够显著减少田间马铃薯金线虫群体密度。高抗品种中宣薯5号、会薯15号和会薯19号为高产抗病良种,云薯304为富锌薯片加工型品种。亟待根据马铃薯金线虫的发生分布,进一步有针对性地扩大对主栽品种抗性水平的鉴定。
马铃薯金线虫;马铃薯抗性品种;抗病基因;分子标记检测
0 引言
【研究意义】马铃薯()作为我国的第四大粮食作物,其种植面积和产量均居世界第一,在全国范围内均有种植,尤其是在贫困地区种植面积较大,在保障粮食安全和脱贫攻坚战中发挥了重要作用。马铃薯金线虫()是国际公认的重要检疫性有害生物,严重危害马铃薯,寄生番茄、茄子等126种茄科植物[1-3]。2018年我国在贵州省首次发现马铃薯金线虫,目前已在云南、贵州、四川3省7县(市)发现该线虫的发生危害[4-7]。种植抗病品种仍然是其最具经济效益和生态效益的防治方法,筛选可直接用于马铃薯金线虫防控的现有主栽马铃薯品种对有效遏制金线虫的扩散蔓延具有重要意义,可为我国马铃薯金线虫应急防控和可持续防控技术提供重要科学依据。【前人研究进展】马铃薯金线虫发生后一般对马铃薯造成20%—30%的产量损失,发病严重时损失可高达80%—90%,甚至绝收[8]。该线虫属固着性内寄生线虫,以鞣质孢囊在土壤内越冬、滞育。由于孢囊拥有极强抵抗不良环境和杀线虫剂的能力,这也成为该线虫难以被根除的主要原因。马铃薯金线虫已在六大洲超过100个国家发生[3,9]。由于其危害严重,美国、欧盟、欧洲和地中海植物保护组织(EPPO)和中国在内的全球106个国家和组织将其列为进境植物检疫性有害生物[1,3,10]。2020年,我国已将马铃薯金线虫纳入《全国农业植物检疫性有害生物名单》。马铃薯金线虫的传播方式分为近距离和远距离传播,前者以2龄幼虫在土壤中做10—50 cm的短距离移动,而后者可经由风、雨水、家畜和野生动物、马铃薯种薯或商品、加工用块茎及农事操作、农具和交通工具等粘带孢囊而传播[11-12]。前人利用具有不同抗性位点的一套马铃薯鉴别寄主可将马铃薯金线虫划分为Ro1—Ro5 5种致病型[13]。Ro1致病型是全世界马铃薯产区分布最为广泛的致病型,而是位于马铃薯野生种ssp.5号染色体上的一个显性基因,其对马铃薯金线虫Ro1型具有优异抗性[14-16]。目前,种植抗病品种仍然是防治该线虫最经济有效的措施。长期以来,科研人员在马铃薯种质资源筛选、抗病基因发掘与鉴定和育种应用方面开展了大量的研究工作[14,17-21]。Park等[22]通过57R和TG689分子标记及盆栽接种对38个马铃薯品种和350份育种材料进行鉴定比较,评价认为这两种分子标记抗性鉴定能力均较高,分别为99.7%和98.3%,任何一个标记都可以满足抗病育种中对马铃薯金线虫抗性鉴定的需求;de Boer等[23]比较了马铃薯抗/感品种在田间对澳大利亚马铃薯金线虫群体繁殖系数的影响,证实携带的马铃薯抗性品种可以有效减少马铃薯金线虫Ro1型的种群数量;明会等[24]利用6个抗马铃薯金线虫相关分子标记对我国875份马铃薯种质资源进行抗性鉴定,筛选得到211份马铃薯种质含有抗马铃薯金线虫的。【本研究切入点】马铃薯金线虫目前在我国云南、贵州、四川3省发生危害,产区内多个种薯基地受到传播威胁,为该线虫的防治工作带来严峻挑战。而现今我国西南混作区主栽马铃薯品种对该线虫的抗性水平仍不明确,品种田间抗/感表现及其对线虫群体的影响尚不清楚,亟待筛选优质、高抗品种以满足马铃薯金线虫综合防控技术措施需求。【拟解决的关键问题】通过对15份马铃薯西南混作区主栽马铃薯品种进行盆栽接种及抗性评价并结合抗马铃薯金线虫基因分子标记鉴定,比较抗/感品种的田间表现,分析主栽品种对马铃薯金线虫的抗性水平,为该地区马铃薯金线虫应急防控形势下马铃薯品种合理布局和良种推广提供参考。
1 材料与方法
1.1 材料
供试马铃薯金线虫群体采自我国云南省昭通市的马铃薯根系及根际土壤,所有样品保存于中国农业科学院植物保护研究所植物病虫害综合治理全国重点实验室。量取200 mL充分混匀的根际土壤样品,利用浅盘法或淘洗过筛法分离孢囊、雌虫及2龄幼虫[25-26]。孢囊保存于1.5 mL离心管中,4 ℃留存备用。
供试马铃薯为马铃薯西南混作区部分主栽品种,共15份。感病对照品种为会薯16号。本试验完成后所有材料均经高温灭菌处理。
1.2 室内盆栽接种
1.2.1 马铃薯育苗与移栽 盆栽接种鉴定于2019年5—8月在中国农业科学院植物保护研究所植物病虫害综合治理全国重点实验室P3隔离温室进行。试验方法参照EPPO PM 7/40 (5)马铃薯金线虫和马铃薯白线虫()诊断技术标准以及PM 3/68 (1)马铃薯品种对马铃薯孢囊线虫抗性评价鉴定标准[27-28]。种薯用1%次氯酸钠溶液浸泡消毒30 min,无菌水冲洗3—5次。切下以马铃薯单芽眼为中心约3 cm3的薯块于湿沙中育苗,芽长至3—5 cm后,移栽至含有800 mL灭菌土(沙﹕土= 2﹕1)的花盆中。每个品种设置4个技术重复和2个生物学重复。
1.2.2 马铃薯金线虫卵悬浮液制备及接种 挑取饱满深棕色孢囊置于100目筛网上,下方放置600目筛网。用试管塞在筛网上轻轻研磨孢囊,并用流水将卵冲洗到下方筛网中,最后将卵收集到烧杯中制备成1 000粒卵/mL的卵悬浮液。
马铃薯苗移栽生长一周后,用竹签在花盆内戳4个5 cm深度的孔洞。取马铃薯金线虫卵悬浮液进行接种,每盆接种4 mL卵悬浮液。初始群体密度(Pi)为5粒卵/mL土,每盆约接种13个孢囊。接种后,置于隔离温室内培养,培养条件为温度16—22 ℃,白天光照16 h,夜晚黑暗8 h,每3 d浇水200 mL,2周浇一次N-P-K 20-20-20水溶营养液。
1.2.3 室内盆栽接种抗性评价 接种15周后,分离并计数单株孢囊数。以会薯16号作为感病对照品种,计算供试马铃薯品种对感病对照品种的相对感病性。相对感病性(%)=(Pf供试马铃薯品种/Pf感病对照品种)×100,Pf(The final population)代表最终孢囊数量。根据供试马铃薯品种Pf与感病对照品种Pf的相对感病性进行抗性评价。马铃薯品种对马铃薯金线虫的抗性等级划分标准见表1[28]。
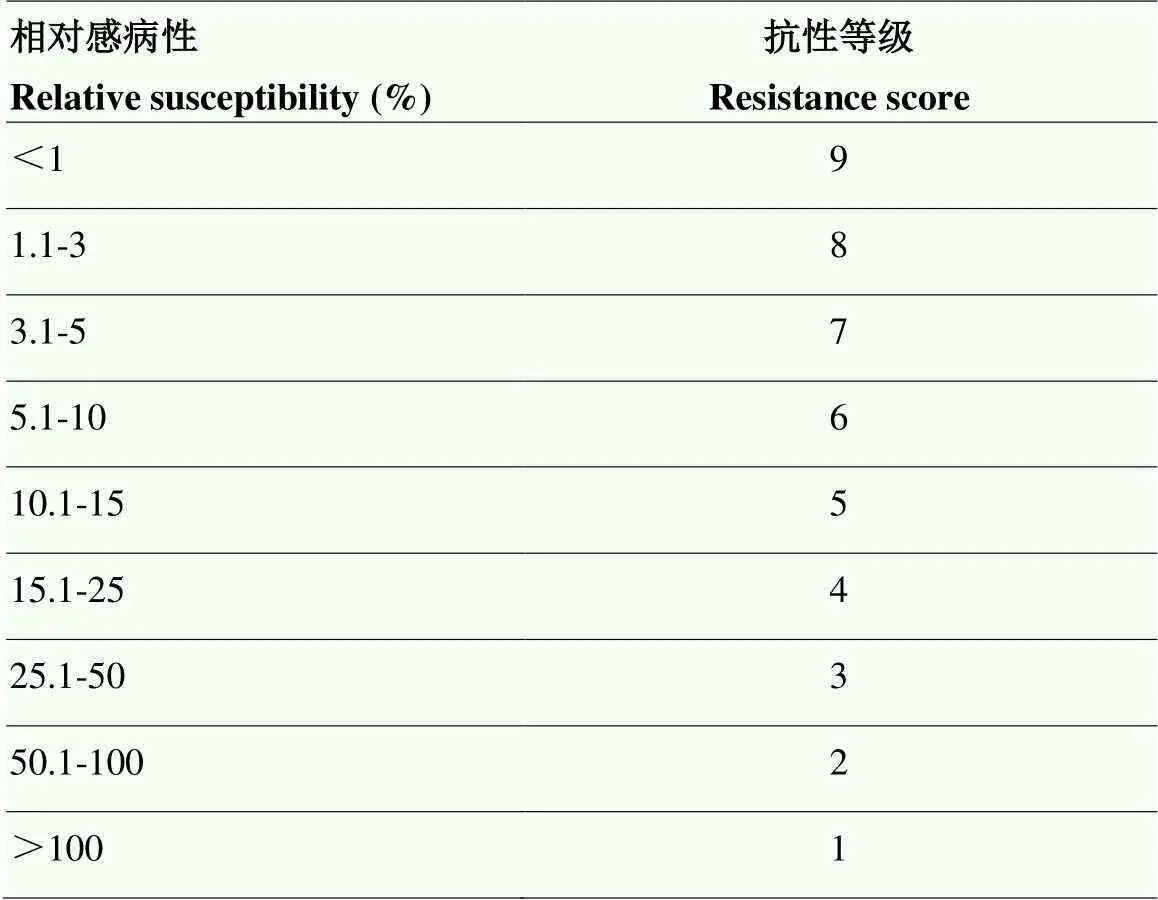
表1 EPPO马铃薯品种对马铃薯金线虫抗性等级划分标准
抗性等级分为1—9,其中抗性等级为9代表最高抗性,马铃薯金线虫基本不能侵染该品种或侵染后不能完成整个生活史
Resistance scores range from 1 to 9, where 9 represents the highest resistance level andis basically unable to infest the cultivar or cannot complete its entire life cycle after infestation
1.3 田间自然小区抗性鉴定
1.3.1 试验地点和田间管理 试验于2021和2022连续两年在云南省昭通市昭阳区西魁坪子马铃薯种植基地进行(E103°41′47′′,N27°35′45′′,海拔2 270 m)。昭阳区西魁坪子地处云南省东北部乌蒙山区腹地,地势西高东低。海拔1 700 m以上区域为马铃薯主产区,属高原大陆季风性气候,干湿两季分明,冬季气温较低,夏季气候凉爽。年平均气温12.1 ℃,年降水量826 mm,年日照时数1 719.4 h,全年无霜期220 d左右,土壤类型为山地黄壤[29-30]。该试验基地冬春干旱,夏秋多雨,常年连作马铃薯,试验前经调查马铃薯金线虫已侵染定殖[6]。
试验采用随机区组排列,共设15个处理(品种),小区长5.5 m,宽2.4 m,面积13.2 m2,小区间隔0.5 m,每处理重复3次,共45个小区。每小区起两垄,垄高20—30 cm,采用双行栽培模式。将N-P2O5-K2O比例为16﹕6﹕26的硫酸钾型复合肥与精制有机肥按1﹕2充分混合后,每穴施150 g,覆土盖膜。马铃薯于每年3月中旬种植,栽培管理按当地大田生产常规措施进行,田间无其他病虫害发生。在马铃薯现蕾至始花期,测量株高。每年10月中旬收获并测产。
1.3.2 田间抗性测定 在马铃薯播种前,每小区利用网格土壤采样法[31]采集亚样品20个,取样深度为10—20 cm,充分混合后每小区留2 kg土壤作为一个样品带回实验室进行孢囊数测定。从每个小区样品中取100 mL土样,经筛淘法分离样品中的孢囊,在显微镜下观察并统计播种前每个小区线虫孢囊基数(Pi)。在一个生长季节结束,马铃薯收获后,用同样的方法从每小区取土壤样品带回室内测定单位土壤内的最终孢囊数(Pf)。计算马铃薯金线虫的繁殖系数,繁殖系数=成熟期孢囊数Pf/播种前土壤孢囊数Pi。孢囊繁殖系数(Pf/Pi)<1,则该品种为抗病品种,反之则为感病品种。
1.4 抗马铃薯金线虫H1基因鉴定
马铃薯出苗后2周取顶部嫩叶于液氮速冻,使用CTAB法提取植物叶片DNA[32]。基因组DNA用Nanodrop 2000分光光度计(Thermo Fisher Scientific Inc.,Wlimington,DE)测定DNA浓度及纯度,并用灭菌水将DNA稀释至100 ng·mL-1左右,样品保存于-80 ℃冰箱。采用57R[17]和TG689[33]两个分子标记鉴定抗马铃薯金线虫Ro1致病型的,分子标记BCH[22]扩增-胡萝卜素羟化酶基因作为对照。对于57R分子标记,抗马铃薯金线虫品种扩增得到450 bp的条带,感病品种扩增出1 500 bp的条带,而前人研究认为同时出现1 500和450 bp条带的马铃薯品种也同样抗马铃薯金线虫,因此也认定其含有[22]。TG689分子标记则相对特异,抗性品种扩增出141 bp大小的条带,而感病品种无条带。分子标记扩增引物序列如表2,以上所有引物均由上海生工生物工程股份有限公司合成。PCR反应体系25 μL:12.5 μL 2×Rapid Taq Master Mix(南京诺唯赞生物科技股份有限公司),0.5 μL 10 μmol·L-1正/反引物,1 μL DNA模板,灭菌水补足至25 μL。PCR程序:94 ℃预变性3 min;94 ℃变性15 s,55 ℃退火15 s,72 ℃延伸15 s,30个循环;72 ℃延伸10 min,4 ℃保存。取10 μL扩增产物经1.2%琼脂糖凝胶电泳分离,全自动凝胶成像分析系统(北京森西赛智科技有限公司)下观察并记录结果。
1.5 数据分析
应用Microsoft Excel和IBM SPSS Statistics 22数据处理软件进行统计分析,采用Duncan新复极差法对不同品种间产量进行多重比较。
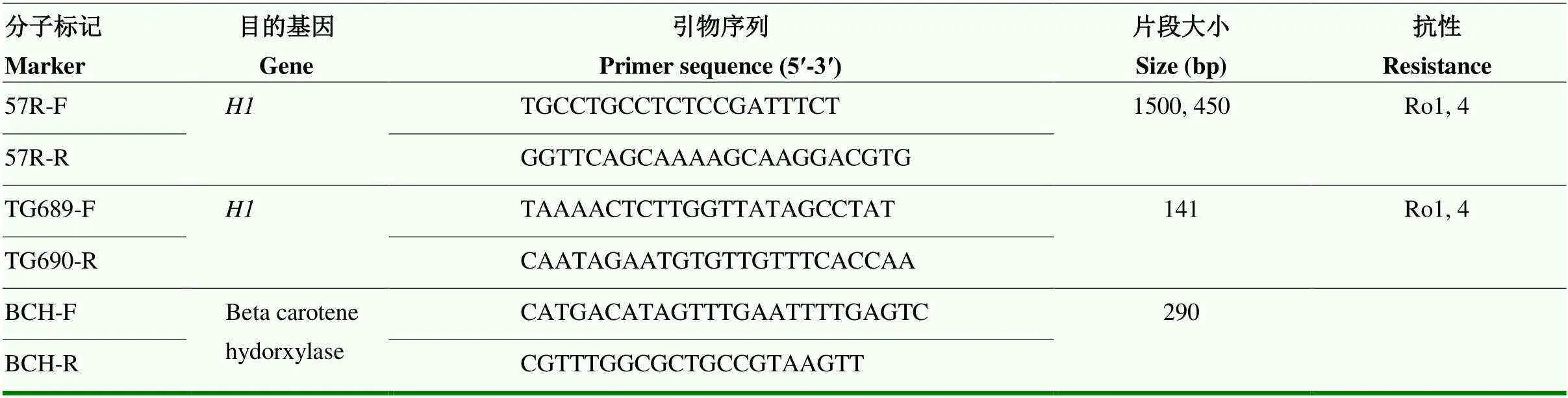
表2 抗马铃薯金线虫H1基因分子标记鉴定
2 结果
2.1 马铃薯抗马铃薯金线虫室内接种鉴定
对15个西南混作区马铃薯主栽品种进行盆栽接种试验,以会薯16号作为感病对照。结果表明,云薯505、宣薯5号、会薯15号、会薯19号和云薯304共5个品种为高抗品种,抗性等级为9,马铃薯金线虫基本不能在这些品种上繁殖。丽薯6号和宣薯6号为中感品种,抗性等级为4。而抗性等级为1—3的7个品种均为高感品种(表3)。
感病对照会薯16号的最终单株孢囊数(Pf)为(223±36)个孢囊,平均繁殖系数(Pf/Pi)为17.15,表明马铃薯金线虫在该品种上大量繁殖。感病品种中,会-2、宣薯8号和丽薯15号的Pf大于对照,Pf/Pi分别为23.84、20.69和18.85。中感品种丽薯6号和宣薯6号Pf小于感病对照品种,Pf/Pi分别为3.31和4.08。而5个高抗品种的最终群体数量Pf仅为0—2个孢囊,Pf/Pi为0—0.15。
2.2 抗马铃薯金线虫H1的分子标记检测
采用相关分子标记57R和TG689鉴定室内接种试验的15个马铃薯主栽品种。以BCH扩增的-胡萝卜素羟化酶基因为对照,所有品种均出现290 bp条带,表明模板DNA无质量问题,可用于后续试验(图1)。经57R和TG689分子标记扩增共计5个品种出现450和141 bp大小条带,即云薯505、宣薯5号、会薯15号、云薯304和宣薯6号(表3)。
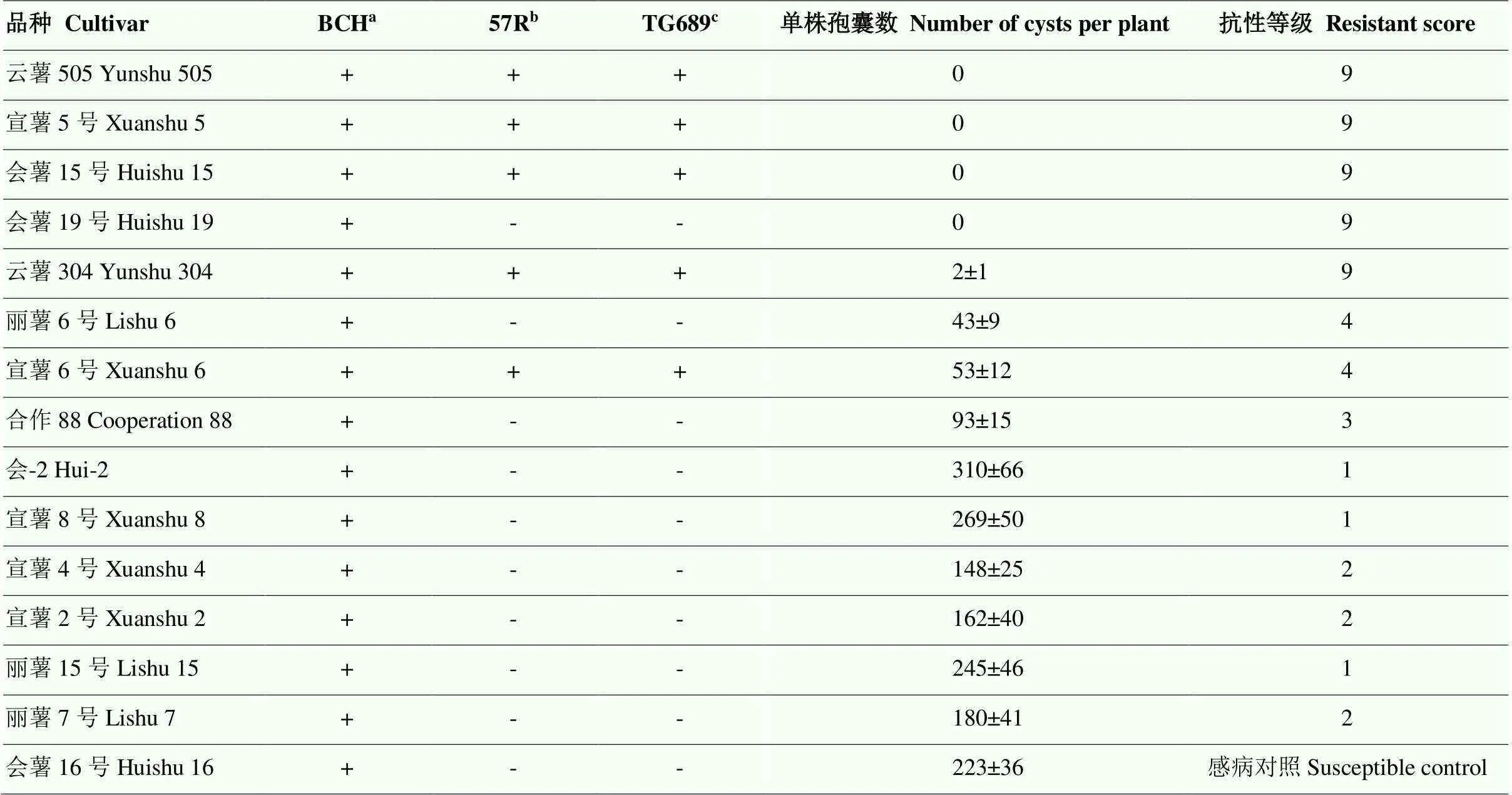
表3 马铃薯品种对马铃薯金线虫抗性室内鉴定评价及H1基因分子标记检测
a:BCH为阳性对照BCH marker as positive controls;b:57R分子标记,“+”与“-”表示经检测出现或未出现450 bp DNA片段57R marker, “+” and “-” indicate the presence and absence of 450 bp PCR products DNA fragments, respectively;c:TG689分子标记,“+”与“-”表示经检测出现或未出现141 bp DNA片段TG689 marker, “+” and “-” indicate presence and absence of 141 bp PCR products DNA fragments, respectively
两个基因鉴定分子标记结果一致,西南混作区15个马铃薯主栽品种中5个马铃薯品种,即云薯505、宣薯5号、会薯15号、云薯304和宣薯6号含抗马铃薯金线虫Ro1和Ro4型的。
2.3 抗/感马铃薯品种田间抗性鉴定
马铃薯金线虫田间平均繁殖系数(Pf/Pi)<1.00的品种共有7个,表现为抗病。5个抗性等级为9的高抗品种(云薯505、宣薯5号、会薯15号、会薯19号、云薯304)马铃薯金线虫Pf/Pi值最低为0.04—0.14;抗性等级为4的中感品种丽薯6号和宣薯6号的Pf/Pi值为0.43—0.65;8个高感品种Pf/Pi在1.18—3.24(图2-c—f)。所有高感品种的Pf/Pi值在2021年(1.18—2.75)和2022年(1.76—3.24)均>1.00,且均大于抗病品种,表明感病品种种植后田间线虫种群数量增加。相比之下,高抗品种的Pf/Pi值在2021年(0.04—0.12)和2022年(0.05—0.14)均<1.00,表明这些抗病品种种植后马铃薯金线虫田间种群密度有所降低(表4)。

1:云薯505 Yunshu 505;2:宣薯5号Xuanshu 5;3:会薯15号Huishu 15;4:会薯19号Huishu 19;5:云薯304 Yunshu 304;6:丽薯6号Lishu 6;7:宣薯6号Xuanshu 6;8:合作88 Cooperation 88;9:会-2 Hui-2;10:宣薯8号Xuanshu 8;11:宣薯4号Xuanshu 4;12:宣薯2号Xuanshu 2;13:丽薯15号Lishu 15;14:丽薯7号Lishu 7;15:会薯16号Huishu 16

a、b:马铃薯品种田间抗性鉴定Identification of resistance of potato cultivars in the field,a:高抗品种云薯505 the highly resistant cultivar Yunshu 505;b:高感品种宣薯2号The highly susceptible cultivar Xuanshu 2;c:会薯16号受马铃薯金线虫侵染的地上部症状Above-ground symptoms of Huishu 16 infested with G. rostochiensis;d—f:会薯16号根表的马铃薯金线虫雌虫、孢囊及2龄幼虫Females, cysts, and 2nd stage juveniles of G. rostochiensis on the roots of Huishu 16

表4 15份马铃薯主栽品种的田间抗性
2.4 抗/感马铃薯田间农艺性状比较
整体上,5个高抗品种株高的均值在两年间均显著高于8个高感品种的株高均值,且高抗品种产量的均值在两年间也均显著高于8个高感品种的产量均值(<0.05)。宣薯5号、会薯15号和会薯19号产量相对较高,显著高于其他马铃薯品种;会-2产量最低,显著低于抗病品种,且低于或显著低于其他感病品种。会薯16号、丽薯7号、宣薯8号和丽薯15号产量相对较低,与产量最低的会-2无显著差异,但显著低于其他马铃薯品种。此外,合作88和宣薯2号与云薯304和丽薯6号产量无显著差异(表5)。
3 讨论
3.1 马铃薯对马铃薯金线虫的抗性评价
马铃薯西南混作区自2013年产量超越北方一作区后,成为我国最主要的马铃薯生产区域[34]。而马铃薯金线虫在该区的发生危害严重限制了我国马铃薯的高产稳产和贸易交流。目前,种植抗病品种仍是防控和遏制该线虫进一步发展扩散最为经济有效的方法。因此,本研究采用室内接种鉴定对西南混作区马铃薯主栽品种进行了抗性等级评价,并将分子标记鉴定作为辅助手段,高效、可靠地筛选出5份高抗马铃薯金线虫品种。抗性等级为9的高抗品种上马铃薯金线虫田间繁殖系数极低,均<0.15,表明马铃薯金线虫基本不能侵染或者不能在这些品种上完成生活史。而对于抗性等级≤3的高感品种,马铃薯金线虫田间繁殖系数则均>1,甚至在品种宣薯2号和宣薯8号上经一个生长季节后马铃薯金线虫种群增长2—3倍,表明连续种植感病品种可使田间马铃薯金线虫种群密度不断扩大,虫源基数逐年上升,病害发展逐年加重。马铃薯高抗品种的室内盆栽接种和田间抗性鉴定的繁殖系数结果高度一致。高感品种的繁殖系数在盆栽和田间鉴定中均>1,但盆栽中的繁殖系数高于田间;两个中感品种在盆栽接种中Pf/Pi>1而田间鉴定中Pf/Pi<1,但其抗性水平在两个试验中均介于高感和高抗品种之间,繁殖系数不一致的情况可能与不同的鉴定环境有关,如田间的线虫初始群体数量差异可能会影响繁殖率。
由于对马铃薯金线虫Ro1型展现出优异抗性,在马铃薯抗病育种中得到广泛应用[17,35]。含有的抗病品种可能同感病品种一样会诱导马铃薯金线虫的孵化。然而在线虫侵入根系后,抗病寄主中线虫的取食位点周围的细胞会触发过敏反应,使得合胞体(孢囊线虫诱导寄主根部形成的取食细胞)在诱导形成的一周内发生退化,最终阻断马铃薯金线虫2龄幼虫的营养摄取而达到抗病且减少田间线虫群体基数的目的[36]。本研究表明抗马铃薯金线虫Ro1致病型的对我国马铃薯金线虫群体具有高水平抗性。利用室内抗性鉴定和分子标记能够有效对马铃薯抗性进行鉴别。室内鉴定得到的5个高抗品种中均含抗性。中感品种宣薯6号虽然检测含,但是室内鉴定和田间试验均表明其抗性水平不及高抗品种。Biryukova等[37]和Faggian等[38]认为马铃薯对金线虫抗性符合数量性状遗传特征,由少数主效基因和多个微效基因共同控制,品种在培育过程中微效基因控制的抗性在基因传递时可能发生重组,这可能是宣薯6号抗性水平发生改变的原因。此外,除外,抗金线虫Ro1致病型还有、和等抗性基因[18,33,39-40],高抗品种会薯19号未检测含有,表明其可能存在其他新型抗性基因发挥抗性作用。此次试验金线虫群体均来自云南省昭通市昭阳区西魁坪子种薯基地,还需要进一步根据马铃薯金线虫的发生分布,有针对性地扩大对当地主栽马铃薯品种抗性程度的鉴定和评价。

表5 15份马铃薯主栽品种的农艺性状
同列数据后不同小写字母表示处理间差异显著(<0.05)
Values followed by different lowercase letters in the same column indicate significantly different between the cultivars at the 0.05 level
3.2 马铃薯抗/感品种对金线虫群体的影响
金线虫在马铃薯上的繁殖率很大程度上取决于初始种群密度[41-42]。当金线虫群体密度<1粒卵/g土时,群体便可增殖高达70倍,而当线虫群体>100粒卵/g土时,由于根系损伤和2龄幼虫之间的竞争增加,增殖率反而受到抑制[23,41,43]。本试验同样发现马铃薯金线虫在合作88和宣薯8号等感病品种上的繁殖系数在相对较低的初始群体密度下的增殖和繁殖系数相对较高。
国外研究认为金线虫的经济阈值为20粒卵/g土,而该数值会受到土壤类型、肥力及产量水平等因素影响[43]。在英国,金线虫的经济阈值约为15粒卵/g土,若不进行有效防控,最高可造成80%的产量损失[44]。在新西兰,金线虫群体密度达到5—10粒卵/g土时田间才表现明显症状,当达到15—20粒卵/g土,对感病品种造成严重危害,最高可造成85%—90%的产量损失[45]。在云南和四川马铃薯金线虫群体种群密度为47—69粒卵/g土[6],除与品种特性相关的重要农艺性状如株高等表征非常明显外,在马铃薯金线虫危害严重田块,感病品种产量大多极显著低于高抗品种产量。
研究表明,种植含抗性基因的马铃薯品种能够使金线虫Ro1致病型种群密度减少80%—90%[40,46-47]。虽然目前尚不明确我国马铃薯金线虫的致病型类别,但本研究表明含的抗性马铃薯品种能够降低我国马铃薯金线虫田间群体密度。英国、新西兰、美国、加拿大和塞尔维亚开展的长期试验的结果表明2—3年轮作或连作种植抗性基因马铃薯品种能够将金线虫种群降至极低甚至难以检测的水平[45-46,48]。但长期单一大面积种植含抗性基因品种也会对田间马铃薯金线虫群体形成较高的选择压力,使得金线虫群体向其他致病型发展,导致抗性品种的抗性丧失[47]。面对马铃薯金线虫入侵我国的严峻形势,未来应将抗马铃薯金线虫纳入马铃薯抗性育种目标,合理布局抗病品种并结合轮作等措施对金线虫开展可持续综合防控。
4 结论
结合室内盆栽接种和分子标记鉴定了我国马铃薯西南混作区7个主栽抗病品种并结合田间抗/感病品种对马铃薯金线虫群体的影响及其农艺性状表现,筛选出宣薯5号、会薯15号和会薯19号为高产、抗病的良好品种。抗马铃薯金线虫Ro1致病型的对我国马铃薯金线虫群体具有高水平抗性且能够减少田间马铃薯金线虫群体密度。而受马铃薯金线虫侵染田间种植的感病品种产量大多显著低于高抗品种,且感病品种种植后会导致线虫种群基数增大病害加重。研究结果可为马铃薯金线虫抗病育种综合评价提供参考,并为指导马铃薯金线虫综合防控、抗病品种合理布局和品种示范推广提供依据。
[1] 彭焕, 刘慧, 江如, 葛建军, 赵守歧, 冯晓东, 黄文坤, 彭德良. 警惕检疫性有害生物马铃薯孢囊线虫(和)入侵我国. 植物保护, 2020, 46(6): 1-9.
PENG H, LIU H, JIANG R, GE J J, ZHAO S Q, FENG X D, HUANG W K, PENG D L. Potential invasion of the potato cyst nematodeandinto China. Plant Protection, 2020, 46(6): 1-9. (in Chinese)
[2] 彭德良, 李建中, 黄文坤, 贺文婷. 第五十五章马铃薯金线虫适生性风险评估与控制预案//万方浩, 彭德良, 王瑞. 生物入侵: 预警篇. 北京: 科学出版社, 2010: 613-624.
Peng D L, Li J Z, huang W K, He W T. Chapter 55 Potential geographic distribution and management measures of golden potato cyst nematode:(Wollenweber) Behrens in China//WAN F H, PENG D L, WANG R. Biological Invasions: Risk Analysis and Early Prevention. Beijing: Science Press, 2010: 613-624. (in Chinese)
[3] CABI. Datasheet report for(yellow potato cyst nematode). (2022-12-05) [2023-11-27]. https://www.cabidigitallibrary. org/doi/10.1079/cabicompendium.27034.
[4] PENG D, LIU H, PENG H, JIANG R, LI Y, WANG X, GE J J, ZHAO S, FENG X, FENG M. First detection of the potato cyst nematode () in a major potato production region of China. Plant Disease, 2023, 107(1): 233.
[5] JIANG R, PENG H, LI Y, LIU H, ZHAO S, LONG H, HU X, GE J, LI X, LIU M, SHAO B, PENG D. First record of the golden potato nematodein Yunnan and Sichuan provinces of China. Journal of Integrative Agriculture, 2022, 21(3): 898-899.
[6] JIANG R, LI Y, HUANG L, LIU S, LIU H, FENG X, LONG H, HU X, GE J J, BIAN Y, LI X, SHAO B, HUANG W, KONG L A, XU C, PENG D, PENG H. Association of(Nematoda) with stunted and chlorotic potato plants in Yunnan and Sichuan provinces in China. Plant Disease, 2023, 107(4): 1027-1034.
[7] 邓春菊, 李艳, 杨毅娟, 杨艳梅, 陈敏, 李永青, 胡先奇. 云南省马铃薯孢囊线虫种类鉴定. 云南农业大学学报(自然科学), 2023, 38(3): 400-408.
DENG C J, LI Y, YANG Y J, YANG Y M, CHEN M, LI Y Q, HU X Q. Identification of potato cyst nematodes () on potato in Yunnan province. Journal of Yunnan Agricultural University (Natural Science), 2023, 38(3): 400-408. (in Chinese)
[8] JATALA P, BRIDGE J. Plant parasitic nematodes in subtropical and tropical agriculture. Wallingford, UK: CAB International, 1990: 137-180.
[9] 葛建军. 中国进境植物检疫性有害生物——线虫卷. 北京: 中国农业出版社, 2018: 21-25.
Ge J J. Imported plant quarantine pests in China——nematode Volume. Beijing: China Agriculture Press, 2018: 21-25. (in Chinese)
[10] EPPO.(HETDRO). (2023-03-17) [2023-11-27]. https://gd.eppo.int/taxon/HETDRO/distribution.
[11] PERRY R N, CURTIS R H C. Plant Nematology. Wallingford, UK: CAB International, 2013: 246-273.
[12] PICKUP J, ROBERTS A M I, DEN NIJS L J M F. Cyst nematode. Oxfordshire, UK: CAB International, 2018: 128-151.
[13] KORT J, ROSS H, RUMPENHORST H J, STONE A R. An international scheme for identifying and classifying pathotypes of potato cyst-nematodesand. Nematologica, 1977, 23(3): 333-339.
[14] GALEK R, RUREK M, DE JONG W S, PIETKIEWICZ G, AUGUSTYNIAK H, SAWICKA-SIENKIEWICZ E. Application of DNA markers linked to the potatogene conferring resistance to pathotype Ro1 of. Journal of Applied Genetics, 2011, 52(4): 407-411.
[15] PINEDA O, BONIERBALE M W, PLAISTED R L, BRODIE B B, TANKSLEY S D. Identification of RFLP markers linked to thegene conferring resistance to the potato cyst nematode. Genome, 1993, 36(1): 152-156.
[16] GEBHARDT C, MUGNIERY D, RITTER E, SALAMINI F, BONNEL E. Identification of RFLP markers closely linked to thegene conferring resistance toin potato. Theoretical and Applied Genetics, 1993, 85(5): 541-544.
[17] FINKERS-TOMCZAK A, BAKKER E, DE BOER J, VAN DER VOSSEN E, ACHENBACH U, GOLAS T, SURYANINGRAT S, SMANT G, BAKKER J, GOVERSE A. Comparative sequence analysis of the potato cyst nematode resistance locusreveals a major lack of co-linearity between three haplotypes in potato (ssp.). Theoretical and Applied Genetics, 2011, 122(3): 595-608.
[18] PAAL J, HENSELEWSKI H, MUTH J, MEKSEM K, MENENDEZ C M, SALAMINI F, BALLVORA A, GEBHARDT C. Molecular cloning of the potatogene conferring resistance to pathotype Ro1 of the root cyst nematode, based on a candidate gene approach. The Plant Journal, 2004, 38(2): 285-297.
[19] SCHULTZ L, COGAN N O I, MCLEAN K, DALE F B, BRYAN G J, FORSTER J W, SLATER A T. Evaluation and implementation of a potential diagnostic molecular marker for-conferred potato cyst nematode resistance in potato (L.). Plant Breeding, 2012, 131(2): 315-321.
[20] SHOCK C C, BROWN C R, SATHUVALLI V, CHARLTON B A, YILMA S, HANE D C, QUICK R, RYKBOST K A, JAMES S R, MOSLEY A R,. TerraRossa: A mid-season specialty potato with red flesh and skin and resistance to common scab and golden cyst nematode. American Journal of Potato Research, 2018, 95(5): 597-605.
[21] ASANO K, KOBAYASHI A, TSUDA S, NISHINAKA M, TAMIYA S. DNA marker-assisted evaluation of potato genotypes for potential resistance to potato cyst nematode pathotypes not yet invading into Japan. Breeding Science, 2012, 62(2): 142-150.
[22] PARK J, YANG H, DE JONG W S, WANG X. An evaluation of two-linked markers and their suitability for selectingresistant potatoes in the New York breeding program. American Journal of Potato Research, 2018, 95(2): 170-177.
[23] DE BOER R F, WAINER J, NORNG S, BEARDSELL D V, CRUMP N S, WASHINGTON W S, YEN A. Influence of susceptible and resistant potato cultivars on the population of the potato cyst nematodeRo1 and on potato yields in a highly infested field in Australia. Annals of Applied Biology, 2022, 181(2): 215-224.
[24] 明会, 蒋伟, 刘太红, 曾蕊, 施运迪, 卢丽丽, 马永艳, 李先平, 于德才. 利用分子标记筛选马铃薯抗孢囊线虫资源. 植物遗传资源学报, 2023, 24(4): 1194-1204.
MING H, JIANG W, LIU T H, ZENG R, SHI Y D, LU L L, MA Y Y, LI X P, YU D C. Molecular markers assisted identification of potato resources resistant to cyst nematode resources. Journal of Plant Genetic Resources, 2023, 24(4): 1194-1204. (in Chinese)
[25] 甄浩洋, 彭焕, 孔令安, 洪豹元, 朱桂兰, 汪锐辉, 彭德良, 文艳华. 中国孢囊线虫新记录种——野生豆孢囊线虫记述及其对豆科植物的寄生性测定. 中国农业科学, 2018, 51(15): 2913-2924.doi: 10.3864/j.issn.0578-1752.2018.15.007.
Zhen H Y, PENG H, KONG L A, HONG B Y, ZHU G L, WANG R H, PENG D L, WEN Y H., a new cyst nematode record in China and its parasitism to legume crops. Scientia Agricultura Sinica, 2018, 51(15): 2913-2924.doi: 10.3864/j.issn. 0578-1752.2018.15.007. (in Chinese)
[26] 彭德良, SUBBOTIN S, MOENS M. 小麦禾谷胞囊线虫()的核糖体基因(rDNA)限制性片段长度多态性研究. 植物病理学报, 2003, 33(4): 323-329.
PENG D L, SUBBOTIN S, MOENS M. rDNA restriction fragment length polymorphism ofin China. Acta Phytopathologica Sinica, 2003, 33(4): 323-329. (in Chinese)
[27] EPPO. PM 7/40 (5)and. EPPO Bulletin, 2022, 52(2): 286-313.
[28] EPPO. PM3/68 (1) Testing of potato varieties to assess resistance toand. EPPO Bulletin, 2006, 36(3): 419-420.
[29] 马惠, 黄平. 昭通市昭阳区靖安镇净作马铃薯“2+X”氮肥总量控制试验. 现代农业科技, 2018(15): 79-80.
MA H, HUANG P. A trial of “2+X” total nitrogen fertilizer control for net-crop potato in Jing’an Town, Zhaoyang District, Zhaotong City. Modern Agricultural Science and Technology, 2018(15): 79-80. (in Chinese)
[30] 王开金, 王进. 昭通市昭阳区马铃薯产业发展现状及建议. 现代农业科技, 2019(11): 90, 93.
WANG K J, WANG J. Current situation and suggestions of the potato industry in Zhaoyang District, Zhaotong City. Modern Agricultural Science and Technology, 2019(11): 90, 93. (in Chinese)
[31] 左佳, 张泽, 陈剑, 路亮霞, 吕新. 基于不同采样方式棉田养分空间变异特征分析. 新疆农业科学, 2014, 51(11): 1970-1975.
ZUO J, ZHANG Z, CHEN J, LU L X, Lü X. Analysis of the characteristics of nutrient spatial variability in cotton fields based on different sampling methods. Xinjiang Agricultural Sciences, 2014, 51(11): 1970-1975. (in Chinese)
[32] DOYLE J J, DOYLE J L. A rapid DNA isolation procedure from small quantities of fresh leaf tissue. Phytochemical Bulletin, 1987, 19(1): 11-15.
[33] MILCZAREK D, FLIS B, PRZETAKIEWICZ A. Suitability of molecular markers for selection of potatoes resistant tospp. American Journal of Potato Research, 2011, 88(3): 245-255.
[34] 关佳晨, 蔡海龙. 我国马铃薯生产格局变化特征及原因分析. 中国农业资源与区划, 2019, 40(3): 92-100.
GUAN J C, CAI H L. Analysis on the changes and reasons of potato production pattern in China. Chinese Journal of Agricultural Resources and Regional Planning, 2019, 40(3): 92-100. (in Chinese)
[35] RICE S L, LEADBEATER B S C, STONE A R. Changes in cell structure in roots of resistant potatoes parasitized by potato cyst-nematodes. I. Potatoes with resistance genederived fromssp.. Physiological Plant Pathology, 1985, 27(2): 219-234.
[36] PRICE J A, COYNE D, BLOK V C, JONES J T. Potato cyst nematodesand. Molecular Plant Pathology, 2021, 22(5): 495-507.
[37] BIRYUKOVA V A, ZHURAVLEV A A, ABROSIMOVA S B, KOSTINA L I, KHROMOVA L M, SHMYGLYA I V, MOROZOVA N N, KIRSANOVA S N. Use of molecular markers of potato golden nematode resistance genesand. Russian Agricultural Sciences, 2008, 34(6): 365-368.
[38] FAGGIAN R, POWELL A, SLATER A T. Screening for resistance to potato cyst nematode in Australian potato cultivars and alternative solanaceous hosts. Australasian Plant Pathology, 2012, 41(5): 453-461.
[39] KREIKE C M, KOK-WESTENENG A A, VINKE J H, STIEKEMA W J. Mapping of QTLs involved in nematode resistance, tuber yield and root development insp. Theoretical and Applied Genetics, 1996, 92(3/4): 463-470.
[40] JACOBS J M E, VAN ECK H J, HORSMAN K, ARENS P F P, VERKERK-BAKKER B, JACOBSEN E, PEREIRA A, STIEKEMA W J. Mapping of resistance to the potato cyst nematodefrom the wild potato species. Molecular Breeding, 1996, 2(1): 51-60.
[41] BRODIE B B. Effect of initial nematode density on managingwith resistant cultivars and nonhosts. Journal of Nematology, 1996, 28(4): 510-519.
[42] LAMONDIA J A, RAWSTHORNE D, BRODIE B B. Decline ofas influenced by potato root diffusate movement and persistence in soil. Journal of Nematology, 1987, 19(2): 172-176.
[43] TURNER S J, EVANS K. The origins, global distribution and biology of potato cyst nematodes ((Woll.) andStone.)//Markes R J, Brodie B B. Potato cyst nematodes: Biology, distribution and control. Wallingford, UK: CAB International, 1998: 7-26.
[44] TRUDGILL D L, PHILLIPS M S, ALPHEY T J W. Integrated control of potato cyst nematode. Outlook on Agriculture, 1987, 16(4): 167-172.
[45] MARSHALL J W. Potato cyst nematodes (species) in New Zealand and Australia//Markes R J, Brodie B B. Potato cyst nematodes: Biology, distribution and control. Wallingford, UK: CAB International, 1998: 353-394.
[46] GRUJIĆ N, RADIVOJEVIĆ M. Population decline ofin Western Serbia. Nematology, 2017, 19(2): 185-195.
[47] WHITEHEAD A G, TURNER S J. Management and regulatory control strategies for potato cyst nematodes (and)//Markes R J, Brodie B B. Potato cyst nematodes: Biology, distribution and control. Wallingford, UK: CAB International, 1998: 135-152.
[48] LAMONDIA J A, BRODIE B B. Effects of initial nematode density on population dynamics ofon resistant and susceptible potatoes. Journal of Nematology, 1986, 18(2): 159-164.
Identification and evaluation of major potato cultivars resistance toand detection of theirresistance gene marker
HUANG LiQiang1, JIANG Ru1, ZHU BoZhi1, PENG Huan1, XU Chong2, SONG JiaXiong2, CHEN Min2, LI YongQing2, HUANG WenKun1, PENG DeLiang1
1State Key Laboratory for Biology of Plant Diseases and Insect Pests, Institute of Plant Protection, Chinese Academy of Agricultural Sciences, Beijing 100193;2Plant Protection and Quarantine Station of Zhaotong City, Yunnan province, Zhaotong 657000, Yunnan
【Objective】Potato cyst nematodes (PCN), includingand, are damaging soilborne quarantine parasitic pests on potatoes. Thehas now distributed in seven counties of Yunnan, Guizhou, and Sichuan provinces in China, and several seed potato bases are threatened by the spread of. This study aimed to identify the resistance level of major potato cultivars to, clarify the presence of a knownresistance gene, and to provide a reference for screening and promoting resistant cultivars for controlling.【Method】For bioassay, 15 major potato cultivars from the southwest mixed-cropping zone were inoculated withpopulations in an isolation greenhouse. The number of cysts per plant was counted and relative susceptibility was calculated, and finally the resistance of the cultivars was ranked according to a standard scoring notation. Forresistance gene identification, two molecular markers 57R and TG689, linked to thefor resistance toRo1 pathotype, were used to identify 15 cultivars of the bioassay, with the BCH marker for amplification of the beta carotene hydroxylase gene as a control. For the field trial, a comparison of resistant and susceptible potato cultivars was conducted in a naturally infested field in 2020 and 2021 in Zhaotong, Yunnan Province. To estimate the initial (Pi) and final (Pf) populations of, soil sample was taken before planting and after harvested, and the reproduction factor (Pf/Pi) was calculated. The height of above-ground part of the plant at budding and initial flowering stages and the total yields at harvesting stage were measured.【Result】Among the 15 major potato cultivars, five cultivars (Yunshu 505, Xuanshu 5, Huishu 15, Huishu 19, and Yunshu 304) are highly resistant. It’s hard forto reproduce on these cultivars. Two cultivars (Lishu 6 and Xuanshu 6) are moderately susceptible. Eight cultivars are highly susceptible, especially the Pf/Pi of Hui-2, Lishu 15 and Xuanshu 8 was higher than that of the susceptible control Huishu 16 (Pf/Pi=17.15). Additionally, the results of the twogene-linked molecular markers were generally consistent, five cultivars (Yunshu 505, Xuanshu 5, Huishu 15, Yunshu 304, and Xuanshu 6) contain the.reproduction factor differed significantly on resistant and susceptible cultivars in the field. The average Pf/Pi values of highly resistant cultivars (with resistance score 9) were <1 in 2021 (0.04-0.12) and 2022 (0.05-0.14), indicating that nematode population densities decreased after planting of highly resistant cultivars. On the contrary, the average Pf/Pi values of the highly susceptible cultivars were >1.00 in 2021 (1.18-2.75) and 2022 (1.76-3.24), indicating an increase in nematode populations in the field after planting of highly susceptible cultivars. There were significant differences between cultivars in plant height and yield (<0.05). The mean height of the five highly resistant cultivars was significantly higher than that of the eight highly susceptiblecultivars in the two years. The cultivars Xuanshu 5, Huishu 15 and Huishu 19 had the highest yields of 51.67-56.48 and 33.28-40.57 t·hm-2in two years, while Hui-2 had the lowest yields.【Conclusion】The resistant cultivars in the southwest mixed-cropping zone show excellent resistance to, mainly carrying the, and can reducepopulation densities in the field. High yields are produced by the resistant cultivars Xuanshu 5, Huishu 15, and Huishu 19, while Yunshu 304 is utilized as a processing potato for zinc-rich crisps. More focused identification of resistance levels of local cultivars based onincidence is urgently required.
; potato resistant cultivar;resistant gene; molecular marker detection

10.3864/j.issn.0578-1752.2024.08.007
2023-11-27;
2024-01-04
国家重点研发计划(2023YFD1400400)、国家自然科学基金(32072398)、云南省彭德良专家工作站(2023-126)、昭通市科学技术局彭德良专家工作站(2021 ZTYX03)、政府购买服务项目(15190025)、中国农业科学院科技创新工程(ASTIP-02-IPP-15)
黄立强,E-mail:hlq292573628@163.com。江如,E-mail:jiangruby@126.com。黄立强和江如为同等贡献作者。通信作者彭德良,E-mail:pengdeliang@caas.cn
(责任编辑 岳梅)
