lincRNA Cox2通过miR-129-5p/AMPK调控BCG感染的巨噬细胞糖酵解进程
2024-04-24徐蕾于嘉霖刘莉邓光存吴晓玲
徐蕾,于嘉霖,刘莉,邓光存,吴晓玲
lincRNA Cox2通过miR-129-5p/AMPK调控BCG感染的巨噬细胞糖酵解进程
徐蕾,于嘉霖,刘莉,邓光存,吴晓玲
宁夏大学生命科学学院/西部特色生物资源保护与利用教育部重点实验室,银川 750021
【目的】探究lincRNA Cox2对BCG(Calmette-Guérin)感染的RAW264.7巨噬细胞糖酵解进程的调控作用,阐明Mtb与巨噬细胞之间的相互作用,为结核病的诊断和治疗提供新的靶点。【方法】利用小干扰RNA敲减lincRNA Cox2的表达,以及使用miR-129-5p mimics过表达载体,结合BCG感染,通过实时荧光定量PCR检测lincRNA Cox2、miR-129-5p和促炎因子IL-1β、TNF-α、IL-6的表达量;乳酸含量检测试剂盒检测乳酸(LD)的分泌情况;平板涂布法检测巨噬细胞菌载量情况;双荧光素酶报告基因系统验证lincRNA Cox2与miR-129-5p以及miR-129-5p与AMPK的互作关系;蛋白免疫印迹检测AMPK(AMP依赖蛋白激酶)及糖酵解途径中关键基因HK1(己糖激酶1)、PKM2(丙酮酸激酶2)和LDHA(乳酸脱氢酶)的表达变化。【结果】 BCG感染12 h能够极显著上调RAW264.7巨噬细胞中lincRNA Cox2的表达(=0.000013),与BCG组相比,siRNA+BCG组中AMPK(=0.000771)、HK1(=0.00323)、PKM2(=0.000135)和LDHA(=0.002532)的表达量以及乳酸的分泌量(=0.020802)发生显著上调,而促炎因子IL-1β(=0.000451)、TNF-α(=0.000147)、IL-6(=0.0001)的表达发生显著下调,菌载量试验表明siRNA+BCG组中的巨噬细胞菌载量显著下调(=0.000127)。双荧光素酶报告基因系统表明lincRNA Cox2和miR-129-5p存在相互作用关系并以AMPK为靶基因。BCG感染RAW264.7巨噬细胞12 h后极显著下调miR-129-5p的表达(=0.000156),与BCG组相比,miR-129-5p mimics+BCG组中AMPK(=0.000262)、HK1(=0.019524)、PKM2(=0.001658)和LDHA(=0.000887)表达量以及乳酸分泌量(=0.044952)发生显著下调。【结论】 lincRNA Cox2通过海绵吸附miR-129-5p并靶向AMPK,促进BCG感染的RAW264.7巨噬细胞糖酵解进程。
lincRNA Cox2;miR-129-5p;AMPK;BCG;巨噬细胞;糖酵解进程
0 引言
【研究意义】结核病(tuberculosis,TB)是由结核分枝杆菌(,Mtb)感染引起的人畜共患呼吸道传染性疾病。根据世界卫生组织2022年全球结核病报告,2021年结核病死亡病例高达140万例[1]。其中,由于耐多药结核病、人类免疫缺陷病毒(human immunodeficiency virus,HIV)及新型冠状病毒(SARS-CoV-2)的冲击[2-3],导致结核病的发病现状不断加剧,严重威胁人类身体健康。结核分枝杆菌属于胞内寄生菌,对其感染机制及宿主抗感染机制的研究将为结核病的预防及治疗提供重要帮助。【前人研究进展】巨噬细胞是Mtb的主要宿主细胞与靶细胞,当机体感染Mtb时,巨噬细胞识别、吞噬病原体,并在胞内发生一系列复杂的相互作用[4]。在这复杂的博弈过程中,细胞代谢扮演着重要角色,其通过改变胞内能量水平,从而增强细胞在恶劣环境中的生存能力,这一过程被称为代谢重编程[5]。其中,最为常见的是糖酵解重编程,指巨噬细胞受到细菌感染时,葡萄糖被一系列酶,如己糖激酶(HK1)、丙酮酸激酶(PKM2)和乳酸脱氢酶(LDHA)等催化分解为乳酸并产能的过程[6]。有研究表明,巨噬细胞糖酵解重编程已成为宿主对Mtb感染的早期免疫反应的关键[7]。在使用糖酵解抑制剂2-DG处理Mtb感染后的巨噬细胞时,发现Mtb的存活率显著上调,这表明糖酵解途径可以抑制巨噬细胞中Mtb的生长[8]。但随着感染的持续发展,Mtb也通过多种途径拮抗糖酵解途径。研究发现,Mtb不仅可以上调miR-21促进IL-4的产生,并且能够抑制糖酵解限速酶—磷酸果糖激酶的产生,以降低糖酵解的进程,从而确保菌体的存活和复制[9]。miRNA对病原菌感染的巨噬细胞生物学功能的调控具有重要作用,但miRNA功能的行使与长链非编码RNA(long noncoding RNA,LncRNA)密不可分,因此探究LncRNA与miRNA的相互作用从而调控糖酵解进程具有重要意义。LncRNA是一类长度超过200个核苷酸且缺乏蛋白质编码能力的转录本,该RNA能够重新编程基因表达并影响不同的细胞功能[10],且其表达水平与结核分枝杆菌的感染机制及细胞命运的调控密切相关[11]。研究表明,Lnc- EST12能够抑制巨噬细胞中炎症和焦亡的活化,并且能够通过FUBP3负调节巨噬细胞抗Mtb的先天免疫[12]。在一些情况下,LncRNA还可以充当microRNA诱饵,从而对抑制靶mRNA或靶蛋白的表达有重要作用。本团队研究发现,LncRNA NR_003508能够作为正调节剂,通过海绵吸附miR-346-3p以调节RIPK1的表达,进而抑制Mtb诱导的程序性坏死[13]。lincRNA Cox2属于基因间非编码RNA,是诱导度最高的lncRNA之一,其位于蛋白质基因前列腺素-过氧化物内切酶2(Cox2/Ptgs2)下游51 kb处,主要功能与调节巨噬细胞炎症反应有关。如lincRNA Cox2在急性肺损伤期间高表达,通过降低促炎因子的表达进而调控肺泡巨噬细胞的炎症反应,最终维持肺部稳态[14]。【本研究切入点】本项目组在前期已经证明,BCG感染巨噬细胞后lincRNA Cox2会发生显著上调,但有关其如何调控Mtb诱导巨噬细胞糖酵解的研究尚未见详细报道。且生物信息学数据库预测出lincRNA Cox2与miR-129-5p存在相互结合位点。研究发现,miR-129-5p在多种癌症中表现出抗肿瘤的功能。如miR-129-5p能够通过调节ADAM9抑制细胞增殖和侵袭能力[15],以及削弱了SPN对细胞增殖、迁移、侵袭和细胞周期进程的促进作用,增强了细胞凋亡活性[16]。然而miR-129-5p在糖酵解进程中的作用并未见确切描述。在糖酵解进程中,AMP/ATP传感器AMP依赖蛋白激酶(adenosine 5′- monophosphate-activated protein kinase,AMPK)能够调控并维持细胞的代谢稳态,从而降低TCA循环产生的能量[17]。由此可见,探讨lincRNA Cox2对Mtb与巨噬细胞相互作用过程中的糖酵解重编程调控的作用,为筛选治疗与预防结核病的靶向药物及探索增强宿主抗Mtb感染免疫手段至关重要。【拟解决的关键问题】采用牛分枝杆菌疫苗株卡介苗(Calmette-Guérin,BCG)诱导RAW264.7巨噬细胞引发糖酵解重编程,通过小干扰敲减lincRNA Cox2的表达并过表达miR-129-5p,同时利用蛋白免疫印迹技术检测糖酵解关键酶的表达情况,进而明确lincRNA Cox2对BCG感染的RAW264.7巨噬细胞糖酵解的调控作用,并探讨其中的分子机制。上述研究有助于阐明Mtb与巨噬细胞之间的相互作用,并为结核病的诊断或治疗提供新的靶点。
1 材料与方法
1.1 菌株与细胞系
牛结核分枝杆菌卡介苗,购自上海生物制品研究所并保存于西部特色生物资源保护与利用教育部重点实验室(宁夏大学)。使用DifcoTMMiddlebrook 7H10培养基(BD公司)对BCG进行平板涂布并置于37 ℃培养箱中培养,于对数期挑取单菌落转接至DifcoTMMiddlebrook 7H9液体培养基(BD公司)中,37 ℃培养箱中培养,待BCG培养至合适浓度时(OD600 nm=1.5)进行传代。小鼠肺泡巨噬细胞(RAW264.7)和人肾上皮细胞(HEK293T),购自中国科学院上海生命科学研究院细胞资源中心并保存于西部特色生物资源保护与利用教育部重点实验室(宁夏大学)。使用含体积分数10%胎牛血清的DMEM(赛默飞)培养液,于37 ℃、饱和湿度、5% CO2的细胞培养箱中培养,当细胞培养密度达到90%时传代一次。以上细胞感染试验均在西部特色生物资源保护与利用教育部重点实验室的P2级实验室中进行。
1.2 构建si-lincRNA Cox2和miR-129-5p-mimics载体
根据lincRNA Cox2的mRNA全长序列,设计并合成小干扰。干扰序列如下:
si-lincRNA Cox2:5′-AAGAGUAAGAUUCUGAA GAUCUU-3′。
根据miR-129-5p的全长序列,设计并合成miR-129-5p mimics,序列如下:
miR-129-5p mimics: sense 5′-CUUUUUGCGGUC UGGGCUUGC-3′
antisense 5′-AAGCCCAGACCGCAAAAAGUU-3′
Negative control: sense 5′- UUCUCCGAACGUGU CACGUTT-3′
antisense 5′-ACG UGACACGUUCGGAGAATT-3′。
以上序列交由上海吉玛制药技术有限公司合成。
1.3 载体的转染
将生长于对数期的RAW264.7巨噬细胞接种于6孔细胞培养皿中,使每孔细胞数量为1×106,恒温培养5 h待细胞贴壁后,取转染试剂(ZETA LIFE)与载体等比例混合于200 µL EP管中,并室温静置15 min。将混合物加入细胞培养液中,混匀后放入细胞培养箱中培养24 h。
1.4 荧光定量PCR检测
1.4.1 总RNA提取及cDNA合成 总RNA提取方法按照TRIZOL法,使用TRIZOL、氯仿、异丙醇、75%乙醇和无核酶水等试剂进行提取。以提取出的RNA为模板,使用Prime Script RT Master Mix(TAKARA)说明书配制RT反应液20 µL,反应结束后将cDNA放置在-20 ℃或-80 ℃保存。
1.4.2 荧光定量PCR反应 根据Universal SYBR Green Fsat qpcr Mix(爱博泰克)说明书,配制qPCR体系20 µL,涡旋混匀后,上机进行荧光信号定量检测。qPCR反应程序:预变性95 ℃ 3 min,95 ℃ 5 s、60 ℃ 32 s循环40次。荧光定量PCR反应的具体条件详见Universal SYBR Green Fsat qPCR Mix试剂说明书。相关引物序列如表1。
1.5 乳酸含量检测
将生长于对数期的RAW264.7巨噬细胞接种于6孔细胞培养皿中,使每孔细胞数量为1×106。待细胞贴壁,并根据试验条件处理不同时间后收集细胞培养液,使用乳酸(LD)测试盒(南京建成生物工程研究所)检测乳酸,然后酶标仪中波长530 nm进行OD值读取,并根据试剂盒说明书进行含量计算。

表1 实时荧光定量PCR引物序列
1.6 平板涂布法检测巨噬细胞菌载量
将生长于对数期的RAW264.7巨噬细胞接种于6孔细胞培养皿中,使每孔细胞数量为1×106。待细胞贴壁,根据试验条件处理后收集细胞,并用0.1% TritonX-100裂解,离心收集沉淀后用PBS重悬沉淀,将重悬后的沉淀梯度稀释涂布于7H10平板上,37℃恒温培养两周后计数。
1.7 双荧光素酶报告基因检测
利用网站(https://bibiserv.cebitec.uni-bielefeld.de/)预测lincRNA Cox2和miR-129-5p、miR-129-5p和AMPK的相互作用位点,将该两个结合位点的野生型及突变型目的片段分别构建并整合进pmirGLO Vector载体中。将生长于对数期的293T细胞接种于12孔细胞培养皿中,使每孔细胞数量为3×105,将质粒载体转染入293T细胞后,使用dual-luciferase reporter assay system(Promega)试剂盒进行双荧光素酶报告基因检测。上述质粒载体交由上海吉玛制药技术有限公司设计合成。
1.8 Western blot 检测
将生长于对数期的RAW264.7巨噬细胞接种于6孔细胞培养皿中,使每孔细胞数量为1×106。待细胞贴壁,并根据实验条件处理不同时间后,使用全蛋白提取试剂盒(凯基生物)提取细胞全蛋白,使用BCA蛋白含量检测试剂盒(赛默飞)检测蛋白浓度,将蛋白调整至同一浓度后,进行SDS-PAGE凝胶电泳并转膜,随后进行Western blot,使用AMPK(CST)、HK1、PKM2、LDHA和β-actin抗体(ABclonal),检测蛋白的相对表达变化。
1.9 免疫荧光检测
将生长于对数期的RAW264.7巨噬细胞接种于铺有无菌盖玻片的12孔细胞培养皿中,使每孔细胞数量为3×105。待细胞贴壁后对细胞按照不同试验组进行处理。处理完成后将培养液吸弃,用4%多聚甲醛固定细胞25 min,0.5% TritonX-100在室温条件下通透30 min,5% BSA室温条件下封闭1 h。后在37 ℃培养箱中孵育一抗3 h(使用5% BSA以1﹕200稀释AMPK抗体),后同样条件下避光孵育二抗(使用PBS以1﹕200稀释荧光抗体)。最后将含DAPI的封片剂滴在载玻片上,将铺有细胞的盖玻片倒扣在封片剂上。待片子避光自然风干后,使用激光共聚焦显微镜观察AMPK的荧光表达并拍照。
1.10 统计学分析
所有数据均经过3次独立试验,并采用GraphPad Prism 7软件中的One Way ANOVA进行统计学分析,数据均使用平均值±标准误差(M±SEM)表示。图中标注ns代表无显著差异,*代表显著差异(<0.05),**代表差异极显著(<0.01),***代表差异极显著(<0.001)。
2 结果
2.1 BCG感染RAW264.7巨噬细胞后上调lincRNA Cox2的表达
lincRNA Cox2是巨噬细胞中重要的免疫调节因子,为探究BCG感染对RAW264.7巨噬细胞中lincRNA Cox2的影响,本研究使用荧光定量PCR检测lincRNA Cox2的表达变化。结果表明(图1),与感染0 h相比,BCG感染RAW264.7巨噬细胞后,lincRNA Cox2的表达在感染前期呈显著上调的趋势,且在感染时间为12 h(=0.000013)和18h(=0.000019)时表达量最高。当BCG持续感染RAW264.7巨噬细胞24 h后,lincRNA Cox2的表达趋于下调,但仍显著高于感染0 h(=0.00047)。由此可知,BCG感染RAW264.7巨噬细胞可诱导lincRNA Cox2的表达发生上调,并在12 h时表达量最高。
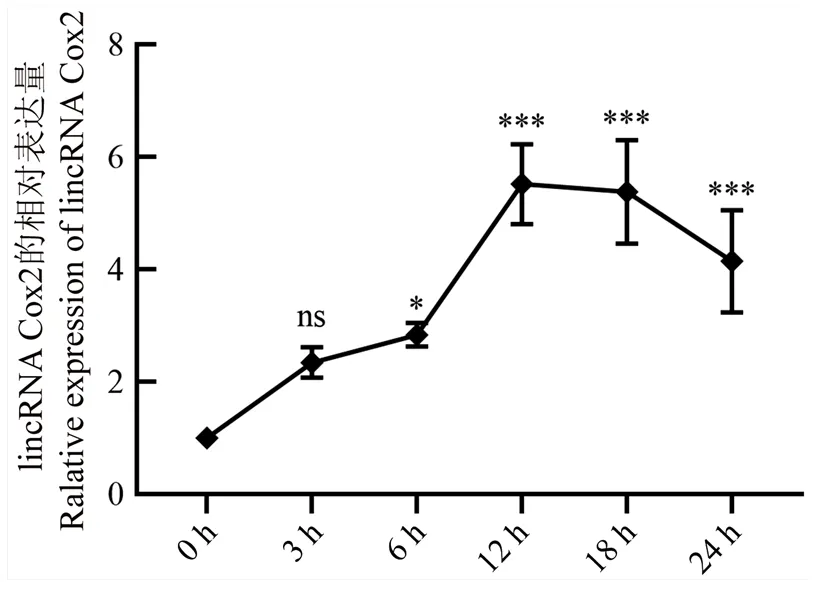
ns 无显著差异 No significant difference ; *P<0.05; ***P<0.001 下同 The same as below
2.2 BCG感染RAW264.7巨噬细胞后上调糖酵解关键酶的表达
糖酵解进程受到多种酶的调控,其中HK1作为己糖激酶中的一种亚型,可与线粒体外膜结合,通过调节GAPDH改变葡萄糖代谢[18];丙酮酸激酶PK亚型中的PKM2在免疫细胞中高表达,从而调控丙酮酸的产生[19];乳酸脱氢酶LDHA是催化糖酵解最后一步的关键酶,可催化丙酮酸转化为乳酸[20]。为探究BCG感染RAW264.7巨噬细胞后糖酵解的变化,本研究检测了不同感染时间下3种酶的表达变化。结果显示(图2),HK1(=0.0031)、PKM2(=0.0155)和LDHA(=0.0021)的表达量均在感染12 h时显著上调且达到最高;随着感染时间的延长,3种蛋白的表达量逐渐下调。因此,本研究后续实验选用12 h为最佳感染时间,从而探究lincRNA Cox2对糖酵解进程的调控作用。

图2 BCG感染RAW264.7巨噬细胞后糖酵解关键酶的表达变化
2.3 si-lincRNA Cox2后上调AMPK的表达
糖酵解受多种因子的协同调控,而AMPK是一种综合代谢传感器,可在细胞水平上维持能量平衡,并在协调组织间代谢信号传导中发挥重要作用[21]。因此,为探究BCG感染RAW264.7巨噬细胞后AMPK的表达变化,本研究使用Western Blot检测了在不同感染时间下AMPK的相对表达量。结果表明,与对照组相比,BCG感染RAW264.7巨噬细胞至12 h时,AMPK的表达量达到最高(=0.0031,图3-A)。为明确lincRNA Cox2在BCG感染RAW264.7巨噬细胞后对AMPK的作用,本研究设计并合成了lincRNA Cox2的小干扰RNA。通过qPCR检测结果可以观察到,与对照组相比,小干扰RNA的干扰效率极为显著(=0.000013,图3-B)。之后本研究将该条小干扰RNA或NC转染进RAW264.7巨噬细胞24 h并感染BCG 12 h后,检测了AMPK的相对表达量,发现与BCG组相比,siRNA+BCG组中AMPK的相对表达量发生级显著的上调(=0.000771,图3-C)。之后,进一步通过免疫荧光检测AMPK的表达,发现相对于对照组中的绿色荧光斑点,siRNA+BCG组中绿色荧光斑点显著增多(图3-D)。由此可知,干扰lincRNA Cox2可以促进BCG感染的RAW264.7巨噬细胞中AMPK的表达。

A:Western blot检测BCG感染RAW264.7巨噬细胞不同时间下AMPK的表达量;B:qPCR检测lincRNA Cox2的干扰效率;C:对RAW264.7巨噬细胞转染NC或lincRNA Cox2的小干扰RNA 24 h并且感染BCG 12 h后,Western blot检测AMPK的表达量;D:免疫荧光检测AMPK的表达水平,绿色光点表示AMPK蛋白表达,蓝色光点表示细胞核
2.4 si-lincRNA Cox2后促进糖酵解进程
为明确lincRNA Cox2在BCG感染RAW264.7巨噬细胞后对糖酵解进程的调控作用,本研究选用糖酵解途径中3种关键酶进行实验,分别为HK1、PKM2和LDHA,使用Western Blot检测了BCG感染RAW264.7巨噬细胞并且干扰lincRNA Cox2后,3种关键酶的表达变化。结果表明(图4-A),相对于BCG组,siRNA+BCG组中HK1(=0.00323,图4-B)、PKM2(=0.000135,图4-C)和LDHA(=0.002532,图4-D)的表达都显著上调。因此,本研究进一步检测了糖酵解下游乳酸的分泌情况,结果表明(图4-E),siRNA+BCG组中的乳酸含量显著高于BCG组(=0.020802)。与此同时,qPCR检测促炎因子的表达发现,相较于BCG组,siRNA+BCG组中IL-1β(=0.000451,图4-F)、TNF-α(=0.000147,图4-G)和IL-6(=0.0001,图4-H)的表达发生显著下调。由此可知,si-lincRNA Cox2能够促进糖酵解的进程并抑制炎症因子的表达。
2.5 si-lincRNA Cox2后下调RAW264.7巨噬细胞中细菌载量
将BCG感染后的RAW264.7巨噬细胞裂解后,通过涂布平板法将裂解液稀释涂布于7H10平板上,37℃恒温培养14 d后检测干扰lincRNA Cox2后对RAW264.7巨噬细胞中细菌载量的影响。结果发现(如图5),与BCG组相比,si+BCG组中菌载量发生显著下调(=0.000127)。
2.6 lincRNA Cox2在RAW264.7巨噬细胞中海绵吸附miR-129-5p
lncRNAs可通过碱基对互补性隔离miRNA,使其远离靶mRNA,从而起到miRNA海绵吸附的作用[22]。因此,为探究lincRNA Cox2对糖酵解重编程的作用机制,本研究利用网站BiBiServ预测lincRNACox2与miR-129-5p的结合位点(图6-A),将野生型与突变型的序列整合进pmirGLO Vector载体中,将其转染进293T细胞中37℃培养24h,最后使用双荧光素酶报告基因试剂盒检测荧光素酶活性。如图6-B中双荧光素酶报告基因检测结果显示,相较于NC组,转染miR-129-5p mimics能够显著下调lincRNACox2- WT质粒的荧光素酶活性(=0.001161),证明lincRNACox2与miR-129-5p能够发生相互作用。为进一步证明lincRNACox2与miR-129-5p的相互作用关系,本研究使用qPCR检测在BCG感染RAW264.7巨噬细胞不同时间条件下miR-129-5p的表达情况(图6-C)。结果表明,miR-129-5p在12 h时表达量显著下调(=0.000156),与BCG感染RAW264.7巨噬细胞不同时间条件下lincRNACox2的表达量相比,miR-129-5p的表达呈相反趋势。而干扰lincRNACox2后miR-129-5p发生了极显著的上调(=0.000198,图6-D)。由此可知,当BCG感染RAW264.7巨噬细胞后,lincRNACox2与miR-129-5p特异性结合,从而进行海绵吸附作用。
2.7 miR-129-5p负调控AMPK的表达及糖酵解进程
为探究miR-129-5p能否靶向AMPK,本研究利用网站BiBiServ预测了miR-129-5p 与AMPK的相互作用位点(图7-A),设计并合成了由AMPK的野生型3'-UTR序列驱动的荧光素酶报告基因,该序列包含潜在的miR-129-5p结合位点(AMPK-WT)或含有miR-129-5p结合位点(AMPK-MUT)的突变,将AMPK-WT质粒和AMPK-MUT质粒与NC或miR-129-5p mimics共转染进293T细胞中。结果显示(图7-B),相较于NC组,转染miR-129-5p mimics能够显著下调AMPK-WT质粒的荧光素酶活性(=0.000035),证明miR-129-5p与AMPK能够发生相互作用。为进一步探究miR-129-5p与AMPK的表达关系,将miR-129-5p过表达载体转染进RAW264.7巨噬细胞中从而检测AMPK的表达量。Western blot结果表明(图7-C, D),与BCG组相比,miR-129-5p mimics+BCG组中AMPK的表达量发生极显著的下调(=0.000262)。由此可知miR-129-5p能够负调控AMPK的表达。
为证明miR-129-5p是否能够调控BCG感染的糖酵解进程,利用Western blot检测糖酵解关键酶的表达变化。结果显示(图7-C),与BCG组相比,miR-129-5p mimics+BCG组中HK1(=0.019524,图7-E)、PKM2(=0.001658,图7-F)和LDHA(=0.000887,图7-G)均发生显著下调。因此,本研究进一步检测了糖酵解下游乳酸的分泌情况,结果表明(图7-H),miR-129-5p mimics+BCG组中的乳酸含量显著低于BCG组(=0.044952)。由此可知,过表达miR-129-5p可以抑制BCG感染的RAW264.7巨噬细胞糖酵解进程。
因此,通过以上数据能够证明,lincRNA Cox2能够通过海绵吸附miR-129-5p对AMPK进行调控,进而对糖酵解关键酶己糖激酶(HK1)、丙酮酸激酶(PKM2)和乳酸脱氢酶(LDHA)的表达产生影响,最终调控乳酸的产量(图8)。
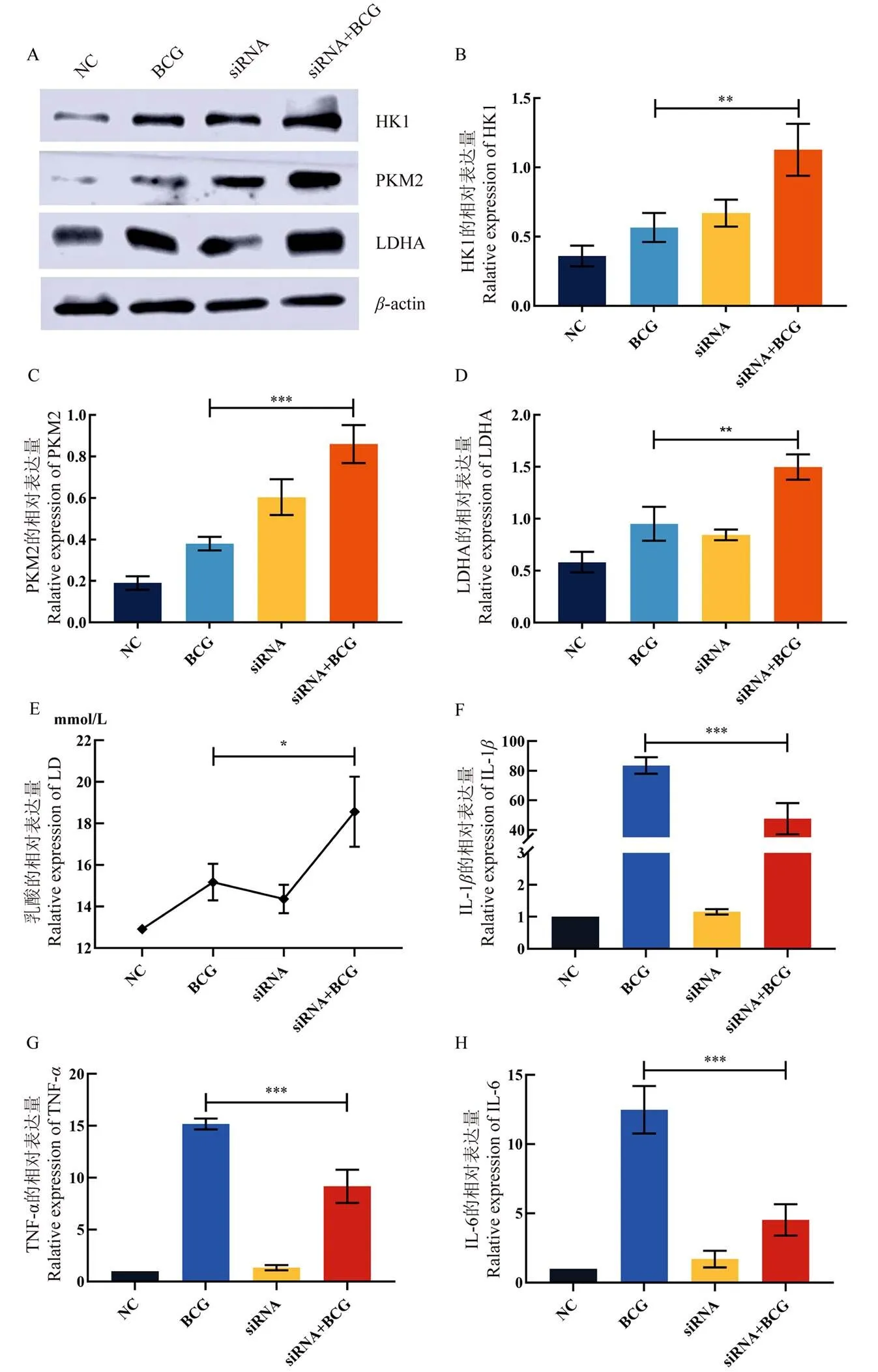
A:在RAW264.7巨噬细胞中转染小干扰RNA 24 h并感染BCG 12 h后,Western blot检测糖酵解关键酶的表达情况;B:定量分析RAW264.7巨噬细胞中HK1的表达情况;C:定量分析RAW264.7巨噬细胞中PKM2的表达情况;D:定量分析RAW264.7巨噬细胞中LDHA的表达情况;E:si-lincRNA Cox2对乳酸分泌情况的影响;F:qPCR检测IL-1β的表达情况;G:qPCR检测TNF-α的表达情况;H:qPCR检测IL-6的表达情况

*** P<0.001
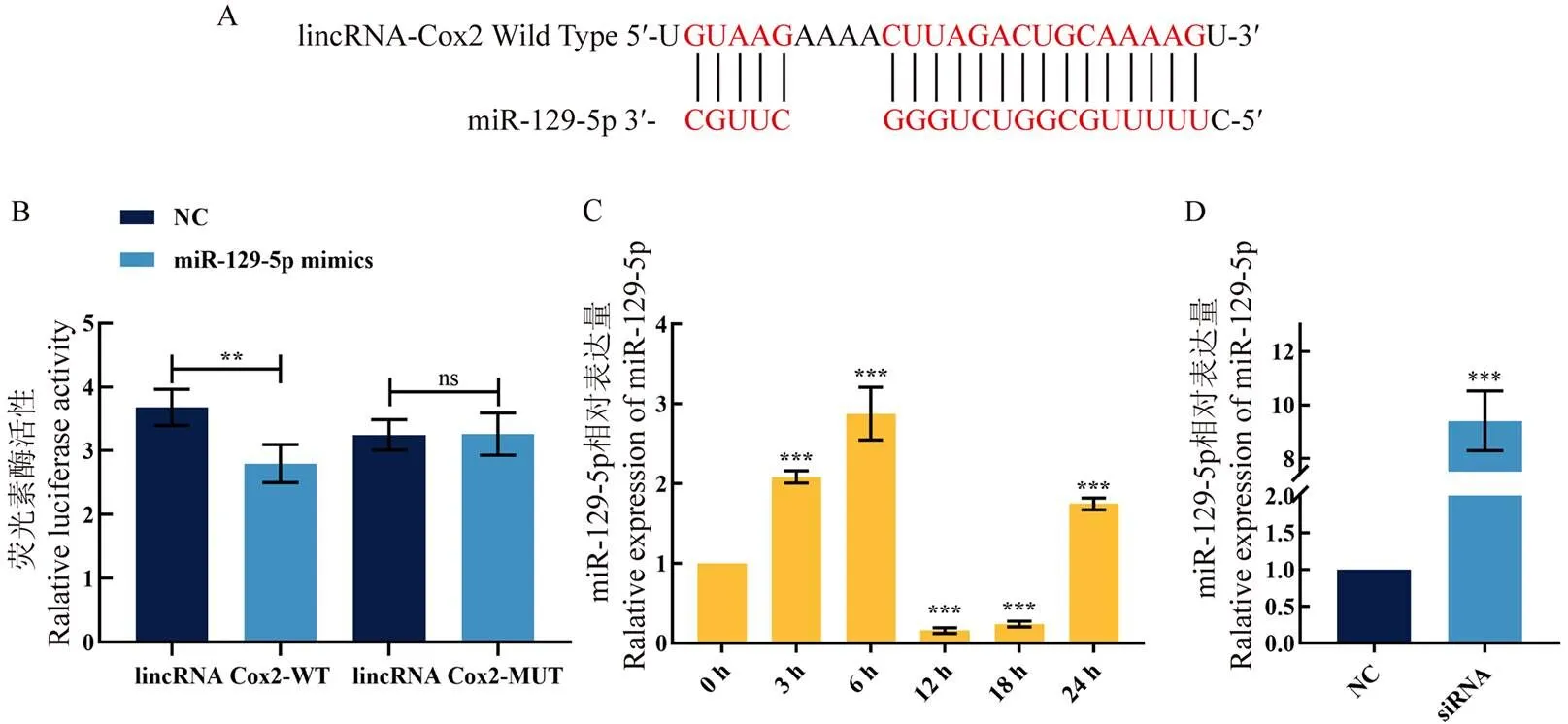
A:lincRNA Cox2和miR-129-5p的结合位点;B:双荧光素酶报告基因证明lincRNA Cox2和miR-129-5p能够发生相互作用;C:BCG感染RAW264.7巨噬细胞不同时间下miR-129-5p的表达;D:qPCR检测干扰lincRNA Cox2后miR-129-5p的表达
3 讨论
3.1 结核分枝杆菌感染巨噬细胞后激活糖酵解进程重编程
结核分枝杆菌作为结核病的致病菌,能够通过气溶胶从活动性肺部感染的个体传播[23]。巨噬细胞作为首先被感染的免疫细胞,是一种研究结核分枝杆菌与宿主之间博弈过程的极佳介质。当巨噬细胞吞噬Mtb后,巨噬细胞启动信号级联反应,将其他免疫细胞募集到肺部,这种免疫细胞的募集会在感染部位周围形成结核肉芽肿。而Mtb和巨噬细胞相互作用的平衡能够影响肉芽肿的结局,进而抑制Mtb的感染进程或者促进Mtb的生长、增殖和全身扩散[24]。巨噬细胞被感染后会极化为两种活化形式,其中M1型巨噬细胞的特征是依靠糖酵解产生能量,并积累产生促炎细胞因子、活性氧、一氧化氮和前列腺素所需的代谢中间体。因此,糖酵解进程重编程的发生以及病原体的存活是众多调控因子相互作用的结果,其中的代谢机制并未完全阐明。
3.2 结核分枝杆菌感染巨噬细胞后LncRNA的作用机制
随着高通量测序技术的发展及研究的深入,研究人员发现了大量的LncRNA。LncRNA是一类长度超过200个核苷酸的RNA,它们不会被翻译成蛋白质产物,而是作为RNA分子发挥作用。LncRNA与大多数mRNA相似,在5′端有特殊帽子结构,3′端有聚腺苷酸。近来有研究表明,一些LncRNA具有小的开放阅读框,能够编码有关键生物学功能的短肽,这说明LncRNA可以同时在RNA和肽中发挥双重作用[25]。如LncRNA-EPS作为一种炎症反应抑制剂,能在巨噬细胞中精确调控免疫反应基因(IRGs)的表达;LincRNA 00948可编码一种跨膜α螺旋微肽—肌调蛋白,且仅在骨骼肌中表达,能够直接与SERCA膜泵相互作用进而抑制肌质网中的钙摄取[26-27]。此外,LncFAM200B还可能通过影响脂肪分化标志基因C/EBPα和AP2,及脂肪合成相关基因SIRT1和PTEN的表达进而影响牦牛肌内脂肪沉积[28]。LncRNA的研究多聚焦在microRNA上,进而对下游靶基因进行调控作用。其中,gga-miR-107-3p吸附LNC_003828影响MINPP1基因在静原鸡肌肉组织的相对表达,进而对IMP的含量产生影响,最终推测三者可能是影响肌肉肌苷酸特异性沉积的关键候选基因[29]。目前,LncRNA和miRNA用于宿主导向疗法以及作为结核病的生物标志物的研究逐渐增多。据报道,LncRNA MIAT在BCG感染巨噬细胞后发生显著上调,并能够通过操纵miR-665/ULK1轴在自噬和抗菌作用中发挥负调节作用[30]。而lincRNA Cox2可以介导不同免疫基因的激活和抑制,并且在H37Rv感染的患者血液中发生高表达,能够作为结核病诊断和治疗靶点的新型生物标志物[31]。本研究发现lincRNA Cox2与miR-129-5p存在结合位点,经双荧光素酶报告基因试验证明lincRNA Cox2与miR-129-5p能够发生特异性结合。并且当BCG感染RAW264.7巨噬细胞12 h后上调lincRNA Cox2的表达,下调miR-129-5p的表达。当干扰lincRNA Cox2后miR-129-5p的表达会上调,证明二者的表达存在负相关性。
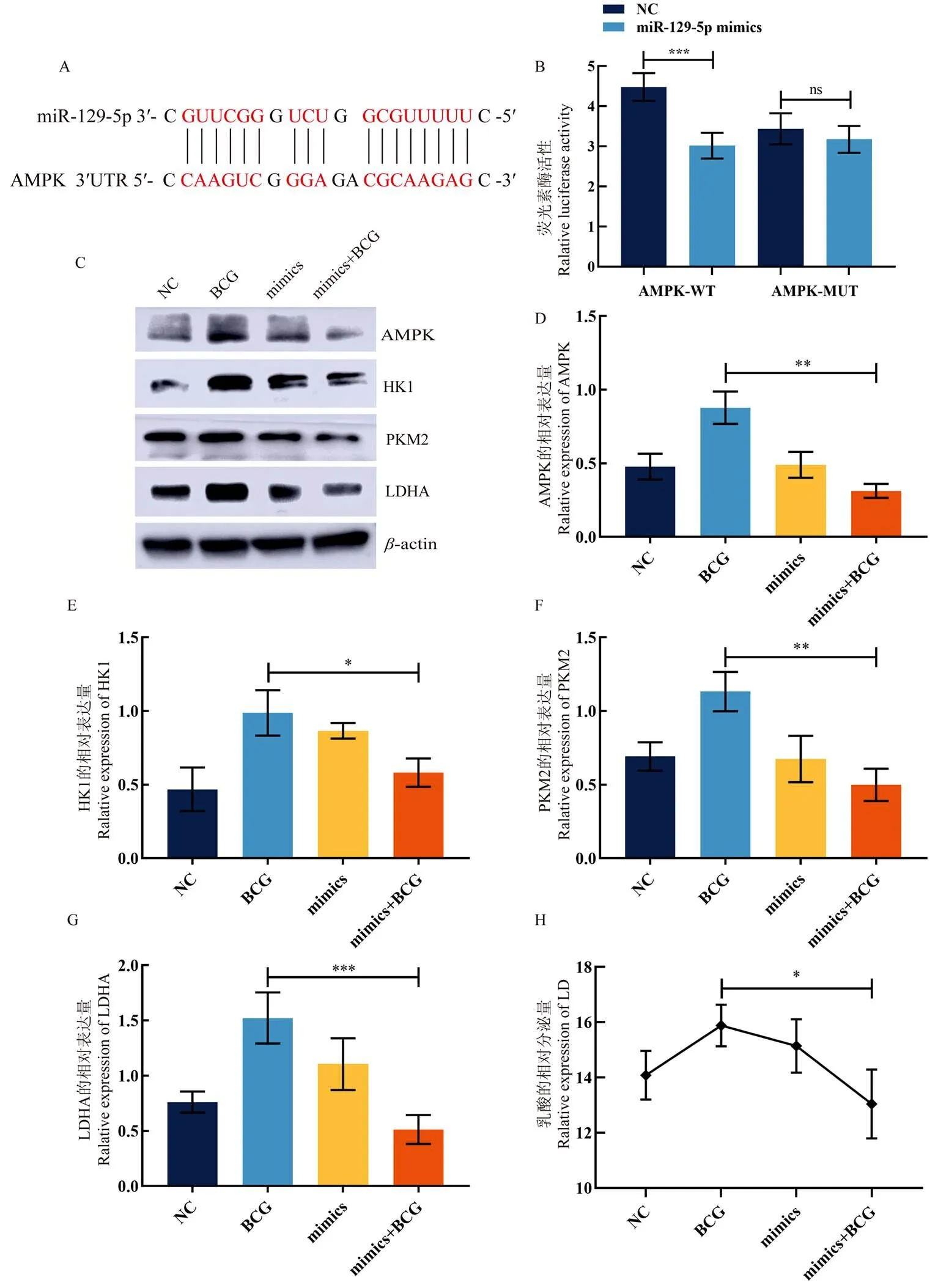
A:miR-129-5p和AMPK的结合位点;B:双荧光素酶报告基因证明miR-129-5p和AMPK能够发生相互作用;C:在RAW264.7巨噬细胞中转染miR-129-5p过表达载体24 h并感染BCG 12 h后,Western blot检测AMPK及糖酵解关键酶的表达情况;D:定量分析RAW264.7巨噬细胞中AMPK的表达情况;E:定量分析RAW264.7巨噬细胞中HK1的表达情况;F:定量分析RAW264.7巨噬细胞中PKM2的表达情况;G:定量分析RAW264.7巨噬细胞中LDHA的表达情况;H:过表达miR-129-5p对乳酸分泌情况的影响

图8 lincRNA Cox2通过miR-129-5p/AMPK调控BCG感染的巨噬细胞糖酵解的机制图
3.3 lincRNA Cox2通过miR-129-5p/AMPK轴调控巨噬细胞糖酵解进程
AMPK已被证明能够参与巨噬细胞糖酵解进程。研究表明,糖酵解能够通过AMPK/SIRT1/NF-κB信号通路调控巨噬细胞焦亡[32];腺苷酸激酶4(Ak4)能够抑制AMPK的活化,使糖酵解重编程产生大量ROS,提高巨噬细胞的杀菌能力[33]。本研究发现,干扰lincRNA Cox2后上调了BCG感染的巨噬细胞中糖酵解进程的关键酶的活性,促进了乳酸的分泌,下调了促炎因子IL-1β、TNF-α和IL-6的表达,并降低了巨噬细胞菌载量。通常糖酵解的活性与促炎因子的分泌以及细胞对菌的清除能力呈正相关关系。但在败血症研究中发现,TGF-β可增强巨噬细胞的糖酵解水平,但下调炎症因子的表达[34]。Ó MAOLDOMHNAIGH等[35]研究也表明,Mtb感染会上调乳酸的分泌,而累积的乳酸会通过负反馈的形式,降低促炎细胞因子的表达。这与本研究的结果一致。此外,课题组前期研究发现,lincRNA Cox2对巨噬细胞的程序性死亡具有重要作用。方舒等人研究表明,干扰lincRNA Cox2可通过促进自噬体的形成,增强细胞自噬反应[36];XU等[37]报道表明,干扰lincRNA Cox2可促进巨噬细胞凋亡的发生。亦有研究表明,乳酸可促进自噬并增强巨噬细胞对Mtb的清除作用[35]。最终胞内菌的存活,是众多免疫通路转归的结果。结合他人研究,本研究认为干扰lincRNA-Cox2通过启动细胞的程序性死亡进程,提高乳酸分泌,增强了细胞的杀菌能力。同时抑制了炎性因子的分泌,降低了因过度炎症而损伤机体的风险,有助于组织的修复,提示其在结核病药物治疗靶点研发中的重要价值。
4 结论
BCG感染RAW264.7巨噬细胞后,干扰lincRNA Cox2通过miR-129-5p/AMPK轴上调巨噬细胞糖酵解关键酶的活性以及乳酸的分泌,并抑制炎症因子的表达,最终抑制胞内菌的存活。
[1] Global tuberculosis report 2022. Geneva: World Health Organization, 2022.
[2] 于嘉霖, 徐雅楠, 韩璐, 马沁梅, 吴晓玲, 邓光存. 脂肪酸结合蛋白4对BCG诱导巨噬细胞自噬的调控作用. 畜牧兽医学报, 2020, 51(9): 2265-2274.
YU J L, XU Y N, HAN L, MA Q M, WU X L, DENG G C. Role of fatty acid binding protein 4 in regulating macrophage autophagy induced by BCG infection. Chinese Journal of Animal and Veterinary Sciences, 2020, 51(9): 2265-2274. (in Chinese)
[3] 毕秀欣, 韩鹏宇, 马吉雪, 李发. 新冠肺炎疫情对全球结核病防治的影响. 口岸卫生控制, 2022, 27(2): 48-51.
BI X X, HAN P Y, MA J X, LI F. Impact of COVID-19 on global tuberculosis prevention. Port Health Control, 2022, 27(2): 48-51. (in Chinese)
[4] PEPPERELL C S. Evolution of tuberculosis pathogenesis. Annual Review of Microbiology, 2022, 76: 661-680.
[5] YANG J S, REN B, YANG G, WANG H Y, CHEN G Y, YOU L, ZHANG T P, ZHAO Y P. The enhancement of glycolysis regulates pancreatic cancer metastasis. Cellular and Molecular Life Sciences, 2020, 77(2): 305-321.
[6] MENDONCA L E, PERNET E, KHAN N, SANZ J, KAUFMANN E, DOWNEY J, GRANT A, ORLOVA M, SCHURR E, KRAWCZYK C, JONES R G, BARREIRO L B, DIVANGAHI M. Human alveolar macrophage metabolism is compromised duringinfection. Frontiers in Immunology, 2022, 13: 1044592.
[7] GLEESON L E, O’LEARY S M, RYAN D, MCLAUGHLIN A M, SHEEDY F J, KEANE J. Cigarette smoking impairs the bioenergetic immune response toinfection. American Journal of Respiratory Cell and Molecular Biology, 2018, 59(5): 572-579.
[8] HUANG L, NAZAROVA E V, TAN S M, LIU Y C, RUSSELL D G. Growth ofsegregates with host macrophage metabolism and ontogeny. The Journal of Experimental Medicine, 2018, 215(4): 1135-1152.
[9] HACKETT E E, CHARLES-MESSANCE H, O’LEARY S M, GLEESON L E, MUÑOZ-WOLF N, CASE S, WEDDERBURN A, JOHNSTON D G W, WILLIAMS M A, SMYTH A, OUIMET M, MOORE K J, LAVELLE E C, CORR S C, GORDON S V, KEANE J, SHEEDY F J.limits host glycolysis and IL-1β by restriction of PFK-M via microRNA-21. Cell Reports, 2020, 30(1): 124-136.e4.
[10] BRIDGES M C, DAULAGALA A C, KOURTIDIS A. LNCcation: lncRNA localization and function. The Journal of Cell Biology, 2021, 220(2): e202009045.
[11] 于志瑞, 张旭, 牛莎莎, 邓光存, 吴晓玲. LncRNA NR003508通过海绵吸附miR-483-3p并靶向MLKL调控BCG感染小鼠巨噬细胞坏死. 畜牧兽医学报, 2022, 53(9): 3149-3159.
YU Z R, ZHANG X, NIU S S, DENG G C, WU X L. LncRNA NR003508 regulates BCG-infected mouse macrophages necrosis by the sponge adsorption of miR-483-3p and targeting MLKL. Acta Veterinaria et Zootechnica Sinica, 2022, 53(9): 3149-3159. (in Chinese)
[12] YAO Q L, XIE Y, XU D D, QU Z L, WU J, ZHOU Y Y, WEI Y Y, XIONG H, ZHANG X L. Lnc-EST12, which is negatively regulated by mycobacterial EST12, suppresses antimycobacterial innate immunity through its interaction with FUBP3. Cellular & Molecular Immunology, 2022, 19(8): 883-897.
[13] LIU L, YU Z R, MA Q M, YU J L, GONG Z Q, DENG G C, WU X L. LncRNA NR_003508 suppresses- induced programmed necrosis via sponging miR-346-3p to regulate RIPK1. International Journal of Molecular Sciences, 2023, 24(9): 8016.
[14] ROBINSON E K, WORTHINGTON A, POSCABLO D, SHAPLEIGH B, SALIH M M, HALASZ H, SENINGE L, MOSQUEIRA B, SMALIY V, FORSBERG E C, CARPENTER S. lincRNA-Cox2 functions to regulate inflammation in alveolar macrophages during acute lung injury. Journal of Immunology, 2022, 208(8): 1886-1900.
[15] LIU Q, JIANG J W, FU Y, LIU T, YU Y, ZHANG X F. MiR-129-5p functions as a tumor suppressor in gastric cancer progression through targeting ADAM9. Biomedicine & Pharmacotherapy, 2018, 105: 420-427.
[16] GAO B, WANG L J, ZHANG N, HAN M M, ZHANG Y B, LIU H C, SUN D L, XIAO X L, LIU Y F. MiR-129-5p inhibits clear cell renal cell carcinoma cell proliferation, migration and invasion by targeting SPN. Cancer Cell International, 2021, 21(1): 263.
[17] SEN K, PATI R, JHA A, MISHRA G P, PRUSTY S, CHAUDHARY S, SWETALIKA S, PODDER S, SEN A, SWAIN M, NANDA R K, RAGHAV S K. NCoR1 controls immune tolerance in conventional dendritic cells by fine-tuning glycolysis and fatty acid oxidation. Redox Biology, 2023, 59: 102575.
[18] DE JESUS A, KEYHANI-NEJAD F, PUSEC C M, GOODMAN L, GEIER J A, STOOLMAN J S, STANCZYK P J, NGUYEN T, XU K, SURESH K V, CHEN Y H, RODRIGUEZ A E, SHAPIRO J S, CHANG H C, CHEN C L, SHAH K P, BEN-SAHRA I, LAYDEN B T, CHANDEL N S, WEINBERG S E, ARDEHALI H. Hexokinase 1 cellular localization regulates the metabolic fate of glucose. Molecular Cell, 2022, 82(7): 1261-1277.e9.
[19] WIESE E K, HITOSUGI S, LOA S T, SREEDHAR A, ANDRES-BECK L G, KURMI K, PANG Y P, KARNITZ L M, GONSALVES W I, HITOSUGI T. Enzymatic activation of pyruvate kinase increases cytosolic oxaloacetate to inhibit the Warburg effect. Nature Metabolism, 2021, 3(7): 954-968.
[20] DING J, KARP J E, EMADI A. Elevated lactate dehydrogenase (LDH) can be a marker of immune suppression in cancer: Interplay between hematologic and solid neoplastic clones and their microenvironments. Cancer Biomarkers, 2017, 19(4): 353-363.
[21] MURALEEDHARAN R, DASGUPTA B. AMPK in the brain: its roles in glucose and neural metabolism. The FEBS Journal, 2022, 289(8): 2247-2262.
[22] 杨舟, 林书典, 詹宇威, 肖璐, 符克英, 黄小蝶. LncRNA MIR22HG 通过海绵吸附miR-22-5p对类风湿关节炎成纤维样滑膜细胞增殖、凋亡和炎性反应的影响. 安徽医科大学学报, 2023, 58(3): 405-412.
YANG Z, LIN S D, ZHAN Y W, XIAO L, FU K Y, HUANG X D. Effects of lncRNA MIR22HG on proliferation, apoptosis and inflammatory response of rheumatoid arthritis fibroblast-like synoviocytes by sponge adsorption of miR-22-5p. Acta Universitatis Medicinalis Anhui, 2023, 58(3): 405-412. (in Chinese)
[23] BOSEDASGUPTA S, PIETERS J. Inflammatory stimuli reprogram macrophage phagocytosis to macropinocytosis for the rapid elimination of pathogens. PLoS Pathogens, 2014, 10(1): e1003879.
[24] HOWARD N C, KHADER S A. Immunometabolism duringinfection. Trends in Microbiology, 2020, 28(10): 832-850.
[25] RANSOHOFF J D, WEI Y N, KHAVARI P A. The functions and unique features of long intergenic non-coding RNA. Nature Reviews Molecular Cell Biology, 2018, 19(3): 143-157.
[26] NELSON B R, MAKAREWICH C A, ANDERSON D M, WINDERS B R, TROUPES C D, WU F F, REESE A L, MCANALLY J R, CHEN X W, KAVALALI E T, CANNON S C, HOUSER S R, BASSEL- DUBY R, OLSON E N. A peptide encoded by a transcript annotated as long noncoding RNA enhances SERCA activity in muscle. Science, 2016, 351(6270): 271-275.
[27] WEI L, LIU K, JIA Q Z, ZHANG H, BIE Q L, ZHANG B. The roles of host noncoding RNAs ininfection. Frontiers in Immunology, 2021, 12: 664787.
[28] 冉宏标, 赵丽玲, 王会, 柴志欣, 王吉坤, 王嘉博, 武志娟, 钟金城. LncFAM200B对牦牛肌内前体脂肪细胞脂质沉积的影响. 中国农业科学, 2022, 55(13): 2654-2666. doi: 10.3864/j.issn.0578-1752.2022. 13.014.
RAN H B, ZHAO L L, WANG H, CHAI Z X, WANG J K, WANG J B, WU Z J, ZHONG J C. Effects of lnc FAM200B on the lipid deposition in intramuscular preadipocytes of yak. Scientia Agricultura Sinica, 2022, 55(13): 2654-2666. doi: 10.3864/j.issn.0578-1752.2022.13.014.(in Chinese)
[29] 禹保军, 邓占钊, 辛国省, 蔡正云, 顾亚玲, 张娟. 静原鸡肌肉组织肌苷酸特异性沉积相关LNC_003828-gga-miR-107-3p-MINPP1的关联分析. 中国农业科学, 2021, 54(19): 4229-4242. doi: 10.3864/ j.issn.0578-1752.2021.19.017.
YU B J, DENG Z Z, XIN G S, CAI Z Y, GU Y L, ZHANG J. Correlation analysis of inosine monophosphate specific deposition related LNC_003828-gga-miR-107-3P-MINPP1 in Jingyuan chicken muscle tissue. Scientia Agricultura Sinica, 2021, 54(19): 4229-4242. doi: 10.3864/j.issn.0578-1752.2021.19.017.(in Chinese)
[30] JIANG F, LOU J, ZHENG X M, YANG X Y. LncRNA MIAT regulates autophagy and apoptosis of macrophage infected bythrough the miR-665/ULK1 signaling axis. Molecular Immunology, 2021, 139: 42-49.
[31] LI D Y, GAO C Y, ZHAO L, ZHANG Y M. Inflammatory response is modulated by lincRNACox2 via the NF-κB pathway in macrophages infected by. Molecular Medicine Reports, 2020, 21(6): 2513-2521.
[32] HE Y N, WANG Y T, JIA X B, LI Y X, YANG Y, PAN L F, ZHAO R, HAN Y, WANG F, GUAN X Y, HOU T Z. Glycolytic reprogramming controls periodontitis-associated macrophage pyroptosisAMPK/ SIRT1/NF-κB signaling pathway. International Immunopharmacology, 2023, 119: 110192.
[33] CHIN W Y, HE C Y, CHOW T W, YU Q Y, LAI L C, MIAW S C. Adenylate kinase 4 promotes inflammatory gene expression via Hif1α and AMPK in macrophages. Frontiers in Immunology, 2021, 12: 630318.
[34] GAUTHIER T, YAO C, DOWDY T, JIN W W, LIM Y J, PATIÑO L C, LIU N, OHLEMACHER S I, BYNUM A, KAZMI R, BEWLEY C A, MITROVIC M, MARTIN D, MORELL R J, ECKHAUS M, LARION M, TUSSIWAND R, O’SHEA J J, CHEN W J. TGF-β uncouples glycolysis and inflammation in macrophages and controls survival during sepsis. Science Signaling, 2023, 16(797): eade0385.
[35] Ó MAOLDOMHNAIGH C, COX D J, PHELAN J J, MITERMITE M, MURPHY D M, LEISCHING G, THONG L, O’LEARY S M, GOGAN K M, MCQUAID K, COLEMAN A M, GORDON S V, BASDEO S A, KEANE J. Lactate alters metabolism in human macrophages and improves their ability to kill. Frontiers in Immunology, 2021, 12: 663695.
[36] 方舒. LncRNA-Cox2对BCG诱导RAW264.7细胞自噬的调控作用[D]. 西宁:宁夏大学, 2021.
FANG S. Regulation of LncRINA-Cox2 on autophagy of RAW264.7 induced byCalmette-Guérin[D]. Xining: Ningxia University, 2021. (in Chinese)
[37] XU Y N, YU J L, MA C J, GONG Z Q, WU X L, DENG G C. Impact of knockdown LincRNA-Cox2 on apoptosis of macrophage infected withCalmette-Guérin. Molecular Immunology, 2021, 130: 85-95.
lincRNA Cox2 Regulates BCG-infected Macrophages Glycolysis by miR-129-5p/AMPK
XU Lei, YU JiaLin, LIU Li, DENG GuangCun, WU XiaoLing
School of Life Sciences, Ningxia University/Key Lab of Ministry of Education for Protection and Utilization of Special Biological Resources in Western China, Yinchuan 750021
【Objective】 The aim of this study was to investigate the regulatory role of lincRNA Cox2 in the glycolysis of RAW264.7 macrophages infected byCalmette-Guerin (BCG), and to elucidate the interaction between Mtb and macrophages, so as to provide a new target for the diagnosis and treatment of tuberculosis.【Method】 RNA interference technique was used to knock down the expression of lincRNA Cox2, and miR-129-5p mimics were used to overexpress miR-129-5p. QPCR was performed to measure the lincRNA Cox2, miR-129-5p and proinflammatory cytokine ( IL-1β, TNF-α, and IL-6 ) expression after BCG infection. The expression of Lactic Acid was detected by Lactic Acid assay kit. The bacterial load was measured bacterial load in BCG-infected macrophages. Dual luciferase reporter gene system validation experiments were carried out on lincRNA Cox2 and miR-129-5p, or miR-129-5p and AMPK relationships. The expression of AMPK (AMP activated protein kinase), HK1 (Hexokinase 1), PKM2 (pyruvate kinase M2), and LDHA (Lactate dehydrogenase A) were detected by Western blotting. 【Result】 The expression of lincRNA Cox2 was significantly upregulated (=0.000013) after BCG infection in RAW264.7 macrophages for 12 h. Compared with the BCG group, the siRNA+BCG group had significantly upregulated the expression of AMPK (=0.000771), HK1 (=0.00323), PKM2 (=0.000135), LDHA (=0.002532), and the secretion of LD (=0.020802), but the expression of IL-1β (=0.000451), TNF-α (=0.000147), IL-6 (=0.0001) was significantly reduced. The lincRNA Cox2 knockdown caused a significant reduce of bacterial load in BCG-infected macrophages (=0.000127). Dual luciferase reporter gene system were performed to the co-localized of lincRNA Cox2 and miR-129-5p, and targeting AMPK. The expression of miR-129-5p was significantly reduced (=0.000156) after BCG infection in RAW264.7 macrophages for 12 h. Compared with the BCG group, the miR-129-5p mimics+BCG group had significantly reduced the expression of AMPK (=0.000262), HK1 (=0.019524), PKM2 (=0.001658), LDHA (=0.000887), and the secretion of LD (=0.044952). 【Conclusion】 lincRNA Cox2 promoted BCG-infected RAW264.7 macrophages glycolysis process by sponging miR-129-5p and targeting AMPK.
lincRNA Cox2; miR-129-5p; AMPK; BCG; macrophages; glycolysis

10.3864/j.issn.0578-1752.2024.08.014
2023-10-27;
2024-01-31
国家自然科学基金(32060160,32160162)、宁夏自然科学基金重点项目(2023AAC02015)
徐蕾,E-mail:xvleilearning@163.com。通信作者吴晓玲,E-mail:wuxiaol@nxu.edu.cn
(责任编辑 林鉴非)
