牦牛小脑不同区域神经营养素-4及其受体的表达特征与定位研究
2024-04-17刘珊珊杜晓华刘霞吴亚娟郑丽平
刘珊珊 杜晓华,* 刘霞 吴亚娟 郑丽平
(1甘肃农业大学动物医学院,甘肃 兰州 730070;2甘肃农业大学生命科学技术学院,甘肃 兰州 730070)
牦牛是青藏高原特有畜种和主要的畜禽遗传资源,是世界上唯一能够在高寒低氧、强紫外线、牧草营养短缺等极端环境中生存的大型反刍动物[1-2]。由于牦牛具有与低氧适应相关的解剖结构和生理特征,如较大的心和肺、较厚的体表覆盖物和发达的皮肤腺,使其能够适应高寒低氧环境[1-3]。脑作为耗氧量较大的组织器官,在高原地区对氧分压的变化十分敏感[4-5]。小脑是中枢神经系统运动协调的主要中心,与大脑运动皮层保持着广泛的神经连接,尽管其体积仅为大脑总体积的10%,但其中包含了超过50%的神经元[6-8]。缺氧可导致神经元供能不足,引发多种异常生理活动,包括酶活性降低、细胞膜通透性改变、膜电位异常和神经冲动传导障碍,最终引起一系列高原病[9-11]。
神经营养素-4(neurotrophin-4,NT-4)是神经营养因子家族重要的成员,也是中枢神经系统神经元的存活因子[12-13],在促进神经元生长、发育、分化与成熟,维持神经元存活以及促进神经元损伤后修复与再生及神经-免疫-内分泌等方面均发挥着重要作用[14-15]。神经营养性酪氨酸激酶受体2(neurotrophic tyrosine kinase receptor type 2,NTRK2)是一种酪氨酸激酶受体,在神经系统中发挥重要的生物学功能[16-17]。研究发现,NT-4可促进脑缺血缺氧后血管的增殖来抵抗缺血缺氧性脑损伤,当NT-4与反应神经元表面受体NTRK2结合后,触发受体激活,从而启动复杂的细胞通路,并促进神经元的生存和发育,抑制细胞凋亡[18-19]。同时,NT-4通过表达上调激活受体NTRK2,组装为NT-4-NTRK2复合物,能够启动细胞内一系列反应来调节缺氧诱导因子-1α(hypoxia-inducibe factor-1α,HIF-1α)的表达,进一步调节参与糖代谢和血管生成的下游蛋白的表达,进而提高动物机体对低氧环境的耐受性[20-21]。此外,机体长期处于高原低氧环境下会导致活性氧(reactive oxygen species,ROS)蓄积,脑组织因ROS过量堆积而引起炎症反应[22-23],星形胶质细胞和小胶质细胞在脑内炎症反应中明显激活,释放多种炎症因子,并损伤脑组织及血管内皮功能[24]。NT-4也可通过降低促炎因子的表达、减轻神经炎症以及改善神经功能对缺血缺氧性脑损伤产生保护作用[25]。目前对NT-4及其受体NTRK2在神经系统方面的研究主要集中在小鼠、大鼠、猴等物种的神经损伤修复等领域,关于牦牛的研究尚鲜见报道。
鉴于此,本研究以牦牛和黄牛小脑组织为研究对象,通过苏木精-伊红染色(hematoxylin-eosin,HE)、免疫组织化学(immunohistochemistry,IHC)、实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)、蛋白免疫印迹(Western blot,WB)对NT-4和NTRK2的分布及表达特征进行研究,旨在阐明NT-4及其受体NTRK2在牦牛与黄牛小脑各区域中的表达规律,分析与牦牛脑组织适应低氧环境的关系,以期为研究牦牛脑组织低氧适应性机制提供参考。
1 材料与方法
1.1 样品采集
甘南牦牛(母,6岁)样品在甘肃省甘南藏族自治州合作市采集,南阳黄牛(母,6岁)在河南省郑州市采集,各3头。分别采集不同区域小脑组织,置于液氮和4%多聚甲醛溶液中保存备用。
1.2 主要试剂及仪器
TriQuick RNA提取试剂盒、放射免疫沉淀试验(radioimmunoprecipitation assay,RIPA)组织快速裂解液,科宝(兰州)生物科技有限公司;Evo M-MLV反转录试剂盒,(长沙)艾科瑞生物工程有限公司;NT-4多克隆抗体(rabbit anti-NT-4 polyclonal antibody,DF6226),艾菲(美国)生物科技有限公司;神经营养性酪氨酸激酶受体2(rabbit anti-NTRK2 monoclonal antibody,4603),上海优宁维生物公司;兔抗β-actin多克隆抗体(rabbit anti-β-actin polyclonal antibody,bs-0061R)、山羊抗兔IgG/HRP (goat anti-rabbit IgG/HRP,bs-0295GHRP),博奥森(北京)生物技术有限公司;链霉卵白素-生物素法检测(streptavidin peroxidase,SP)试剂盒,中杉金桥(北京)生物技术有限公司;增强型HRP-DAB底物显色试剂盒,赛维尔(武汉)科技有限公司;LightCycler96荧光定量PCR仪,瑞士Roche公司;冷冻型高通量组织研磨仪,宁波新芝生物公司;台式高速冷冻离心机,长沙湘仪离心机仪器有限公司;TGrade加热型程控五段金属浴,北京天根生化公司;超微量分光光度计,北京凯奥科技发展有限公司。
1.3 实时荧光定量PCR(qRT-PCR)
1.3.1 引物设计 根据NCBI网站GenBank数据库(https://www.ncbi.nlm.nih.gov/genbank)公布的牦牛NT-4(NM-001304828)与NTRK2(NM-010808129.3)基因序列,同时以β-actin(NM-173979.3)为内参基因,使用Primer Premier 6.0软件设计引物,并送至上海生物工程股份有限公司进行合成,引物信息见表1。
1.3.2 总RNA提取和反转录 用研磨仪充分研磨牦牛与黄牛小脑各区域组织样品,使用TriQuick RNA提取试剂盒提取组织总RNA,并用分光光度计测定RNA浓度,按照Evo M-MLV反转录试剂盒说明书将RNA反转录为cDNA,置于-20 ℃冰箱保存备用。
1.3.3 牦牛与黄牛小脑不同区域NT-4及NTRK2基因扩增 采用反转录的cDNA作为模板,对NT-4、NTRK2、β-actin进行PCR扩增,并使用10 g·L-1琼脂糖凝胶对扩增产物进行分析,以确定目标片段的大小和纯度。
1.3.4 qRT-PCR检测NT-4及NTRK2在牦牛与黄牛小脑中的表达 以β-actin为内参基因,使用荧光定量PCR仪分别将牦牛与黄牛小脑不同区域NT-4及NTRK2进行扩增反应,每组3个重复。反应体系为20 μL:SYBR High-Sensitivy q-PCR SuperMix 10 μL,上下游引物各0.8 μL,cDNA模板 1 μL,dd H2O 7.4 μL。反应条件:50 ℃预热2 min,95 ℃预变性40 s;95 ℃变性30 s,60 ℃退火30 s,共40个循环;每个样品设4次重复。反应结束后,使用Light Cycler®96软件采集Ct值,利用2-ΔΔct法计算目的基因的相对表达量。
1.4 蛋白免疫印迹(WB)
1.4.1 蛋白样品制备 称取牦牛与黄牛小脑不同组织各0.2 g于无酶离心管中,分别加入2 mL RIPA裂解液和20 μL蛋白酶抑制剂,置于预冷的-10 ℃研磨仪中研磨,然后摇床冰浴2 h,离心后收集上清,蛋白浓度测定后分装于-80 ℃冰箱保存备用。
1.4.2 WB检测 将提取的蛋白与4×蛋白上样缓冲液按3∶1的比例混匀后,98 ℃恒温金属浴进行蛋白变性10 min,冷却至室温,存于-20 ℃备用。变性蛋白经10%聚丙烯酰胺凝胶电泳后,湿转法转印至0.22 μm聚偏二氟乙烯膜(polyvinylidenefluoride,PVDF)上,用50 g·L-1脱脂奶粉室温封闭4 h后,孵育一抗(NT-4:1∶500,NTRK2:1∶1 000,β-actin:1∶2 000稀释)4 ℃过夜,磷酸盐缓冲液+Tween(phosphate buffer solution with Tween,PBST)洗涤4次,每次15 min,室温摇床孵育二抗(1∶3 000)2 h,PBST洗涤4次,每次15 min,滴加化学发光液(enhanced-chemiluminescence,ECL)置于化学发光仪进行显影。
1.5 免疫组织化学(IHC)检测
石蜡切片经二甲苯、苯酒(无水酒精与二甲苯1∶1配制)和梯度酒精脱蜡脱水,然后用柠檬酸盐缓冲液进行抗原热修复,冷却至室温后,按SP试剂盒说明书依次滴加内源性过氧化物阻断剂和山羊血清工作液进行阻断封闭,随后滴加一抗,其中NT-4和NTRK2稀释比例均为1∶100,阴性对照用磷酸盐缓冲液(phosphate buffer solution,PBS)代替,4 ℃过夜孵育,次日用PBS洗涤15 min后,滴加生物素标记山羊抗兔IgG于37 ℃温箱孵育15 min,PBS洗涤后滴加辣根酶标记链酶卵白素工作液于37 ℃温箱中孵育15 min,PBS洗涤15 min后滴加现配的增强型二氨基联苯胺(diaminobenzidine,DAB)进行显色,在光学显微镜下控制染色并用自来水终止显色,依次用苏木精复染、盐酸酒精分化、自来水返蓝,脱水透明后用中性树胶封片,在光学显微镜下观察并拍照。
1.6 数据统计分析
使用SPSS 23.0软件进行单因素方差分析(analysis of variance,ANOVA),所有数据均以平均数±标准差(Mean±SD)表示,并采用Graphpad Prism 8.0进行绘图。
2 结果与分析
2.1 qRT-PCR检测结果
PCR扩增产物通过10 g·L-1琼脂糖凝胶电泳后,片段大小与预期相符。NT-4(图1-A)、NTRK2(图1-B)和β-actin(图1-C)分别为160、105和158 bp,扩增产物条带单一,以上结果说明cDNA模板可用于qRTPCR检测。
图1 NT-4 (A)、NTRK2 (B)和β-actin (C)基因扩增Fig.1 NT-4 (A),NTRK2 (B) and β-actin (C) gene amplification
qRT-PCR检测结果表明,牦牛与黄牛小脑各区域中均有NT-4基因的表达,其在牦牛小脑半球皮质中表达量最高,且显著高于其他区域(P<0.05,图2-A),蚓部髓质中表达量最低。另外,黄牛NT-4基因的相对表达量在蚓部髓质中最高,与其余各区域相比,具有显著差异(P<0.05,图2-B),小脑半球髓质表达量最低。
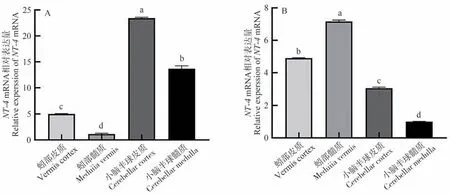
图2 NT-4 基因在牦牛(A)与黄牛(B)小脑不同区域的表达结果Fig.2 The expression of NT-4 gene in different regions of the yaks (A) and cattles (B) cerebellum
NTRK2基因在牦牛与黄牛小脑各区均有不同程度的表达。其中,NTRK2基因在牦牛蚓部皮质中表达量最高,且显著高于其他组织(P<0.05,图3-A),小脑半球皮质次之,小脑半球髓质表达量最低。而在黄牛小脑半球髓质表达量最高,且显著高于其他组织(P<0.05,图3-B),蚓部皮质次之,小脑半球皮质表达量最低。
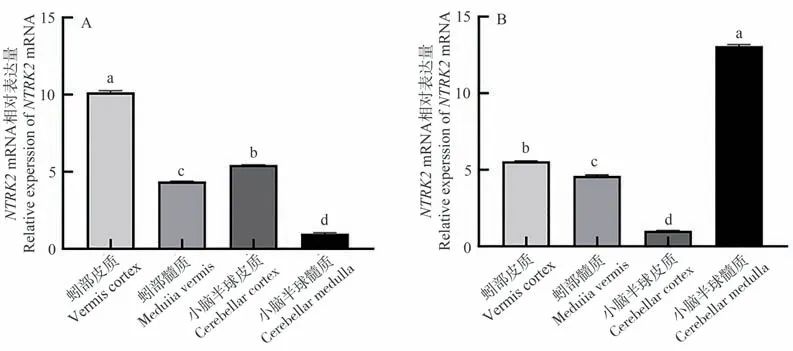
图3 NTRK2基因在牦牛(A)与黄牛(B)小脑不同区域的表达结果Fig.3 The expression of NTRK2 mRNA in different regions of the yaks (A) and cattles (B) cerebellum
与黄牛相比,NT-4基因在小脑半球皮质和小脑半球髓质中的表达量显著高于黄牛,而在蚓部髓质中低于黄牛(图4-A);NTRK2基因在牦牛小脑髓质中的表达量显著低于黄牛,而在蚓部皮质和小脑半球皮质的表达量显著高于黄牛,蚓部髓质的表达量与黄牛无明显差异(图4-B)。
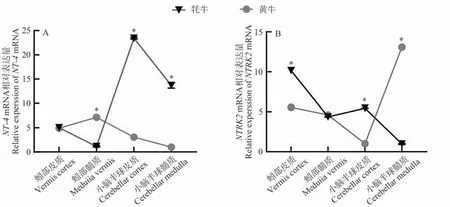
图4 牦牛与黄牛小脑不同区域NT-4及NTRK2基因表达比较Fig.4 Comparative expression of NT-4 and NTRK2 in different regions of the yaks and cattles cerebellum
2.2 WB检测
WB结果表明,NT-4蛋白在牦牛与黄牛小脑各区域均有表达。牦牛小脑半球皮质表达量最高,且显著高于其他组织(P<0.05,图5-A),小脑半球髓质次之,蚓部皮质表达量最低。黄牛蚓部髓质表达量最高,显著高于其他组织(P<0.05,图5-B),蚓部皮质次之,小脑半球髓质表达量最低。
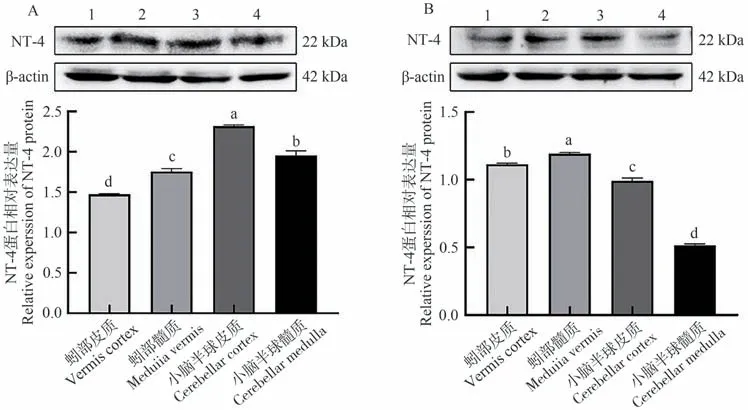
图5 牦牛(A)与黄牛(B)小脑不同区域中NT-4蛋白表达情况Fig.5 Expression of NT-4 protein in different regions of the yaks (A) and cattles (B) cerebellum
NTRK2蛋白在牦牛与黄牛小脑各区域均有表达,其中,NTRK2在牦牛蚓部皮质中表达最高,且显著高于其他组织(P<0.05,图6-A),小脑半球髓质次之,蚓部髓质表达量最低。NTRK2在黄牛小脑半球髓质中表达量最高,显著高于其他组织(P<0.05,图6-B),蚓部皮质次之,小脑半球皮质表达量最低。
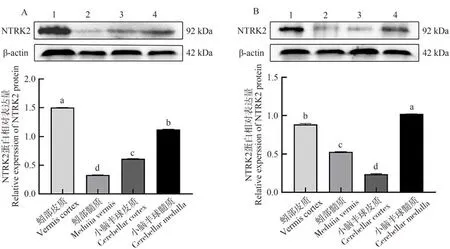
图6 牦牛(A)与黄牛(B)小脑不同区域中NTRK2蛋白表达情况Fig.6 Expression of NTRK2 protein in different regions of the yaks (A) and cattles (B) cerebellum
与黄牛相比较,NT-4蛋白在牦牛小脑各区域中的表达量均高于黄牛(图7-A);NTRK2蛋白的表达量在蚓部髓质和小脑半球髓质中低于黄牛或无差异,其余区域均高于黄牛(图7-B)。
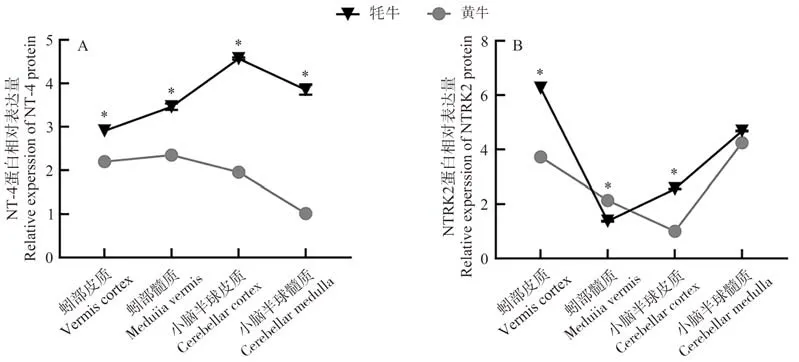
图7 牦牛与黄牛小脑不同区域NT-4 (A)及NTRK2 (B)蛋白表达比较Fig.7 Comparative expression of NT-4 (A) and NTRK2 (B) in different regions of the yaks and cattles cerebellum
2.3 IHC检测结果
通过HE染色观察牦牛和黄牛小脑组织结构,结果如图8、9所示,牦牛和黄牛小脑各区域组织结构相似。蚓部皮质和小脑半球皮质从浅到深均可分为分子层、浦肯野细胞层和颗粒层。分子层主要包括无髓神经细胞纤维和少量神经元,如胞体较大的篮状细胞;浦肯野细胞层由排列整齐的浦肯野细胞胞体组成,胞体呈梨形;颗粒层则由密集的颗粒细胞和一些高尔基细胞组成。蚓部髓质和小脑半球髓质形态结构相似,主要有神经胶质细胞和神经纤维组成,并伴有少量血管。

图8 牦牛小脑不同区域中NT-4和NTRK2蛋白分布Fig.8 Distribution of NT-4 and NTRK2 proteins in different regions of the yaks cerebellum
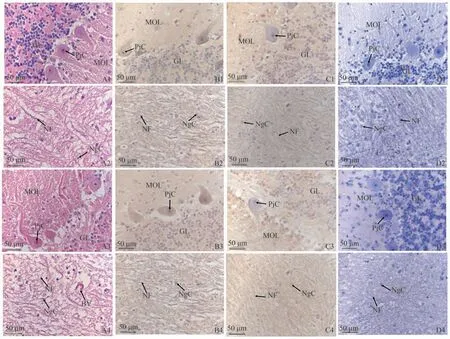
图9 黄牛小脑不同区域中NT-4和NTRK2蛋白分布Fig.9 Distribution of NT-4 and NTRK2 proteins in different regions of the cattles cerebellum
通过免疫组织化学染色法检测牦牛与黄牛小脑各区域NT-4及NTRK2的分布及定位。结果如图8、9所示,黄牛小脑NT-4和NTRK2阳性细胞的分布和定位趋势与牦牛一致,阳性产物主要分布于细胞质。在蚓部皮质和小脑半球皮质的分子层中,可见散乱分布的NT-4和NTRK2阳性反应,同时篮状细胞的胞质中也有少量阳性表达。浦肯野细胞的胞质中亦有阳性产物分布,而颗粒细胞的胞质中也呈现大量细胞表达阳性产物。此外,在蚓部髓质和小脑半球髓质中,阳性着色多集中于神经元胞质中,在神经胶质细胞中也有少量阳性产物分布。
3 讨论
NT-4作为神经营养因子家族中的重要成员之一,可控制脊椎动物神经元的存活和分化,同时在脑缺血缺氧后可通过NT-4-NTRK2信号传导途径发挥内源性保护作用[26]。本研究结果显示,NT-4基因和蛋白在牦牛与黄牛小脑不同区域均有表达,牦牛NT-4蛋白在小脑各区域中表达水平显著高于黄牛,该蛋白在小脑半球皮质中表达量最高,小脑半球髓质中表达量次之,在牦牛蚓部皮质中表达量最低。然而,NT-4基因在牦牛蚓部髓质中表达量最低。有研究报道,基因的转录和蛋白的翻译存在时空差异[27],这可能是造成NT-4基因及其蛋白存在表达差异的主要原因。前人研究表明,机体长期处于高原低氧环境下,会使小脑半球浦肯野细胞中酶活性降低、供能不足、机体免疫能力减弱,进而引起炎症反应[28-29]。此外,还有研究报道NT-4可通过降低促炎因子的表达水平、减轻神经炎症以及改善神经功能对缺血缺氧性脑损伤产生保护作用[25,30]。髓质主要由密集的纤维束和神经网络组成,其中神经胶质细胞是神经营养因子的主要来源,已被证明在控制神经发生、细胞迁移、轴突生长、维持血脑屏障以及控制体内平衡和血管张力等方面发挥重要作用[31-32]。由此推测NT-4可能在牦牛与黄牛小脑神经元的存活、生长以及功能发挥方面具有调节作用,牦牛小脑半球中NT-4的高表达可能也会参与神经-免疫-内分泌调控网络,进而使脑组织更好的适应低氧环境。
NTRK2是原肌球蛋白受体激酶家族中的重要成员,也是NT-4的高亲和力受体,NT-4对脑组织的神经保护作用需NTRK2的激活[33]。相关研究发现,当机体或细胞受到缺血缺氧刺激时,会诱导NT-4和NTRK2的表达增加,NT-4随后诱导NTRK2形成二聚体,并自动发生磷酸化,磷酸化受体再通过相关途径调节缺氧诱导因子-1α(HIF-1α)的表达[26]。本研究结果与上述研究结果相一致,即NT-4及NTRK2在牦牛蚓部皮质和小脑半球皮质中的表达量均显著高于黄牛,说明二者协同对神经元发挥了内源性保护作用,但两种因子在牦牛蚓部髓质的表达趋势不一致,提示NT-4与NTRK2并非一一对应关系,可能与低亲和力受体竞争NT-4并与之结合有关。
已有研究表明,在中枢神经和周围神经系统中的大多数神经元中均可观察到NT-4和NTRK2阳性表达[34],这与本研究中NT-4和NTRK2蛋白在牦牛和黄牛小脑各区域均有阳性表达结果一致,即在小脑各区域的皮质中主要定位于分子层、浦肯野细胞层和颗粒层的神经元胞质中,在髓质各区域中主要分布于神经纤维以及神经胶质细胞中,说明NT-4和NTRK2对小脑的神经保护作用主要依赖于以上神经元的存活来维持中枢神经系统内环境的稳定。但是,在成年恒河猴脑组织中NT-4仅存在于浦肯野细胞中,而在颗粒层未见阳性表达[35],这与本研究结果不一致,可能与物种差异以及机体耗氧量有关。此外,有研究显示,NT-4在不同神经元中的表达水平会随着缺血缺氧性损伤增强而升高[12],本研究发现,牦牛小脑各区域中NT-4和NTRK2蛋白免疫阳性反应强度整体强于黄牛,推测可能与牦牛长期处于低氧环境有关。脑组织受到低氧刺激时,上述细胞被激活并诱导NT-4和NTRK2表达,再通过HIF-1α调节参与糖代谢和血管生成的下游蛋白的表达,有助于牦牛适应高原低氧环境。
4 结论
NT-4和NTRK2在成年牦牛与黄牛小脑各区域中均有表达且存在显著差异,与黄牛相比,两种因子在牦牛小脑中的表达水平更高,提示NT-4和NTRK2除了共同参与调控机体正常的生理功能之外,也可能在牦牛小脑神经元及神经胶质细胞低氧适应过程中发挥内源性神经保护作用,进而使脑组织免受低氧损伤。
