基于UPLC-QTOF-MS解析苦荞黄酮组成及药理学网络分析
2024-04-17董玲张凤菊赵驰杨文渊韩梅黄巧莲阿木布哈李治华
董玲 张凤菊,* 赵驰 杨文渊 韩梅 黄巧莲 阿木布哈 李治华,*
(1四川省农业科学院农产品加工研究所,四川 成都 610066;2四川省农业科学院园艺研究所,四川 成都 610066;3四川省农业科学院农业质量标准与检测技术研究所,四川 成都 610066;4甘洛县教育体育和科学技术局,四川 凉山 615100)
苦荞[Fagopyrumtataricum(L.)Gaertn.]是蓼科(Polygonaceae)荞麦属(FagopyrumMill)双子叶植物成熟的种子[1]。苦荞作为重要的药食同源性食品原料,具有很高的医药价值,包括预防高血压、癌症,辅助降血糖、血脂和消炎镇痛等多种功效[2-3]。研究发现,苦荞黄酮提取物具有多种生物活性功能,如降低脂质过氧化对机体的损伤,治疗心血管疾病[4];抑制肝细胞脂肪积累与变性、减轻乙醇对肝细胞膜和细胞的氧化损伤,从而缓解脂肪肝炎症[5];阻止血浆氧化三甲胺(plasma trimethylamine-N-oxide,TMAO)引起的血管功能障碍和肝损伤[6];通过靶向调节丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPKs),防止细胞氧化还原态失衡,改善胰岛素抵抗作用,显著保护细胞免受高糖诱导的氧化损伤[7]。苦荞提取物的生物功能与苦荞富含黄酮类物质相关[6-7],主要包括芦丁、槲皮素和山奈酚等[8]。
目前,黄酮提取方法主要包括有机溶剂浸提、热水提取、超临界萃取、超声辅助提取、微波辅助提取和酶法提取等[9-10]。由于大多数黄酮类物质不溶于水,所以黄酮物质提取常采用有机溶剂。提取溶剂包括甲醇、乙醇、丙酮等。相较于甲醇、丙酮等有机试剂,乙醇具有绿色、高效、易回收、污染小且价格低等优点。超高效液相色谱-四级杆-飞行时间质谱(ultrahigh performance liquid chromatography-quadrupoletime of flight mass spectrometry,UPLC-QTOF-MS)是复杂样品中化学组成分析和鉴定的重要工具,具有高效分离能力以及高灵敏度、高选择性、高质量精度和扫描范围广等特点,已被广泛应用于植物成分鉴定。中药系统药理学(Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform,TCMSP)收录了《中华人民共和国药典 2010年版》中所有中草药的化合物成分,并为每种化合物提供了药理作用靶点及相关疾病信息。该研究平台被广泛应用于中药新药开发及中医理论研究,为传统中药活性物质开发提供了网络的系统分析[11]。
本研究通过优化以乙醇为试剂的苦荞黄酮绿色高效提取方法,基于UPLC-QTOF-MS解析苦荞中黄酮主要物质结构,同时采用液相色谱-三重四级杆质谱联用(ultra-high performance liquid chromatography coupled with triple quadrupole mass spectrometry,UPLCQqQ-MS/MS)分析方法对鉴定到的主要关键黄酮进行定量分析,并基于网络药理学分析其活性物质的中药传统药理学作用,旨在为苦荞精深加工及黄酮物质开发利用提供基础数据和理论参考。
1 材料与方法
1.1 材料与试剂
苦荞,甘洛大凉山荞升酒业有限责任公司;芦丁对照品,上海源叶生物科技有限公司;亚硝酸钠、硝酸铝、无水乙醇(分析纯),成都市科龙化工试剂厂;甲醇,赛默飞世尔科技公司(美国)。
对照品:白杨素(I1521027)、大豆苷元(E1631116)、漆黄素(K1629007)、山奈酚(A1619011)、木犀草素(H1617016)、儿茶素(B1707017)、槲皮素(C20J6Y17 22)、淫羊藿苷(F1806121)、柚皮苷(C1420111)、地奥司明(K1809143),上海阿拉丁生化科技股份有限公司;甘草素(RDD-G03611805007)、芒柄花黄素(BZ2021101803)、芹菜素(RFS-Q00211801029)、黄豆黄素(BZ2021101805)、二氢槲皮素(BZ2021101804)、二氢杨梅素(BZ2021101801)、牡荆素(BX2021101802)、染料木苷(BZ2021101806)、黄豆黄苷(BZ2021101807)、黄芪苷(Z-020-160519)、槲皮苷(RFS-H01111805008)、木犀草苷(M-025-160307)、大豆苷(BZ2021101808)、异槲皮苷(K2002218),成都瑞芬思德丹生物科技有限公司;染料木素(20150615)、黄芩苷(20210317),国药集团化学试剂有限公司(上海);柚皮素(BCBN9024 V),美国sigma公司;鹰嘴豆芽素A(J1215AS)、表儿茶素(N0906AS)、异牡荆素(M0420AS),大连美仑生物技术有限公司;山奈素(F11A11X108412)、杨梅素(YM0311YA13)、水飞蓟素(C27N11Y131954)、芦丁(E1908122),上海源叶生物科技有限公司;葛根素(C10800621),上海麦克林生化科技股份有限公司,均供含量测定用。
1.2 主要仪器与设备
5810R台式冷冻离心机,德国Eppendorf公司;SynergyHTX多功能微孔板检测仪,美国伯腾仪器有限公司;超高效液相色谱仪,美国Waters公司;AB 5000三重四极杆质谱仪,AB SCIEX公司(美国);Dionex UltiMate 3000超高效液相色谱仪、Thermo Q Exactive Focus四极杆-静电场轨道阱高分辨质谱仪,美国Thermo Fisher公司;超声波细胞破碎仪,上海力辰邦西仪器科技有限公司。
1.3 苦荞原料处理
将黑苦荞初筛去杂,在50 ℃烘箱中干燥4 h,取出后磨成细粉,密封保存,待用。
1.4 苦荞乙醇超声提取条件工艺优化
本试验重点研究乙醇浓度、超声功率、超声温度、超声时间以及料液比5种关键因素对苦荞黄酮提取率的影响。称取样品1.0 g,精密称定后置于小烧杯中,在以下试验条件下进行黄酮提取。(1)乙醇浓度:加入40 mL浓度(V/V)分别为50%、60%、70%、80%、90%、100%的乙醇,超声功率为200 W,在50 ℃条件下超声30 min。超声后用中速滤纸过滤,滤液用各对应浓度乙醇溶液定容到50 mL,待测。(2)超声功率:加入40 mL浓度为60%的乙醇,超声功率分别为100、120、140、160、180、200 W,在50 ℃条件下超声30 min。超声后用中速滤纸过滤,滤液用60%浓度乙醇定容到50 mL,待测。(3)超声温度:加入40 mL浓度为60%的乙醇,超声功率为200 W,在40、50、60、70、80℃条件下分别超声30 min。超声后用中速滤纸过滤,滤液用60%浓度乙醇定容到50 mL,待测。(4)超声时间:加入40 mL浓度为60%的乙醇,超声功率为200 W,在50 ℃条件下分别超声30、40、50、60、80、100 min。超声后用中速滤纸过滤,滤液用60%浓度乙醇定容到50 mL,待测。(5)料液比:分别加入30、40、50、60、70 mL浓度为60%的乙醇,超声功率为200 W,在50 ℃条件下超声30 min。超声后用中速滤纸过滤,滤液用60%浓度乙醇定容到100 mL,待测。
1.5 苦荞总黄酮测定
1.5.1 总黄酮标准曲线的制备 参照葛瑞宏等[12]的方法,采用亚硝酸钠-硝酸铝比色法测定总黄酮含量。具体操作如下:取芦丁标准品5.000 0 mg,用60%的乙醇溶液定容至25 mL容量瓶中,得到浓度为0.2 mg·mL-1的芦丁标准品储备液。分别取0、1.0、2.0、3.0、4.0、6.0 mL的上述储备液于9个10 mL的容量瓶中,用60%乙醇稀释定容至10 mL,得到浓度分别为0、0.02、0.04、0.06、0.08、0.12 mg·mL-1的芦丁标准储备液。分别取上述浓度的标准储备液5 mL于试管中,加入5%亚硝酸钠0.7 mL放置6 min,再加入10%硝酸铝0.7 mL放置6 min,加4%氢氧化钠2 mL,摇匀并定容至10 mL,10 min后测定510 nm处的吸光值(A),制作标准曲线回归方程。
1.5.2 苦荞提取物中总黄酮测定 取5 mL提取液置于试管中,加入5%亚硝酸钠0.7 mL放置6 min,再加入10%硝酸铝0.7 mL放置6 min,加4%氢氧化钠2 mL,摇匀并定容至10 mL,10 min后测定510 nm处的吸光值(A1),减去空白板吸光值(A0)得到准确吸光度值(A)。提取得率(mg·g-1)按以下公式计算[12]:
提取得率=提取液中黄酮类化合物总量/提取用苦荞质量。
1.6 UPLC-QTOF-MS黄酮结构定性解析
色谱柱采用Kinetex®Biphenyl 100 Å柱(100 mm×2.1 mm,1.7 μm);柱温为40 ℃;流动相A为0.1%甲酸水溶液;流动相B为乙腈,梯度洗脱,流速为0.3 mL·min-1。梯度洗脱程序见表1,黄酮提取液进样量为2 μL。
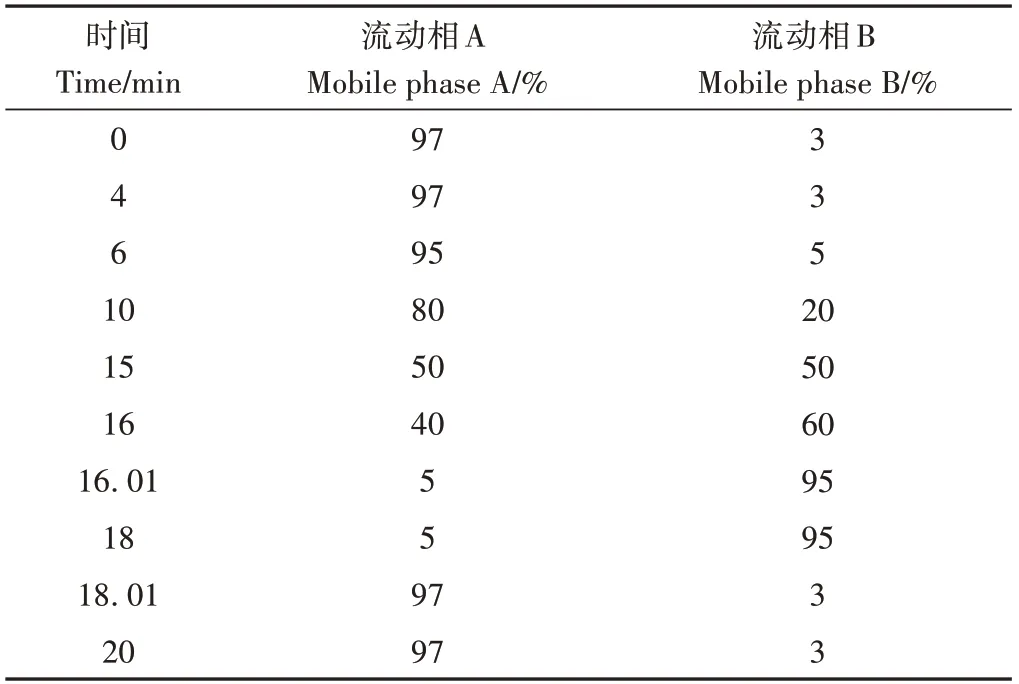
表1 UPLC洗脱程序Table 1 UPLC elution procedure
质谱条件:电喷雾离子源(electron spray ionization,ESI);扫描模式为二级子离子采用加数据依赖采集模式(data-dependent acquisition,DDA);扫描范围为质荷比(m/z)80~1 200;喷雾电压为-3 kV;鞘气压力为7 000 kPa,辅助气压力为1 750 kPa;一级质谱全扫描分辨率为70 000,二级质谱分辨率为17 500,碰撞能量为20、40、60 eV;离子传输温度为325 ℃;辅助加热温度为350 ℃。
1.7 UPLC-QqQ-MS/MS黄酮定量分析
定量分析采用Waters超高效液相色谱仪和AB 5000三重四极杆质谱仪。
色谱条件:采用ACQU ITY UPLC®BEH C18色谱柱(2.1 mm×100 mm,1.7 μm,美国Waters公司),黄酮提取液和黄酮对照品进样量5 μL,柱温40 ℃,流动相A为0.1%甲酸水,流动相B为甲醇,流速为0.25 mL·min-1。梯度洗脱条件为0~1 min,10% B;1~3 min,10%~33% B;3~10 min,33% B;10~15 min,33%~50% B;15~20 min,50%~90% B;20~21 min,90% B;21~22 min,90%~10%B;22~25 min,10% B。
质谱条件:电喷雾离子源(ESI),负离子电离模式。离子源温度500 ℃,离子源电压-4 500 V,碰撞气41.37 kPa,气帘气206.84 kPa,雾化气和辅助气均为344.74 kPa。检测方式:采用多重反应监测(multiple reaction monitoring,MRM)进行扫描,用特征离子对进行定量分析。
1.8 苦荞中关键有效生物活性类黄酮成分的药理学分析
用中药系统药理学TCMSP数据库查询从UPLCQTOF-MS分析得到的代谢物,鉴定其是否属于关键活性成分,并查询防治相关疾病信息。当代谢产物的口服生物利用度(oral bioavailability,OB)≥5%、药物相似度(drug-likeness,DL)≥0.14时[13],视为苦荞中属于中药的关键活性成分。
2 结果与分析
2.1 提取条件对黄酮提取率的影响
以芦丁作为总黄酮测定的标准物质,测定芦丁系列浓度在510 nm波长处的吸光值,以吸光值为纵坐标、芦丁浓度为横坐标,制作标准曲线,得到回归方程如下。由图1-A可知,卢丁质量浓度与吸光值间的线性关系良好。
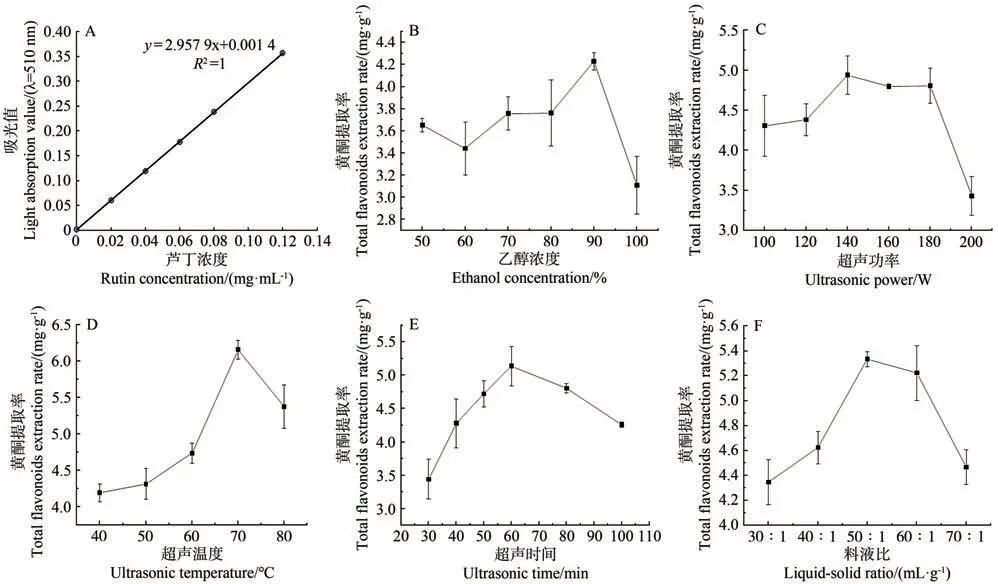
图1 提取条件对黄酮提取率的影响Fig.1 Effect of extraction conditions on the extraction rate of total flavonoids
y=2.957 2x+0.001 4,R2=1(n=6)
苦荞黄酮提取率随着乙醇浓度(图1-B)、超声功率(图1-C)、超声温度(图1-D)、超声时间(图1-E)和提取液与苦荞原料比(图1-F)的增加而提高,当达最高值时,又开始呈现下降趋势。
单因素试验结果表明,乙醇浓度90%(V/V)、超声功率140 W、超声温度70 ℃、超声时间60 min、提取液与苦荞原料比50∶1(mL·g-1)为超声辅助乙醇提取苦荞黄酮的有效条件。
2.2 UPLC-QTOF-MS黄酮结构鉴定
如表2所示,本研究从苦荞乙醇提取物中共鉴定到16种黄酮类物质,[M-H]-分子量为268.898~609.138。其中分子量为268~300的有6个,300~400的有2个,400~500的有6个,500~600的有1个,大于600的有1个。在黄酮结构方面,主要可分为黄酮醇、黄烷醇和黄酮糖苷3类,其中芦丁、异牡荆素、牡荆素、异槲皮苷、槲皮苷、柚皮苷、黄芪苷和木犀草苷均为黄酮糖苷类,表明黄酮糖苷类化合物是苦荞中的主要类黄酮成分结构。
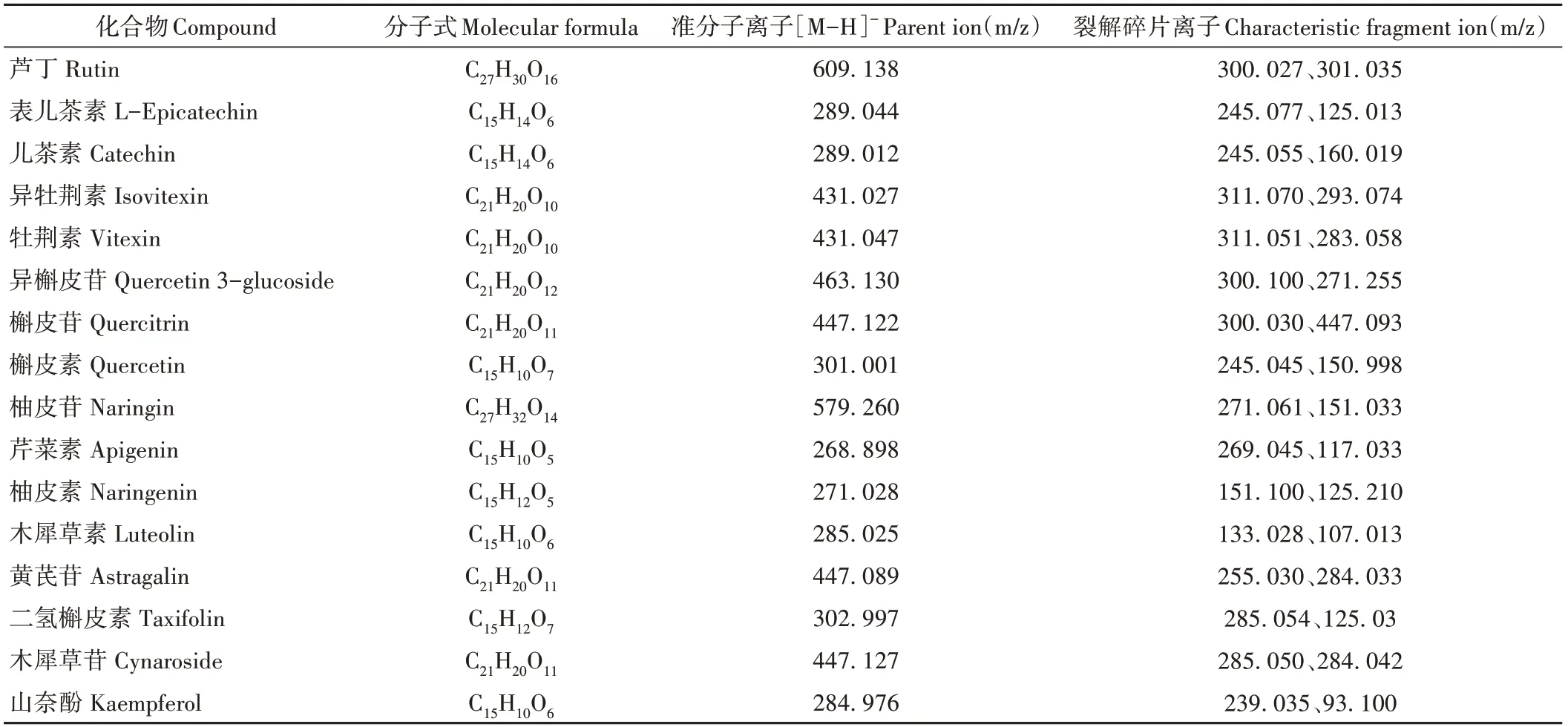
表2 苦荞提取物中黄酮鉴定结果Table 2 Identification results of flavonoids in tartary buckwheat extract
2.3 黄酮定量分析
由表3可知,所有测定的黄酮对照品在测定范围内的相关系数均大于0.99,线性关系良好,定量限为0.1~2.0 ng·mL-1。用标准曲线对苦荞黄酮提取物进行定量分析,检测到的黄酮物质总含量为239.87 μg·mL-1。其中,芦丁、表儿茶素和儿茶素含量较高,分别为115.81、72.99和23.08 μg·mL-1。
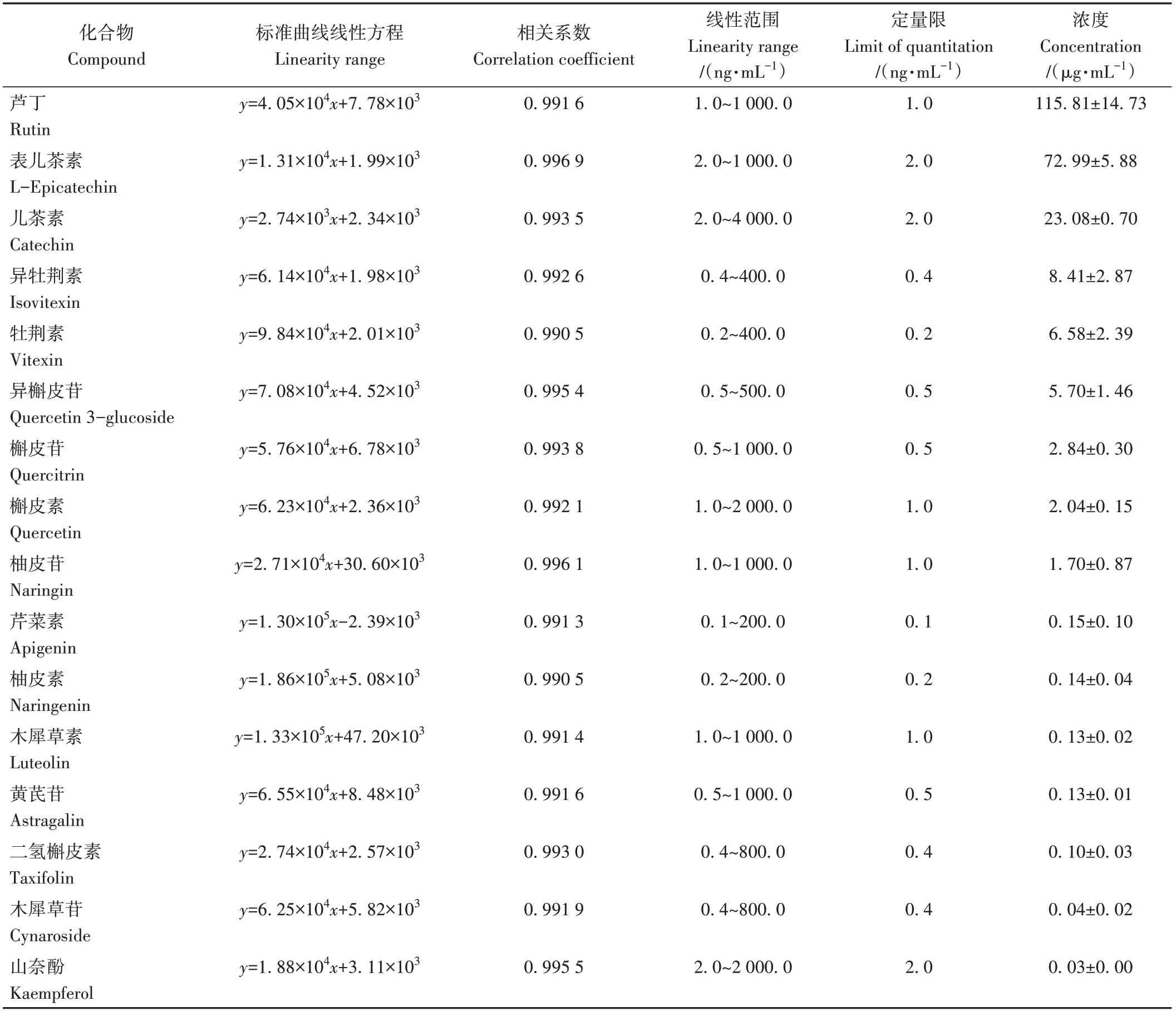
表3 苦荞提取物中黄酮定量分析结果Table 3 Quantitative analysis results of flavonoids in tartary buckwheat extract
2.4 苦荞中黄酮类关键活性物的网络药理学分析
采用TCMSP数据库分析苦荞中黄酮类物质的潜在功能价值,结果见表4。苦荞中黄酮化合物的口服生物利用度(OB)整体较高,仅少量糖苷类化合物的OB较低。本试验提取和鉴定的黄酮化合物分子量大部分小于500(表2),表明苦荞黄酮在潜在口服生物利用度上较高。同时,由表4可以看出,苦荞黄酮化合物的类药性(DL)值也较高,均大于0.14。
3 讨论
本研究乙醇浓度对苦荞黄酮提取率影响的结果,与龙旭等[14]提取丹参黄酮的结果相似,可能与苦荞中黄酮物质的极性相关;超声功率增大可增加空化效应,破坏细胞壁和细胞膜,有利于黄酮物质溶出,当功率过大,也会破坏黄酮的结构,导致提取率降低[15];当提取温度超过70 ℃时,黄酮提取率呈现下降趋势,可能是高温导致黄酮类物质结构受到破坏所致[16]。当超声时间从60 min增至100 min时,黄酮提取率明显下降,可能是由于提取时间过长导致黄酮发生变性损失,进而导致黄酮提取率呈现下降趋势[17]。
UPLC-QTOF-MS鉴定结果显示,苦荞中黄酮类化合物主要属于黄酮苷类化合物,这与王佳蕊[18]的研究结果一致。值得注意的是,前人在苦荞叶和花中都发现了木犀草素(Luteolin)[19-20],本研究在荞麦种子中也发现了该化合物,有利于丰富对苦荞生长周期中各阶段形成的黄酮类化合物的认识。有报道显示,苦荞中的槲皮素和山奈酚含量高于表儿茶素和儿茶素含量,这与本研究结果不一致,推测主要原因是原料和提取工艺不同[21]。本研究的试验材料为凉山州黑苦荞。凉山州地处川西高原,受当地海拔、气温的影响,黑苦荞独特的植物生物代谢方式造成其黄酮类化合物间的差异[22]。
从苦荞中鉴定到的黄酮经网络药理学分析,大部分具有较高的口服生物利用度(OB)和类药性(DL),虽然有个别黄酮物质OB较低,但该活性物质经胃肠道消化代谢,脱去糖后形成的苷元的OB较高,如芦丁的OB只有3.2,经胃肠道菌群消化代谢后的产物槲皮素的OB为46.43[23]。由此推测苦荞的药用功能可能与苦荞中的黄酮化合物质具有较高的OB相关。苦荞黄酮类物质作用靶点主要集中在前列腺素G/H合成酶受体1和2(prostaglandin G/H synthase 1/2,PTGS1/PTGS2),PTGS1有间接保护心脏的作用[24]。芦丁是苦荞中的主要酚类物质[25-26],其可作用于DNA拓扑异构酶Ⅱ,具有治疗白血病、抗感染、抗氧化、抗肿瘤、保护细胞、神经和心血管等多种药理活性[27-28]。表儿茶素(又名L-表儿茶素,(-)-表儿茶素和L-儿茶素)和儿茶素(又名儿茶酸、儿茶精)是异构体[29],属于黄烷醇类化合物,具有抗糖尿病活性、抗高血脂症、预防心血管疾病和代谢紊乱的功能[30-31]。上述结果表明大部分苦荞活性物质可在治疗抗动脉硬化和血管炎等血管疾病中发挥重要作用。因此,推测苦荞中的大部分活性黄酮类物质在预防、治疗心血管疾病方面具有一定优势。此外,表儿茶素作为苦荞中含量较多的化学物质,还能作用于雌激素受体预防治疗女性高发的乳腺癌,以及绝经期妇女综合征。
中草药成分发挥药理作用需达到特定的剂量,因此对中草药中的活性成分开展准确的定量研究有一定必要性。本研究证实,基于UPLC-QqQ-MS/MS的多离子反应监测(multiple reaction monitoring,MRM)是一种高效的定性、定量分析黄酮的方法,未来可进一步结合非靶向的定性鉴定优势和三重四级杆的定量优势,开发更多的植物黄酮定性和定量分析方法,为后续药物开发奠定基础。
4 结论
单因素试验结果表明,当乙醇浓度为90%、超声功率为140 W、超声温度为70 ℃、超声时间为60 min、乙醇溶液与苦荞原料比为50∶1(mL·g-1)时,超声提取苦荞黄酮的提取率最高。本研究采用UPLC-QTOF-MS共鉴定到16种黄酮物质,采用UPLC-QqQ-MS/MS定量分析发现苦荞黄酮提取物中的主要成分为芦丁、表儿茶素和儿茶素,含量分别为115.81、72.99和23.08 μg·mL-1。经TCMSP网络分析,已鉴定到的黄酮化合物中,大部分物质都具有潜在的抗癌、防治心血管疾病等药用功效。
