白术、酸枣仁提取物对金黄色葡萄球菌的抑菌效果研究
2024-04-08吴科惠吕曼婷龚海洲张亚南王攀林李向臣
■ 吴科惠 吕曼婷 刘 锋 龚海洲 张亚南 王攀林 李向臣 宋 丹
(浙江农林大学动物科技学院·动物医学院,浙江省畜禽绿色生态健康养殖应用技术研究重点实验室,浙江杭州 311300)
金黄色葡萄球菌是常见的病原体之一,广泛分布于自然界,由于其侵袭性、多药耐药性和毒力,导致动物发生多种严重的炎性疾病[1]。例如,金黄色葡萄球菌在奶牛乳房内感染导致乳腺炎[2],禽类感染可引发关节炎、急性败血症且能诱发鸡痘、马利克氏病等其他禽类疾病[3],兔感染金黄色葡萄球菌可引起皮肤脓肿、乳腺炎和败血症等[4]。此外,因不当处理和随后在高温下储存而摄入被金黄色葡萄球菌污染的食物之后,会发生葡萄球菌食物中毒,且动物在随着药物治疗的过程中细菌会逐渐产生耐药性[5]。传统抗生素的滥用造成了包括耐药性在内的一系列健康问题,威胁着人类健康,其对多种抗生素耐药性的出现促使了新型抗菌药物的开发[6]。
药用植物是天然抗生素的潜在来源之一,可以产生多种抗菌化合物,以响应微生物激发子[5]。尽管它们的抗菌活性通常比普通抗生素弱,但随着传统抗生素的滥用变得具有挑战性,近年来植物作为强抗菌剂的可行来源在制药、食品和动物饲料行业发挥了关键作用。许多研究发现植物提取物,如酚类和类黄酮类显示出良好的抗菌活性。白术是菊科植物白术的干燥根,主要生长在中国的浙江、江苏、江西、湖南和安徽等省[7]。研究表明,白术含有多种生物活性成分,包括类固醇、多糖、三萜、倍半萜和其他化学物质,表现出抑菌、抗炎、抗氧化、免疫调节等多种生物活性[8]。酸枣仁是酸枣科酸枣的干燥种子,是一种著名的中药材,具有很高的食用和药用价值[9]。含有丰富的植物化学物质,其主要成分包括皂苷、黄酮类化合物和脂肪酸等,具有抗炎、抗氧化等作用[10-11]。本研究的目的是研究白术、酸枣仁提取物单独以及联合作用对金黄色葡萄球菌的抑菌活性,为在抑制金黄色葡萄球菌药物研发方面补充理论数据,以期实现利用天然中草药改善抗生素滥用所导致细菌耐药性的问题。
1 材料与方法
1.1 试验材料
金黄色葡萄球菌(ATCC6538)、胰蛋白胨大豆肉汤(TSB),购自青岛海博生物技术有限公司;白术、酸枣仁提取物,购自兰州沃特莱斯生物科技有限公司;琼脂粉、考马斯亮蓝试剂,购自武汉赛维尔生物科技有限公司;碱性磷酸酶(AKP)试剂盒、乳酸脱氢酶(LDH)试剂盒,购自南京建成生物工程研究所有限公司;SDS-PAGE 凝胶制备试剂盒,购自康为世纪生物科技股份有限公司;结晶紫染色剂,购自上海生物工程有限公司。
1.2 主要仪器
BSA 分析天平(BSA124S),购自赛多利斯(上海)贸易有限公司;垂直层流洁净工作台(HCB-1300V),购自上海勇诺生物科技有限公司;智能生化培养箱(SPX-150),购自宁波海曙赛福实验仪器厂;电热鼓风干燥箱(101-3 型),购自上海锦屏仪器仪表有限公司;ZEALWAY 高压灭菌器(GI54D),购自上海甄明科学仪器有限公司;恒温振荡器(HZ-9211K),购自太仓市科教器材厂;酶标仪,购自伯乐生命医学产品(上海)有限公司;超声波细胞粉碎机(KS-450F),购自宁波海曙科生超声设备有限公司。
1.3 试验方法
1.3.1 培养基配制
准确称取TSB 固体6 g,用ddH2O 定容至200 mL,高压灭菌锅121 ℃灭菌30 min,得液体培养基,备用。准确称取TSB 固体3 g,琼脂1.5 g,用ddH2O 定容至100 mL,高压灭菌锅121 ℃灭菌30 min,得固体培养基,备用。
1.3.2 药物配制
分别准确称取3.2 g 白术提取物、3.2 g 酸枣仁提取物及两种药物各3.2 g 的混合药物,定容至40 mL,配制浓度为80 mg/mL原药液。取320 µL原药液加入680 µL 无菌水,配制浓度为25.6 mg/mL 的待用药物1 mL,保存,备用。
1.3.3 细菌培养于垂直层流洁净工作台取出保存菌液,用生理盐水稀释,使用涂布器均匀涂抹100 µL 菌液于TSB 固体培养基上,置于37 ℃恒温培养箱中培养12 h,使用接种针挑选单菌落接种于TSB 液体培养基中,37 ℃振荡培养16 h 制备菌悬液,调整细菌浓度为1×105CFU/mL(菌液浓度约为1×108CFU/mL时,OD630值为0.08~0.10)。
1.3.4 亚抑菌浓度测定和抑制率
取无菌96孔板,采用微量二倍稀释法,即在96孔板第1~11 列各加入100 µL TSB 液体培养基,再在第1 列加入100 µL 待用药物(步骤1.3.2),吹打5~6 次使药物与培养基充分混匀后吸取100 µL加入第2列,继续吹打混匀,依此类推稀释药液至第10列,第10列混匀后弃去100 µL,保持第1~11列各孔液体体积相等,再向1~11 列加入100 µL 待用菌液(步骤1.3.3),此时可得药物浓度为6.4、3.2、1.6、0.8、0.4、0.2、0.1、0.05、0.025、0.012 5、0 mg/mL 菌悬液。第1~10 列为试验组,第11 列为阴性对照组,每组设置3 个重复。为排除药物及培养基颜色对试验结果影响,对每种药物设置2 个不含菌的空白对照组。放入培养箱培养16 h后肉眼观察菌的生长情况,使用酶标仪测定OD630值。
金黄色葡萄球菌OD630值=试验组OD630值-空白对照组OD630值
抑制率(%)=(阴性对照OD630值-金黄色葡萄球菌OD630值)/阴性对照OD630值×100
1.3.5 白术、酸枣仁提取物对金黄色葡萄球菌细胞膜完整性的影响
将金黄色葡萄球菌(1×105CFU/mL)加入到药物浓度分别为0.4 mg/mL 白术提取物、0.4 mg/mL 酸枣仁提取物和0.1 mg/mL 二者联合药物的培养基中,并设置不含药的对照组,37 ℃培养16 h。以5 000 r/min转速离心菌悬液10 min,取上清稀释10 倍后在96 孔板中每孔加入200 µL,酶标仪检测OD260和OD280值。每组药物设置5个复孔,试验至少重复3次。
1.3.6 白术、酸枣仁提取物对菌体总蛋白含量的影响
将金黄色葡萄球菌(1×105CFU/mL)加入到药物浓度分别为0.4 mg/mL 白术提取物、0.4 mg/mL 酸枣仁提取物和0.1 mg/mL 二者联合药物的培养基中,37 ℃培养16 h。以5 000 r/min 转速离心10 min,弃上清液,留沉淀,加入500 µL无菌水吹打混匀,使用超声波细胞粉碎机使细菌中的蛋白质裂解出来,3 000 r/min离心10 min,取150 µL 上清液加入50 µL 4×Loading buffer 混匀。按照SDS-PAGE 凝胶制备试剂盒说明书配制好8%的SDS-PAGE 凝胶,在凝胶中加样后进行电泳(80 V/20 min、130 V/45 min),按照考马斯亮蓝说明书进行染色处理,脱色剂脱色后拍照。
1.3.7 白术、酸枣仁提取物对金黄色葡萄球菌生物膜形成的影响
取1 µL 金黄色葡萄球菌(1×105CFU/mL)加入到药物浓度分别为0.4 mg/mL 白术提取物、0.4 mg/mL 酸枣仁提取物和0.1 mg/mL 二者联合药物的培养基中,充分混匀后加样至96 孔板,每孔200 µL,每组设置5 个复孔,37 ℃振荡培养12 h。吸出培养液,使用ddH2O 清洗2 次,加入100 µL 甲醇处理15 min,弃去甲醇,室温干燥5 min,加入100 µL 0.1%结晶紫染色液染色5 min,ddH2O 洗去多余染料,倒置96孔板于烘箱中烘干水分。每孔加入200 µL 33%冰醋酸,37 ℃恒温箱作用30 min使结晶紫充分溶解,使用酶标仪于590 nm处测定吸光值。
1.3.8 白术、酸枣仁提取物对菌体LDH的影响
将金黄色葡萄球菌(1×105CFU/mL)加入到药物浓度分别为0.4 mg/mL 白术提取物、0.4 mg/mL 酸枣仁提取物和0.1 mg/mL 二者联合药物的培养基中,并设置不含药的对照组,37 ℃培养16 h。取1.5 mL菌悬液于离心管,以5 000 r/min 转速离心菌悬液10 min,弃上清液,留沉淀,加入1 mL 无菌水吹打混匀,利用超声波细胞粉碎机使细菌中的LDH 裂解出来,5 000 r/min 离心10 min,取上清液备用。按照LDH 试剂盒说明书配制好所需样品并于96 孔板加样,使用酶标仪测定OD450值以检测LDH 活力,每组试验至少重复3 次。
1.3.9 白术、酸枣仁提取物对菌液上清AKP的影响
将金黄色葡萄球菌(1×105CFU/mL)加入到药物浓度分别为0.4 mg/mL 白术提取物、0.4 mg/mL 酸枣仁提取物和0.1 mg/mL 二者联合药物的培养基中,并设置不含药的对照组,37 ℃恒温培养16 h。取1.5 mL菌悬液于离心管,以5 000 r/min 转速离心10 min,取上清液按照AKP测试盒说明书配置样品并检测,使用酶标仪于520 nm 处测定吸光度,计算AKP 活力,每组试验至少重复3次。
1.4 统计分析
应用Excel 软件初步整合所得数据,应用Graphpad prism 7.00软件对数据进行方差分析和作图。
2 结果与分析
2.1 白术、酸枣仁提取物的亚抑菌浓度测定
由图1(A)~图1(C)可知,酸枣仁、白术提取物单独和二者联合作用均对金葡萄球菌有抑制作用,其亚抑菌浓度分别为0.4、0.4、0.1 mg/mL;抑制率分别为16.84%、17.90%和22.87%[图1(D)~图1(F)],表明白术和酸枣仁提取物联合作用抑菌效果显著强于单独使用(P<0.05)。

图1 酸枣仁、白术提取物对金黄色葡萄球菌生长的影响及抑制率
2.2 白术、酸枣仁提取物对金黄色葡萄球菌上清核酸和蛋白质含量的影响
由图2 可知,与对照组相比,白术、酸枣仁提取物单独和联合处理组的OD260、OD280值均显著上升(P<0.05);与白术、酸枣仁提取物单独处理组相比,二者联合处理组的OD260、OD280值显著上升(P<0.05),表明二者单独和联合处理均能破坏细菌细胞膜,显著增加菌液上清中核酸和蛋白质含量,且联合作用对金黄色葡萄球菌细胞膜的破坏能力显著强于单独使用。
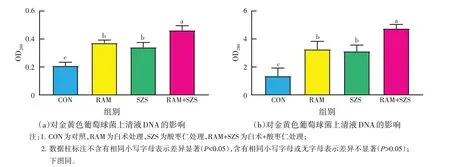
图2 白术、酸枣仁提取物对金黄色葡萄球菌上清DNA和蛋白质含量的影响
2.3 白术、酸枣仁提取物对金黄色葡萄球菌菌体总蛋白含量的影响
由图3 可知,与对照组相比,白术、酸枣仁提取物单独和联合处理组的总蛋白含量显著减少,联合处理组总蛋白含量较单独处理组显著减少,表明二者单独和联合作用均能破坏细胞膜,使得细胞内蛋白质外泄,且联合作用对细胞膜的破坏作用显著强于单独作用。
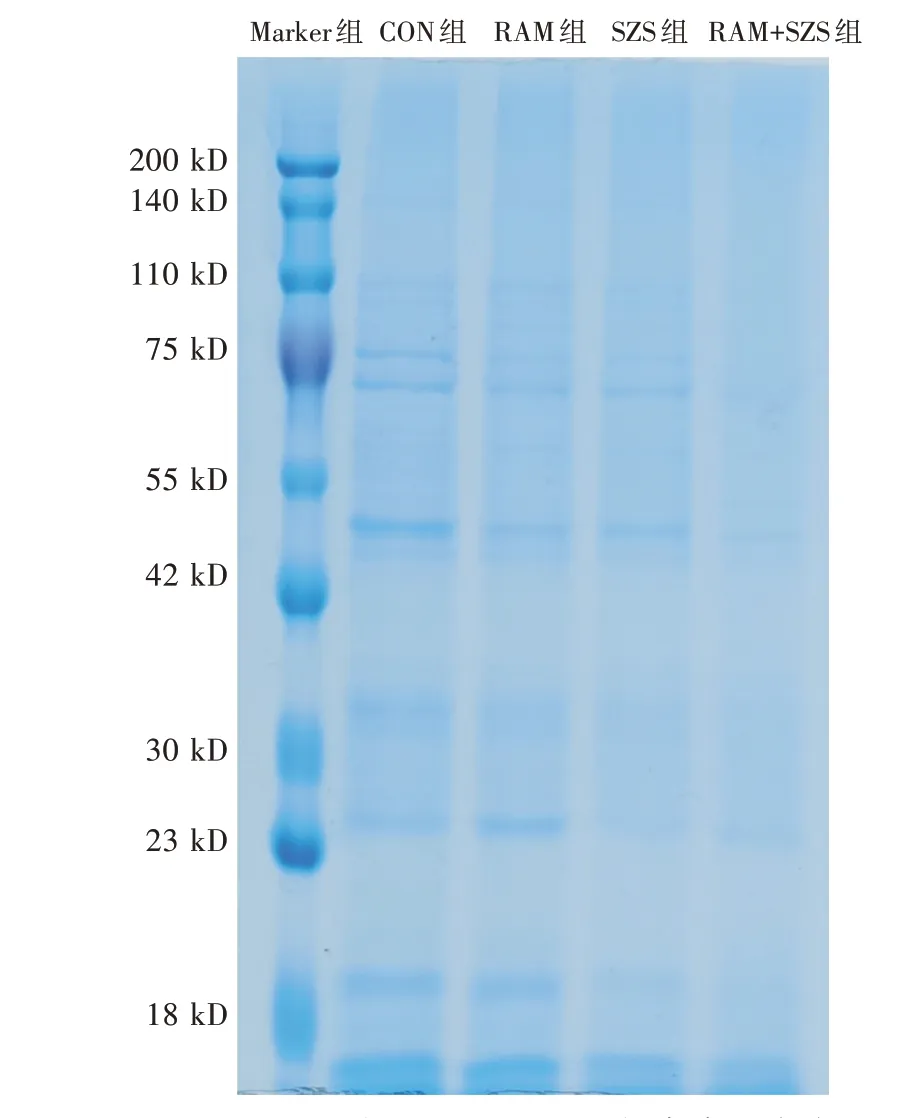
图3 白术、酸枣仁提取物金黄色葡萄球菌菌体总蛋白含量的影响
2.4 白术、酸枣仁提取物对金黄色葡萄球菌生物膜形成的影响
如图4 可知,与对照组相比,白术、酸枣仁提取物单独和联合处理组的OD590值均显著降低(P<0.05);与白术、酸枣仁提取物单独处理组相比,二者联合处理组的OD590值显著降低(P<0.05),表明二者单独和联合作用均能显著抑制金黄色葡萄球菌的生物膜形成,且联合作用对生物膜形成的抑制作用显著强于单独作用。
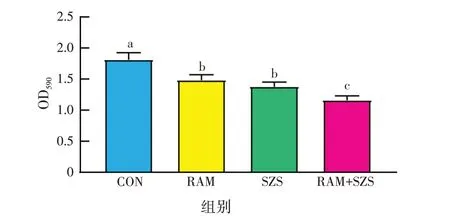
图4 白术、酸枣仁提取物对金黄色葡萄球菌生物膜形成的影响
2.5 白术、酸枣仁提取物金黄色葡萄球菌菌体LDH活力的影响
由图5 可知,与对照组相比,白术、酸枣仁提取物单独和联合处理组的LDH活力显著降低(P<0.05);与白术、酸枣仁提取物单独处理组相比,二者联合处理组的LDH活力显著降低(P<0.05),表明二者单独和联合作用均能破坏金黄色葡萄球菌细胞膜,促进菌体内LDH释放,且联合作用对细胞膜的破坏作用显著强于单独作用。
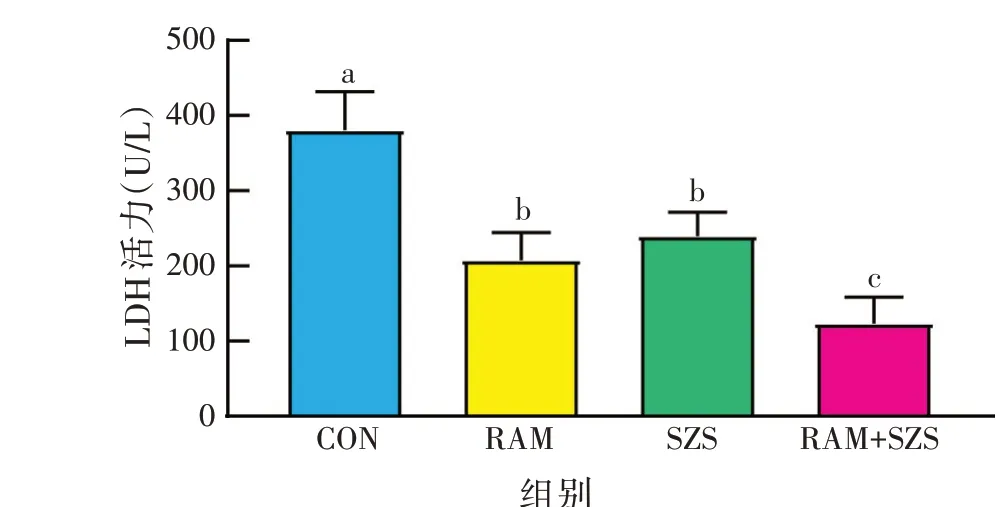
图5 白术、酸枣仁提取物金黄色葡萄球菌菌体LDH活力的影响
2.6 白术、酸枣仁提取物对金黄色葡萄球菌菌液上清AKP活力的影响
由图6 可知,与对照组相比,白术、酸枣仁提取物单独和联合处理组的AKP活力显著增强(P<0.05);与白术、酸枣仁提取物单独处理组相比,二者联合处理组的AKP活力显著增强(P<0.05),表明二者单独和联合作用均能破坏金黄色葡萄球菌细胞壁,引起菌体内AKP渗漏,且联合作用对细胞壁的破坏作用显著强于单独作用。
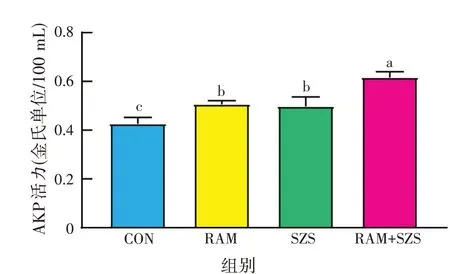
图6 白术、酸枣仁提取物金黄色葡萄球菌菌液上清AKP活力的影响
3 讨论
金黄色葡萄球菌广泛存在于自然界,可随食物链传递,极大影响动物机体健康、动物制品品质和畜牧业的经济发展。目前主要采用抗生素抑制金黄色葡萄球菌,但长期使用抗生素会导致细菌耐药性增强。世界卫生组织已将细菌耐药性列为一个主要的公共卫生问题,并呼吁采取联合行动来控制[12]。随着抗生素的不合理使用,包括超级细菌在内的耐多药细菌逐渐发展,数量不断增加,对环境和食物造成一定程度的污染[13]。因此,有必要寻找有效、简便的方法来抵御耐药。中药及其成分被认为是新型抗菌药物筛选和开发的重要来源。
白术、酸枣仁均为天然植物中药,抗氧化性强,其提取物中含有各种活性物质,对耐药细菌具有直接抗菌作用。例如白术中含有黄酮,白术黄酮对金黄色葡萄球菌、大肠杆菌和枯草芽孢杆菌均有较强的抑菌活性[14]。白术多酚能抑制金黄色葡萄球菌、大肠杆菌、绿脓杆菌和枯草芽孢杆菌活性[15]。白术挥发油可以显著抑制包括金黄色葡萄球菌在内的多种细菌活性[16]。酸枣仁提取物中含有黄酮、皂苷、挥发油等成分,具有增强免疫力的功效,且其中的皂苷能防治家禽大肠杆菌病[17]。本研究结果显示,0.4 mg/mL 白术、酸枣仁提取物单独作用和0.1 mg/mL白术和酸枣仁提取物联合作用均对金黄色葡萄球菌生长产生显著的抑制作用,且联合作用对金黄色葡萄球菌的抑制效果显著强于单独作用。
细菌个体由细胞壁、细胞膜、细胞质和核小体组成,其中细胞膜是细菌与外界进行物质和能量交换的重要媒介。当致病菌的细胞膜通透性被破坏时,细菌中的核酸、蛋白质等大分子物质会泄露到培养基中,金黄色葡萄球菌培养基上清中核酸、蛋白质含量可以间接反映细菌细胞膜的通透性[18]。本研究检测了菌液上清中核酸渗漏OD 值(OD260)和蛋白质渗漏OD 值(OD280),结果发现,白术、酸枣仁提取物单独和联合作用后OD260、OD280数值明显增加,说明金黄色葡萄球菌细胞膜被破坏,导致细胞内核酸和蛋白质渗漏到培养基中。检测菌体总蛋白含量显示,二者单独和联合作用均有效减少金黄色葡萄球菌菌体总蛋白含量。同时,本研究还测定了白术和酸枣仁提取物对菌体LDH含量的影响。LDH存在于细胞膜内部,通过检测LDH 活力可以衡量细菌细胞膜通透性变化[19]。试验结果显示,二者单独和联合处理组的菌体LDH 含量均显著低于对照组,联合处理组菌体LDH 含量显著低于单独处理组,表明LDH 渗漏到了细胞外。生物膜是细菌处于不利于自身生长增殖的环境时所形成的自我保护机制产物[20],生物膜可降低抗菌药物如抗生素等对细菌的渗透度,从而降低药物的杀菌效果[21],保护细菌免受抗生素伤害[22]。结晶紫染色结果显示,白术、酸枣仁提取物单独和联合作用对金黄色葡萄球菌生物膜的形成均具有抑制作用。这些结果充分证实了白术和酸枣仁提取物对金黄色葡萄球菌细胞膜的破坏作用,且联合作用对细胞膜的破坏效果显著强于单独处理。
AKP 是一种存在于细胞壁之间的酶。正常情况下,在细胞壁外检测不到AKP 活力,但当细胞壁受损时,在细胞壁外可以检测到AKP,而且AKP 的活力也会升高[23]。本研究结果显示,白术和酸枣仁提取物单独和联合处理组的菌液上清液中AKP 含量显著高于对照组,说明二者都可以破坏细胞壁,增加细菌细胞壁的通透性,且联合作用效果显著强于单独作用。
本研究首次证实了白术和酸枣仁提取物对金黄色葡萄球菌具有显著的抑菌效果,说明白术和酸枣仁提取物是两种作用效果广泛地控制金黄色葡萄球菌感染的天然化合物,且二者联合作用的抑制效果显著强于单独作用。本研究为进一步阐明白术和酸枣仁提取物单独和联合作用对抗致病菌的分子机制提供了基础参考。
4 结论
本研究结果表明,白术、酸枣仁提取物单独和联合作用均可有效破坏金黄色葡萄球菌细胞壁和细胞膜,抑制生物膜的形成,增强菌液上清核酸、蛋白质含量以及AKP 活力,降低菌体LDH 活力和减少细菌蛋白总含量,且二者联合作用的抑菌效果显著强于单独作用。
