微生物代谢产物调控胃肠道发育的机制
2024-04-08王佳堃郭津晶
■ 王佳堃 郭津晶
(浙江大学奶业科学研究所,浙江杭州 310058)
动物胃肠道中栖息着密集而动态、复杂且多样的微生物群落,这些微生物在宿主新陈代谢、生理免疫和发育过程中扮演着重要角色[1]。微生物影响宿主生理的方式主要是通过产生初级代谢产物和次级代谢产物来调节,包括挥发性脂肪酸(volatile fatty acid,VFA)、色氨酸代谢物、脂类和生物胺等,这些代谢产物可作为信号分子参与微生物与宿主的对话,通过激活或抑制不同的信号途经调控机体的各项功能[2]。因此,通过深入了解胃肠道微生物及代谢产物的组成,明确微生物代谢产物调控生理功能的作用机制,有利于人们采用相应技术手段促进胃肠道健康发育,提高动物生产性能。
1 挥发性脂肪酸
VFA 是胃肠道中膳食纤维经厌氧发酵产生的主要代谢产物。胃肠道中主要的VFA为乙酸、丙酸和丁酸,占所有挥发性脂肪酸的95%以上[3],反刍动物瘤胃或其他动物大肠中的乙酸、丙酸和丁酸产量比例在75∶15∶10 至40∶40∶20 之间变化[4]。VFA 在动物体内最基本的作用是供能,VFA 可满足反刍动物70%的能量需求[5]。同时,VFA 作为信号分子激活G 蛋白偶联受体(G-protein-coupled receptors,GPCRs),进一步激活下游信号级联反应以响应兴奋性变化。此外,VFA 作为组蛋白去乙酰化酶(histone deacetylase,HDAC)的抑制剂影响宿主基因的表达(见图1)[2,6];作为芳香烃受体(aryl hydrocarbon receptor,AHR)的配体激活白细胞介素-1(IL-1)等下游途径。

图1 VFA胞内信号通路[6]
1.1 GPCRs的激活
GPCRs 是一类跨膜受体蛋白,受到外界刺激后,不同类型的GPCRs与细胞外各种配体结合,导致G蛋白活化。G 蛋白再激活下游效应器,释放环磷酸腺苷(cyclic adenosine monophosphate,cAMP)、钙离子等细胞内第二信使,从而将信号逐渐传递下去,使细胞响应各类刺激产生不同的兴奋性变化。VFA敏感的GPCRs又称为游离脂肪酸受体(free fatty acid receptors,FFARs),主要包括GPR41(FFAR3)、GPR42、GPR43(FFAR2)、GPR109a(HCAR2)、GPR164(OR51E2)。乙酸盐、丙酸盐和丁酸盐激活GPR41 和GPR43,丁酸盐特异性激活GPR109a[7]。GPR41 和GPR43 是目前研究最为广泛的FFARs。两者在各个组织中均有表达,但表达量不同。GPR41在脂肪细胞中的表达量最高,GPR43 在免疫细胞中的表达量最高[8]。在胃肠道细胞中,GPR41 和GPR43 主要在肠内分泌细胞(enteroendocrine cell,EECs)、结肠上皮细胞和小肠上皮细胞中表达[9-10],GPR41 在瘤胃上皮细胞中的表达量高于GPR43[11]。
GPR41、GPR43 和GPR109a 被VFA 激活后与Gi/0或Gq偶联[8],抑制cAMP 积累,并活化磷脂酶C(phospholipase C,PLC)、核因子κB(nuclear factor kappa-B,NF-κB)和有丝分裂原活化蛋白激酶(mitogenactivated protein kinase,MAPK)等[6]。cAMP 激活蛋白激酶A(protein kinase A,PKA),通过cAMP 反应元件结合蛋白(cAMP-response element binding protein,CREB)进一步调节转录因子的表达[12]。此外,GPR41和GPR43 还与肌醇1,4,5-三磷酸受体(inositol-1,4,5-triphosphate receptor,IP3R)的形成有关,从而刺激内质网释放胞内Ca2+[13]。
FFARs 激活的下游信号对胃肠道的分泌、运动、免疫和吸收代谢等功能以及胃肠道的形态发育起着重要的调控作用。GPR43 激活引起的胞内钙离子浓度升高会刺激EECs 分泌胰高血糖素样肽1(Glucagon-like peptides,GLP-1)和酪酪肽(Peptide YY,PYY)等激素,但GPR41 参与GLP-1 分泌的机制尚不清楚[10]。GLP-1和PYY能够抑制胃肠道蠕动,延长转运时间,进一步促进营养物质的吸收[14-17]。NF-κB参与肿瘤坏死因子-α(TNF-α)和白细胞介素-2(IL-2)等炎症相关因子的转录,与胃肠道的免疫功能密切相关,靶向调控NF-κB 信号通路有利于开发针对炎症性肠病和溃疡性结肠炎的药物[18]。PKA 可以磷酸化钙调素依赖性蛋白激酶激酶2(calmodulindependent protein Kinase Kinase-2,CaMKK2)[19],在能量平衡、胰岛素信号传递及全身代谢中发挥重要作用[20]。PKA 的靶点CREB 通过调控细胞周期蛋白D1等基因的表达以及ERK1/2 和PI3K-AKT 等信号通路的激活来调控胃肠道细胞的增殖[21]。最近一项研究表明,VFA 调节牛瘤胃上皮细胞的增殖和发育可能是通过GPR41 介导PIK3-AKT-mTOR 信号通路实现[22]。外源性补充丁酸盐不仅显著影响绵羊瘤胃结构(瘤胃组织重量以及上皮厚度增加)和功能(消化酶活性提高),还能刺激GPR43 的表达以增加小肠上皮绝对长度[23]。
1.2 HDAC的抑制
染色质的基本亚基核小体由DNA 和组蛋白八聚体形成,组蛋白乙酰化转移酶(histone acetyltransferase,HAT)有利于核小体的解离,从而使各种转录因子和协同转录因子与DNA 结合位点特异性结合,组蛋白去乙酰化酶(histone deacetylase,HDAC)则发挥相反的作用(见图2)。因此,促进HAT 或抑制HDAC的方式有利于提高转录活性,从而调控基因的表达、细胞增殖、免疫等各项生物过程。HAT 根据不同的底物识别和胞内定位分为两种类型,A 型HAT 在细胞核中使核小体组蛋白乙酰化,B 型HAT 主要在细胞质中负责新合成组蛋白的乙酰化[24]。HDAC 也分为两个类型,Ⅰ类HDACs(HDAC1/HDAC2/HDAC3/HDAC8)在大多数细胞中均有表达,与转录调控关系密切。Ⅱ类HDACs(HDAC4/HDAC5/HDAC6/HDAC7/HDAC9/HDAC10)具有较低的酶活性,其在细胞中的功能(参与细胞分化和发育过程等)可能与脱乙酰无关[25-26]。在调控细胞周期进程中,HDAC1 和HDAC2之间存在互补机制,HDAC1 和HDAC2 的缺失会导致细胞周期停滞于G1 期[27],然而过表达HDAC1 则会使G2 期延长[28]。敲低HDAC3 能够增加细胞周期蛋白A的乙酰化,从而影响细胞周期进程,尤其是S 期与G2/M期的转变[29]。
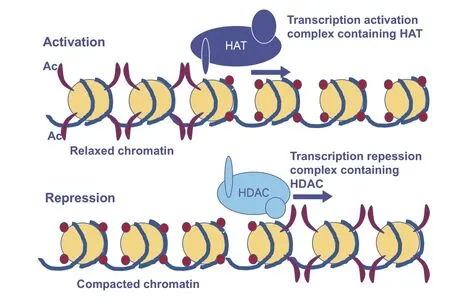
图2 染色质的转录抑制和激活
VFA 可以通过促进HAT 或抑制HDAC 活性的方式来影响基因的调控。丁酸被代谢成乙酰辅酶A 刺激HAT 活性,上调细胞增殖相关基因的表达从而促进结肠细胞增殖[30]。然而VFA 主要是作为HDAC 抑制剂发挥作用,其中丁酸的抑制作用最强,丙酸次之[31]。丙酸和丁酸通过抑制HDAC 活性的方式显著增加了EECs 中PYY 的表达,且表达量高于GPR43 激活后增加的PYY 表达[32]。PYY 在VFA 调节的激素依赖性肠道运动中发挥重要作用,除了激素,VFA(主要是丁酸)还能通过调节肠神经元来影响肠道运动[33],丁酸抑制HDAC 增加阳性神经元数量,并增加乙酰胆碱从而提高肠道动力[34]。VFA 抑制HDAC 在肠道免疫上发挥了更为广泛的作用。丁酸盐通过抑制HDAC 诱导肠道上皮细胞系和结肠细胞突触足蛋白的表达以维持肠道屏障,突触足蛋白对肠上皮紧密连接及细胞迁移至关重要,微生物耗竭抑制的突触足蛋白表达可以通过补充丁酸盐来恢复[35]。丁酸盐通过抑制HDAC3 诱导肠道上皮细胞的醛脱氢酶ALDH1A1 和ALDH1A3 的转录表达,从而刺激视黄醇转化成视黄酸促进肠黏膜稳态,但这种效果并不被GPR43 和GPR109A 激动剂所重现,这表明抑制HDAC3 可能是丁酸盐刺激产生视黄酸促进肠道免疫的独特途径[36]。丁酸盐对HDAC 的抑制,下调肠道巨噬细胞脂多糖诱导的促炎介质(NO、IL-6 和IL-12),而这与GPCRs 的激活无关[37]。丁酸盐和丙酸盐通过抑制HDAC促进Foxp3的转录并增加肠道抗炎Treg细胞的生成,从而介导共生微生物群与免疫系统的交流[38]。总之,VFA 抑制HDAC 途径一方面可以通过调节促炎因子和抗炎因子的表达,一方面可以影响肠道免疫细胞的数量,最终影响促炎和抗炎机制之间的平衡。除了免疫细胞,梭状芽孢杆菌产生的丁酸通过抑制HDAC,促进肠道上皮细胞的增殖,降低Bak1 和Bax 促凋亡蛋白的表达,提高了抗凋亡蛋白Bcl2l10和顶端连接蛋白的表达,从而维持上皮屏障[39]。然而,高浓度丁酸则会通过抑制HDAC 从而促进Foxo3的表达,Foxo3 与Cdkn1a、Cdkn1c 和Gadd45b 的启动子区域结合从而阻滞细胞周期进程,使得结肠干细胞的增殖受到抑制[40]。HDAC 抑制除了通过调控基因的表达来直接影响生理功能,还能形成复合物编码钙通道蛋白(CACNA1h 和CACNA2d2)的表达从而影响钙依赖性生理活动[41],然而该路径在胃肠道上的报道还有待探究。
1.3 其他
微生物来源的VFA 还可以通过其乙酰化酶特性促进结肠中的组蛋白巴豆酰化调控细胞周期[42]。组蛋白巴豆酰化于2011 年被首次发现,是指在组蛋白的氨基酸残基上引入巴豆酰基团,巴豆酰辅酶A 是其主要供体[43]。丁酸通过巴豆酰辅酶A 促进巴豆酰化从而促进基因转录,比组蛋白乙酰化的促转录效果更为直接[44]。Toll 样受体(Toll-like receptors,TLR)是参与非特异性免疫的重要蛋白分子,丁酸盐能够增加EECs 中TLR 的表达,提高NF-κB 活性并促进PYY 的分泌,在免疫反应中发挥作用[45]。输注外源性丁酸盐导致的TLR2、TLR5 上调会改变瘤胃菌群结构,其中产丁酸菌的丰度与TLR5 的表达高度相关[46]。此外,VFA 还可以通过促进AHR,上调IL-1 以维持肠道稳态[47]。丁酸盐和丙酸盐以剂量依赖性方式激活肠上皮细胞的AHR,丁酸盐直接作为AHR 配体上调AHR依赖性基因表达,进而激活AHR 路径,且该路径与GPCRs激活和HDAC抑制的作用无关[48]。
2 色氨酸代谢物
色氨酸是动物体内无法自身合成、依赖外源性摄入的一种必需氨基酸,主要通过犬尿氨酸途径、血清素途径和吲哚途径代谢(见图3)[49]。这3 条代谢途径直接或间接受到胃肠道微生物的调控或反过来影响胃肠道微生物群落的增殖,且3 条代谢途径之间有着紧密而复杂的联系。色氨酸代谢物作为微生物与宿主之间的交流桥梁,对胃肠道的稳态与健康起着重要作用。

图3 肠道微生物调控色氨酸代谢[49]
2.1 犬尿氨酸途径
抗生素介导的肠道微生物耗竭会引起色氨酸含量升高,犬尿氨酸含量下降,表明胃肠道微生物会通过犬尿氨酸途径介导色氨酸的降解[50]。犬尿氨酸途径是一系列的酶促反应,由TDO、IDO1 和IDO2 三种酶对色氨酸执行限速与降解。其中IDO1 在肠道中高表达[51]且与肠道微生物丰度正相关[52]。IDO1 的表达会促进肠上皮细胞的分化并增强黏液屏障促进肠道稳态[53]。IDO1 的缺失则会使促炎介质增加并减少Foxp3 调节性T 细胞数量从而加剧结肠炎[54]。其介导途径可能与TLR、AHR等受体的表达有关[55-56]。
2.2 血清素途径
血清素,又称为5-羟色胺(5-hydroxy tryptamin,5-HT),是一种重要的胃肠道信号分子。机体90%的5-HT 由专门的EECs 亚型肠嗜铬细胞合成与分泌,其释放受到化学物质、机械刺激、神经递质和其他肠道激素等的调控[57],在胃肠道动力、运输及免疫等方面起着重要作用。5-HT 的多效作用与其不同受体的激活相关,其中5-HT3和5-HT4受体在胃肠道中高表达,且与胃肠蠕动有关[58]。5-HT7的激活可能参与5-HT驱动结肠炎的恶化,但5-HT 又能通过作用于5-HT4发挥抗炎作用,并促进上皮细胞的增殖,对肠道上皮细胞屏障功能产生积极影响[59]。
肠道微生物群是肠道5-HT 产生的参与者,微生物介导的5-HT 在刺激胃肠蠕动和血小板功能上发挥了重要作用[60]。然而,其调节机制尚不完全清楚,有研究表明,肠道微生物通过VFA 刺激色氨酸羟化酶1 的转录促进5-HT 的产生[61]。同时,5-HT 又可以反过来影响肠道微生物的生理机能以及肠道上皮定植能力[62]。这表明5-HT 和胃肠道微生物之间存在互作。
2.3 吲哚途径
肠道微生物将色氨酸分解产生吲哚-3-醛、吲哚-3-乙酸、吲哚-3-丙酸等含有吲哚的代谢物。这些吲哚类代谢物是AHR 的有效激动剂,其效力远超其他途径对AHR 的激活[63]。AHR 激活后启动靶基因的转录从而调控众多生理和病理过程。吲哚类代谢物吲哚-3-醛激活AHR,促进IL-22的转录,有利于微生物群落存活,提高定植抗性,同时对肠道黏膜起到炎症保护作用[64];双歧杆菌分解色氨酸产生的吲哚-3-乳酸通过激活AHR 途径,减弱了TNF-α和脂多糖诱导的促炎因子IL-8 的表达,从而保护肠道上皮细胞[65];微生物来源的吲哚-3-丙酸以激活AHR 依赖的方式增加肠上皮细胞IL-10 受体的表达,促进肠道稳态[66]。除了AHR 激活途径,孕烯X 受体在吲哚-3-丙酸调节肠道屏障功能中也扮演着重要角色,同时TLR也参与其之间的化学通讯[67]。
吲哚可以作为微生物-宿主交流并影响宿主代谢的信号分子,一方面,吲哚可以阻断NADH 脱氢酶来减缓ATP 的产生,从而导致GLP-1 分泌减少;另一方面又可以通过抑制电压门控钾通道增强钙内流,诱导产生动作电位以刺激GLP-1 的分泌[68]。吲哚类代谢物引发的钙内流不仅影响着GLP-1的分泌,对于调节肠动力也起着重要作用。Waclawiková 等[69]发现,多种肠道细菌通过色氨酸酶将5-羟色氨酸代谢为5-羟基吲哚,通过激活结肠平滑肌细胞上的L 型钙通道增加钙内流,从而加速肠道收缩力。和其他色氨酸代谢产物一样,吲哚类也会影响微生物的生理,吲哚会影响细菌基因表达、运动性和毒力[70],艰难梭菌诱导吲哚影响肠道微生物的生长和重建等[71]。这表明,吲哚类既可以作为“微生物-宿主”的通讯工具,也能影响“微生物-微生物”之间的相互作用,其复杂的机制还可以进一步深入探讨。
3 其他代谢产物
3.1 生物胺类
生物胺类代谢产物包括单胺(色胺、组胺和酪胺等)和多胺(腐胺、精胺和亚精胺等),由微生物群分解不同的前体氨基酸产生(见图4),通过调节基因表达、信号转导、DNA 和蛋白质合成以及细胞凋亡等,参与调控胃肠道的运动、分泌和免疫等生理功能[72]。与前文提到的微生物代谢产物类似,生物胺类代谢产物也能通过激活相应受体来发挥作用,组胺与H1R、H2R、H3R 和H4R 这4 个GPCRs 结合从而激活不同的下游反应,其中H1R 激活后会引起胞内钙离子浓度瞬时增加,其介导的肠道平滑肌收缩可被L 型钙通道阻滞剂抑制[73];H2R 激活后能够促进胃酸分泌[74]。亚精胺可以通过TLR4 途径影响肠道屏障完整性和肠道微生物群功能[75]。除了受体激活途径,多胺还可以通过增强真核起始翻译因子的羟丁胺化修饰来调节结肠上皮细胞增殖和巨噬细胞分化,以促进胃肠道的发育[76]。此外,生物胺同样可以调节微生物的生理,精胺通过NspS-MbaA 多胺信号系统抑制霍乱弧菌生物膜形成[77],腐胺、尸胺和精胺等具有调节霍乱弧菌毒力的特性,防止其在小肠定植的保护功能[78]。
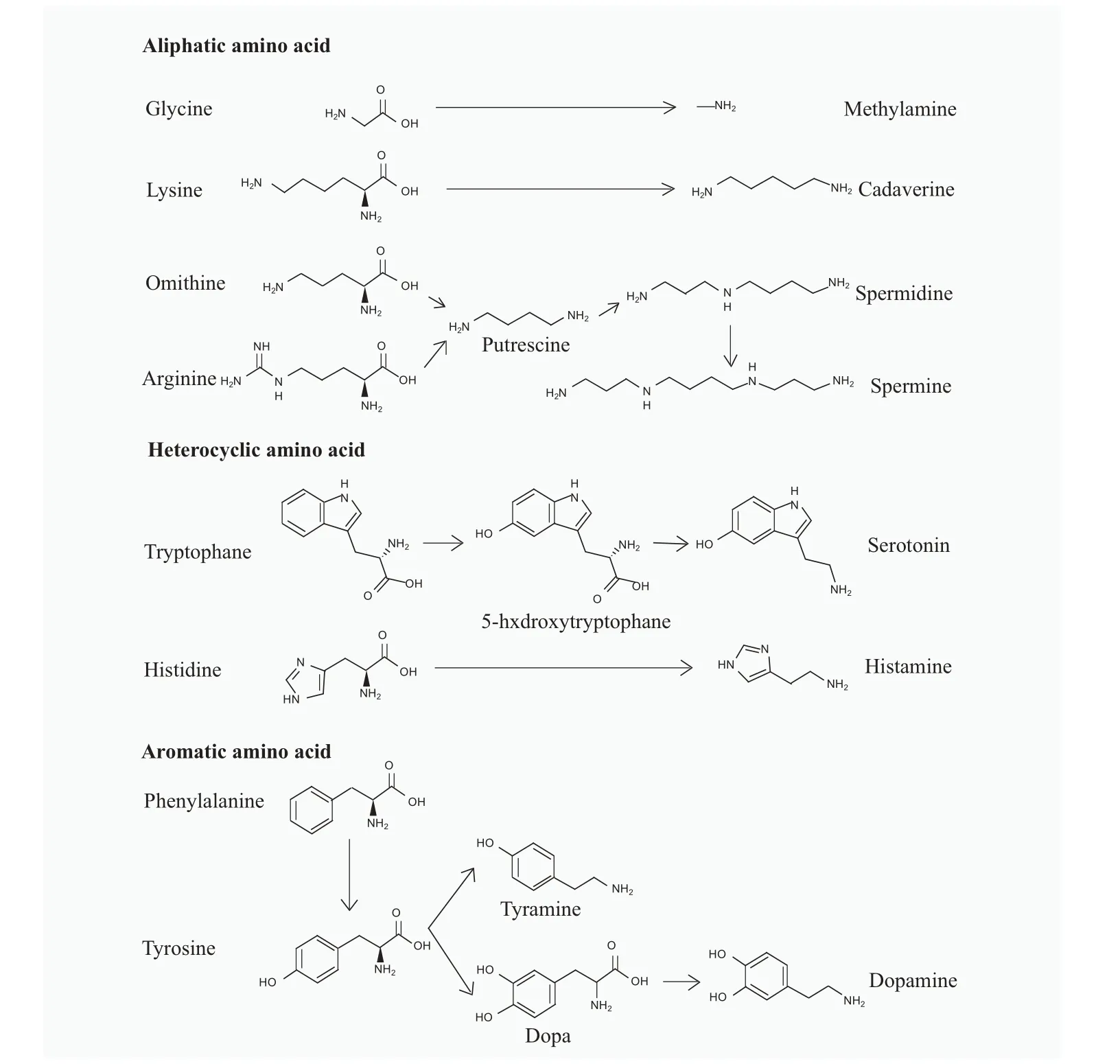
图4 从相关氨基酸衍生的生物胺[72]
3.2 次级胆汁酸
由肝脏产生的初级胆汁酸(胆酸和鹅去氧胆酸等)有约5%会流入肠道,在肠道微生物的作用下,分解代谢为次级胆汁酸(脱氧胆酸和石胆酸等)。次级胆汁酸通过激活G 蛋白偶联胆汁酸受体1(G proteincoupled bile acid receptor 1,GPBAR1/TGR5)和法尼醇X 受体(farnesoid X receptor,FXR)来传递宿主信号。脱氧胆酸和石胆酸通过激活TGR5促进了肠道类器官的生长,增加了YAP1及上游调节因子SRC的活化,促进肠上皮的再生[79]。微生物代谢物脱氧胆酸通过激活FXR 抑制前列腺素E2 合成所需酶,调节肠道黏膜屏障受损后的小肠隐窝的再生与修复[80]。次级胆汁酸还能通过激活TGR5 刺激5-羟色胺和降钙素基因相关肽的释放来调控胃肠道蠕动[81]。FXR 与胃肠道的微生物组成有着紧密关联,FXR 的激活可以防止细菌增殖,其下游基因产物Ang1、iNOS和Il18具有一定的抗菌作用[82]。研究表明,脱氧胆酸通过FXR 增加肠道拟杆菌门比例,降低厚壁菌门比例[83],表明次级胆汁酸可以重塑肠道微生物群的组成。
3.3 维生素及其代谢产物
动物机体所需的维生素主要从饲料中获取,但也有一部分可以通过胃肠道微生物代谢合成。维生素D 活性、储量和其代谢物血清25-羟基维生素D 水平与肠道微生物群(其中包括产生丁酸盐的细菌)多样性高度相关[84]。引入外源乳杆菌属益生菌可增加血清25-羟基维生素D 水平及维生素D 受体(Vitamin D Receptor,VDR)的表达[85-86]。血清25-羟基维生素D和VDR 在胃肠道免疫上发挥了重要作用,此外,VDR在胃肠道中高度表达,与跨细胞钙转运密切相关[87]。在反刍动物瘤胃中,普雷沃氏菌属、丁酸弧菌属、瘤胃梭菌属和拟杆菌属等微生物通过作用于相关依赖酶来影响B 族和K 族维生素的合成[88-90]。B 族和K 族维生素通过相关受体下游信号通路或依赖性蛋白等调节免疫和发育等功能,并影响肠道微生物组成和功能[91-92]。
4 小结
胃肠道微生物代谢产物通过各种途径调节宿主胃肠道细胞增殖及功能,是“微生物-宿主”沟通的桥梁。胃肠道微生物代谢产物与微生物群相互作用,对菌落平衡与胃肠道稳态有着重要作用。尽管大量研究明确胃肠道微生物代谢产物调控胃肠道发育,但鉴于其功能的广泛性以及作用机制的多样性与复杂性,仍有部分领域需要进一步深入。随着生态养殖模式的发展,将微生物代谢产物介导胃肠道健康发育的理论知识与生产实践相结合,对绿色养殖有着重要意义。
