绵羊支原体肺炎病原巢式PCR检测方法的建立与应用
2024-03-20杨华周华倩黄新齐宇余乾张文喆杨永林侯扶琴
杨华 周华倩 黄新 齐宇 余乾 张文喆 杨永林 侯扶琴

摘要 [目的]建立一种诊断绵羊支原体肺炎病原的巢式PCR方法,确定肺炎支原体感染的靶器官。[方法]根据GenBank网站上登录的绵羊支原体16S rRNA基因序列,设计并合成2对引物,以肺炎支原体菌株基因组DNA为模板,经过PCR反应条件的优化,通过测序验证扩增产物的正确性,建立了绵羊支原体肺炎病原的巢式PCR检测方法,进而应用建立的方法完成临床阳性病料肺脏、肺淋巴、心脏、肾脏、肝脏、脾脏、皮肤、小肠和外周血检测以及疑似样本肺脏组织的检测。[结果]建立的巢式PCR方法可扩增出864 bp的特异性目的片段,肺脏和肺淋巴为绵羊肺炎支原体感染的靶器官,临床样本巢式PCR检出率与支原体培养鉴定结果的符合率为100%。 [结论]建立的绵羊支原体肺炎病原巢式PCR检测方法可用于临床样本的实验室诊断。
关键词 绵羊肺炎支原体;巢式PCR;检测方法
中图分类号 S852.62 文献标识码 A 文章编号 0517-6611(2024)04-0074-04
doi:10.3969/j.issn.0517-6611.2024.04.015
开放科学(资源服务)标识码(OSID):
Establishment and Application of Nested PCR Detection Method of Pathogens of Mycoplasma ovipneumonia
YANG Hua1,2,ZHOU Hua.qian1,2,HUANG Xin1 et al
(1.State Key Laboratory of Sheep Genetic Improvement and Healthy Production, Xinjiang Academy of Agricultural and Reclamation Science, Shihezi, Xinjiang 832000;2.College of Animal Science and Technology, Shihezi University, Shihezi,Xinjiang 832000)
Abstract [Objective]In order to establish a nested polymerase chain reaction (PCR) for detecting the pathogens of Mycoplasma ovipneumonia, and determine the target organs of mycoplasma infection. [Method]According to the 16S rRNA sequence of sheep mycoplasma in GenBank website, two pairs of specific primers were designed and synthesized. PCR reaction conditions were optimized by using the genome DNA of M. ovipneumonia as templates. The nested PCR products were verified by sequencing. A nested PCR method for detecting the pathogens of M. ovipneumonia was established. The established method was used to detect the lung, lung lymph, heart, kidney, liver, spleen, skin, small intestine and peripheral blood of clinical positive samples, and the lung tissue from clinical suspected samples. [Result]864 bp specific gene fragment was amplified by using nested PCR method. The lung and lung lymph of sheep were the target organs of mycoplasma infection. The coincidence rate between the detection rate of clinical samples by the nested PCR and pathogen culture and identification results was 100%. [Conclusion]The nested PCR method for detection of M. ovipneumonia could be applied for the laboratory diagnosis of clinical samples.
Key words Mycoplasma ovipneumonia;Nested PCR;Detection method
基金項目 新疆维吾尔自治区肉毛兼用绒毛用羊品种选育提升计划项目(2022XJRMY-03);新疆生产建设兵团农业科技创新工程专项(NCG202211);新疆生产建设兵团重大科技项目(2017AA006);国家肉羊产业技术体系项目(CARS-38)。
作者简介 杨华(1977—),男,湖南长沙人,研究员,博士,从事动物遗传育种与繁殖研究。
收稿日期 2023-03-05
羊支原体肺炎又称羊传染性胸膜肺炎,是危害世界养羊业的主要传染病之一。绵羊肺炎支原体(Mycoplasma ovipneumoniae,MO)是引起绵羊增生性、间质性支原体肺炎的主要病原[1],可通过空气、飞沫、饮水等途径传播,具有高度接触传染性,主要临床症状有喘气、咳嗽、高热、精神萎靡、渐进性消瘦和慢性增生性间质性肺炎等[2]。绵羊在每个季节均可感染肺炎支原体,但春季和冬季的感染率最高,1—3月龄羔羊最易感染发病,感染率髙达95.3%,病死率达到27.5%[1]。绵羊肺炎支原体的感染范围十分广泛,呈全世界范围分布和流行,尤其在养羊业比重较大的不发达国家发病率较高,造成了一定的经济损失,严重影响养羊业的发展。
绵羊肺炎支原体主要引起肺脏的病变,还可以造成心脏、肝脏、脾脏、肾脏、脑、淋巴结的损害。一般认为绵羊肺炎支原体的靶器官是肺脏,临床上主要表现为呼吸道症状,通过病原分离培养和PCR检测,在包括肺脏在内的多个器官中检测到支原体。因此,研究人员认为肺脏不是肺炎支原体感染的唯一靶器官[3]。目前,用于绵羊肺炎支原体常规诊断的方法包括病原分离培养鉴定、血清学检测、免疫组织化学检测、酶联免疫吸附试验(ELISA)检测,近些年也出现了核酸探针和PCR等较为先进的检测方法[4]。但是,核酸探针需要放射性同位素标记,不易普及。巢式PCR是在常规PCR的基础上,以第1轮PCR扩增产物为模板进行第2轮PCR扩增,经2轮PCR得到目的基因片段。与常规PCR相比,巢式PCR的特异性和灵敏度更高[5]。巢式PCR已被用于牛肺炎支原体[6]、猪肺炎支原体[7]、细胞支原体[8]和恶性疟原虫培养中支原体[9]的检测,但未见到用于绵羊肺炎支原体的检测报道。笔者针对绵羊支原体16S rRNA序列设计引物,建立肺炎支原体巢式PCR诊断方法,进而检测分析临床病料肺脏和肺淋巴等9种组织中的肺炎支原体,明确肺炎支原体感染的靶器官,旨在为绵羊支原体感染的诊断、预防和流行病学调查提供参考。
1 材料与方法
1.1 材料
1.1.1 主要试剂。细菌基因组DNA提取试剂盒、血液/细胞/组织基因组DNA提取试剂盒、琼脂糖凝胶DNA回收试剂盒、DL2000 DNA Marker(天根生化科技(北京)有限公司)、Ex Taq酶(宝日医生物技术(北京)有限公司)、琼脂糖(Biowest公司)。
1.1.2 主要仪器。高速离心机(生工生物工程(上海)股份有限公司,中国);PCR仪(杭州朗基科学仪器有限公司,中国);电泳仪(北京六一生物科技有限公司,中国);凝胶成像仪(UVP公司,美国)。
1.1.3 菌株。綿羊肺炎支原体菌株由省部共建绵羊遗传改良与健康养殖国家重点实验室分离、鉴定,-80 ℃下保存。
1.2 方法
1.2.1 临床病料与病原分离。在试验区周边4个羊场采集53只疑似肺炎支原体病死绵羊的肺脏组织,3只健康绵羊屠宰后取肺脏组织。另外,采集经病原分离培养,确诊感染肺炎支原体病死绵羊的肺脏、肺淋巴、心脏、肾脏、肝脏、脾脏、皮肤、小肠和外周血,制备EDTA-Na2抗凝血。支原体分离培养参考文献[10]的方法,以确定临床病例感染的病原。
1.2.2 引物设计。根据 GenBank 网站发表的绵羊支原体16S rRNA基因序列(GenBank登录号为EU265780.1),应用Primer Premier 5软件设计引物,引物序列见表1,引物由生工生物工程(上海)有限公司合成。
1.2.3 DNA提取。 应用细菌基因组DNA提取试剂盒提取绵羊肺炎支原体菌株的基因组DNA,血液/细胞/组织基因组DNA提取试剂盒提取外周血、肺淋巴、肺脏、心脏、肾脏、肝脏、脾脏、皮肤、小肠组织的基因组DNA,以上均按照试剂盒说明书操作,提取的DNA经1%琼脂糖凝胶电泳检测。
1.2.4 PCR反应体系和程序的建立。分别以提取的肺炎支原体菌株和阴性健康绵羊肺脏组织的基因组DNA为模板,进行巢式PCR扩增体系和扩增条件的优化。优化的第1轮扩增PCR反应体系(25 μL)如下:10×Ex Taq buffer(含Mg2+)2.50 μL,dNTP Mixture(各2.5 mmol/L)2.00 μL,ovi1F(10 μmol/L)0.50 μL,ovi1R(10 μmol/L)0.50 μL,Ex Taq(5 U/μL)0.25 μL,去离子水18.25 μL,基因组DNA(50 ng/μL)1.00 μL。将上述溶液混合,按以下程序进行PCR反应:94 ℃ 5 min;94 ℃ 30 s,58 ℃ 30 s,72 ℃ 30 s,35个循环;72 ℃ 5 min。第2轮扩增PCR反应体系(25 μL)如下:取1 μL第1次扩增产物,引物使用ovi2F和ovi2R,其余成分和使用量同第1次PCR。PCR反应程序同第1次PCR。PCR反应结束后,使用1.5%琼脂糖凝胶对5 μL PCR产物进行电泳检测。
1.2.5 PCR产物的测序验证。PCR扩增产物经琼脂糖凝胶DNA回收试剂盒纯化,与pMD18-T载体在25 ℃以下连接,转化到感受态细胞DH5α 中,在氨苄抗性平板上筛选出阳性克隆,提取质粒,经PCR鉴定为阳性的克隆质粒送交生工生物工程(上海)有限公司测序,序列用GenBank数据库BLASTN在线比对分析。
1.2.6
肺炎支原体感染的靶器官鉴定。以确诊感染肺炎支原体病死绵羊的肺淋巴、肺脏、心脏、肾脏、肝脏、脾脏、皮肤、小肠和外周血组织的基因组DNA为模板,应用建立的巢式PCR方法检测绵羊支原体,PCR产物使用1.5%琼脂糖凝胶电泳检测。
1.2.7 临床样本的检测。以53份疑似肺炎支原体感染的临床病例肺脏组织DNA为模板,应用建立的巢式PCR方法检测绵羊支原体肺炎病原。使用分离、鉴定的菌株作为对照,与每一个临床样本PCR检测结果进行对照,计算二者的符合率。
2 结果与分析
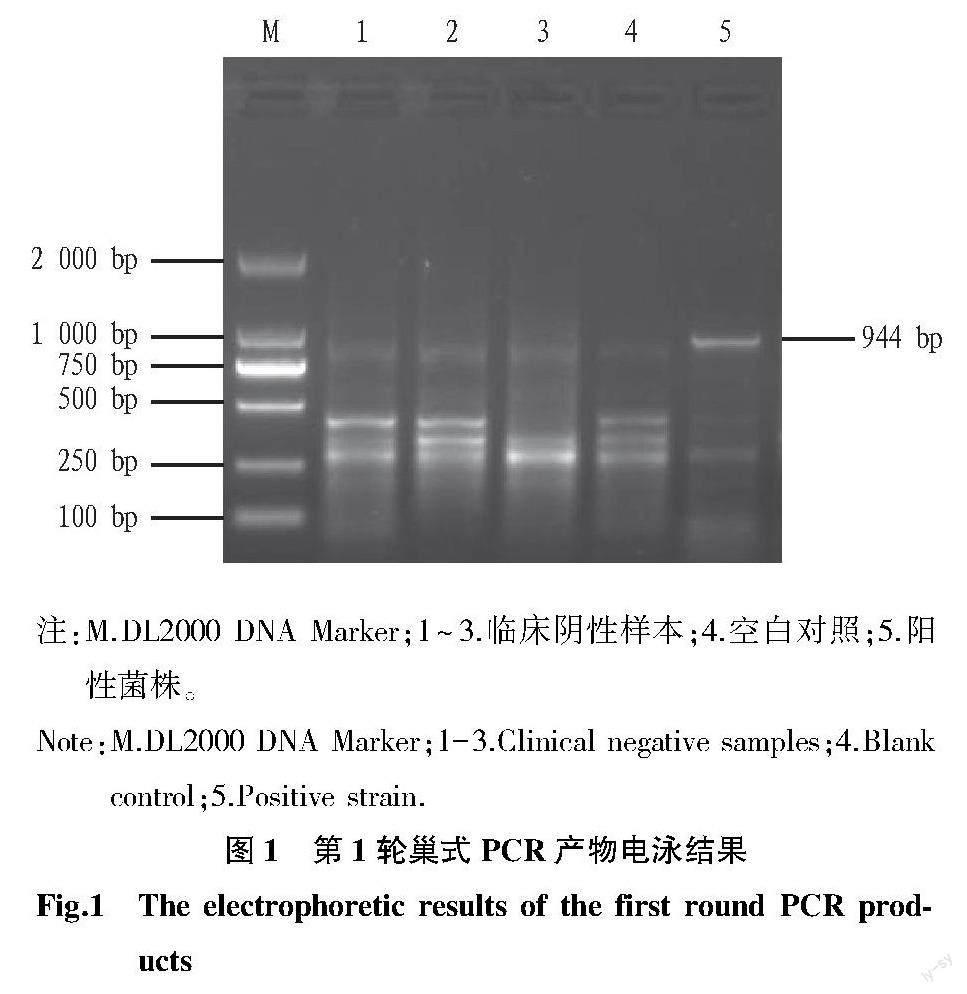
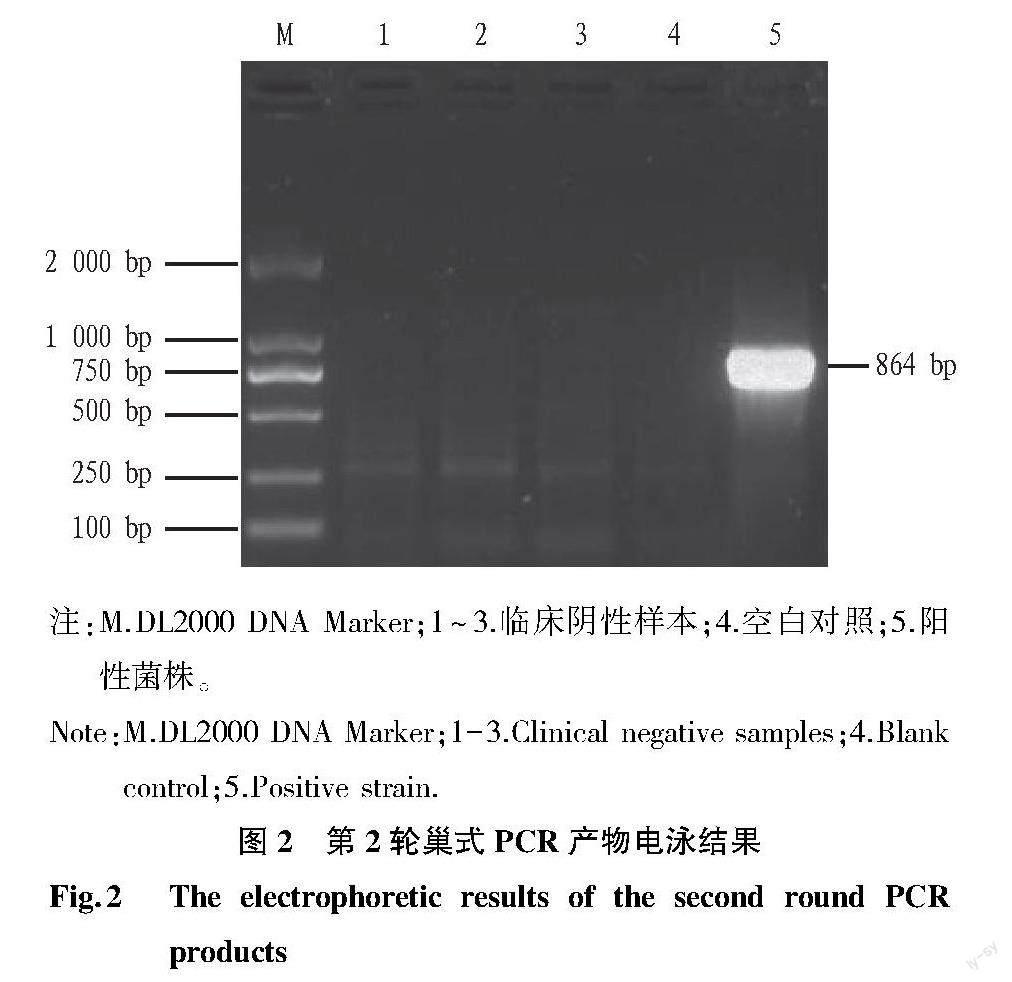
2.1 PCR检测结果 第1轮和第2轮PCR扩增产物经1.5%琼脂糖凝胶电泳检测,第1轮巢式PCR产物的电泳结果见图1。从图1可以看出,阳性菌株、空白对照和阴性样本的PCR产物均存在非特异性扩增,阳性菌株存在944 bp的目的条带。图2为第2轮巢式PCR产物电泳结果。从图2可以看出,阳性菌株扩增出864 bp的特异性条带,空白对照和阴性样本的PCR产物未见特异性条带。
2.2 PCR产物测序
PCR产物的克隆质粒经测序和序列分析,结果表明扩增产物序列与绵羊肺炎支原体16S核糖体RNA基因序列匹配(GenBank登录号为EU265780.1),序列一致性为99%,证明扩增产物为绵羊肺炎支原体的基因片段。
2.3 肺炎支原体感染的靶器官鉴定结果
应用建立的巢式
PCR方法对确诊感染肺炎支原体病死绵羊的肺脏等9个组织DNA进行扩增,PCR产物经琼脂糖凝胶电泳检测发现,在肺脏和肺淋巴DNA中扩增出目的基因,其他组织无目的基因扩增(图3),说明绵羊的肺脏和肺淋巴为肺炎支原体感染的靶器官。
2.4 临床样品的检测
应用建立的巢式PCR方法对采集的53例疑似肺炎支原体感染的临床病例肺脏组织DNA进行检测,结果发现A羊场的12个样本没有扩增出目的基因,另3个羊场(B、C、D羊场)均扩增出特异性目的基因片段,与支原体病原分离培养结果一致。由表2可知,二者的符合率达到100%,说明建立的巢式PCR方法可用于绵羊肺炎支原体感染的临床样本诊断。
3 讨论
绵羊肺炎支原体(MO)是羊群中常见的病原菌之一,其传播范围广,感染的羊只病程呈慢性,康复后可长期带菌,很难预防和控制,MO是严重危害养羊业的一种致病性支原体。环境诱因和其他病原因素使羊体免疫力下降,MO可趁势侵入机体。感染MO的羔羊死亡率增加,羊只出现慢性营养消耗、生长缓慢、繁殖率下降、出栏延后、饲养成本大幅度提高,给养殖场带来巨大的经济损失[11]。然而,感染MO的临床症状和病理变化特征不明显,且容易与巴氏杆菌、肺炎链球菌和化脓杆菌等混合感染或继发感染,导致临床诊断较难。检测取样中,病料极易受到其他支原体和细菌的污染,因此病料的选择也非常关键。Mackay等[12]于1963年在英格兰首次从绵羊体内分离到MO,随后在世界上不同国家和地区均有发现。Manlove等[13]对美国农业部国家健康检测系统中453只绵羊进行检测,发现MO检出率为88%。黄秀君等[14]对攀枝花不同地区山羊MO感染进行血清学调查,结果显示阳性率为46%。韩林梅等[15]对广西6个主要牛、羊养殖场24 000份羊血清进行MO抗体检测,发现MO个体阳性率为40.66%,群体阳性率为77.14%。由此可见,MO在世界范围内广泛流行,造成巨大的经济损失,已成为制约养羊业健康发展的主要疾病之一。因此,有必要建立准确的MO诊断方法,开展绵羊支原体肺炎病原的检测,提高群体健康水平。
目前用于绵羊肺炎支原体的检测方法主要有病原学检测、免疫学检测及分子生物学检测。病原分离培养鉴定虽然是金标准,但因为MO基因组小,自身合成能力有限,对培养条件要求苛刻,实际操作耗时、烦琐[16]。血清学检测相较于分离培养方法速度快、检测量大、检出率高,但该方法容易发生血清学交叉反应,在实际应用中存在一定的局限性[17]。免疫组化检测中,由于MO感染引起的羊支原体肺炎为慢性传染病,菌体量的积累相对较少,且支原体附着于细胞表面或者存在胞质中,导致免疫组化检测阳性信号不明显,检测结果不易判定[18]。随着分子生物学技术的发展,PCR已成为检测绵羊肺炎支原体的一个重要方法。屈勇刚等[19]应用绵羊临床鼻拭子标本建立了肺炎支原体PCR检测方法。李媛等[20]应用PCR方法检测了湖羊肺脏病料中的支原体。冯旭飞等[21]应用绵羊肺脏组织建立肺炎支原体和溶血性曼氏杆菌双重 PCR检测方法。储岳峰等[22]建立了丝状支原体山羊亚种和绵羊肺炎支原体的双重PCR方法。笔者以GenBank网站上发表的绵羊支原体16S rRNA基因部分序列为参考序列,设计用于巢式PCR检测的2对引物,经过PCR反应体系和反应条件的优化,建立了检测绵羊支原体肺炎病原的巢式PCR方法,在肺炎支原体菌株中扩增出864 bp特异性目的条带,测序结果表明PCR产物为目的基因片段。临床阳性绵羊9个组织样品的巢式PCR結果证明肺炎支原体感染的靶器官为肺脏和肺淋巴,说明针对肺炎支原体的检测,病料要采集肺脏或肺淋巴才能确保检测的准确性。该试验进一步应用建立的巢式PCR方法对4个羊场53份疑似样品进行了检测,结果在6份经支原体病原培养鉴定确诊的肺脏组织中扩增出目的条带,其余均未扩增出特异性条带,且巢式PCR检测结果与支原体分离培养的病原学诊断结果一致,说明所建立的巢式PCR方法作为绵羊肺炎支原体PCR检测方法的补充,可用于支原体感染的临床样品诊断,为绵羊肺炎支原体病原的快速检测及早期预防提供技术支持。
参考文献
[1]王旭,张晓宇,张建华,等.绵羊肺炎支原体P130蛋白主要抗原域原核表达及其间接ELISA检测方法的建立[J].中国兽医科学,2018,48(3):281-287.
[2]郑佳琪,黄海碧,王晓晖,等.绵羊肺炎支原体、丝状支原体山羊亚种和精氨酸支原体多重PCR检测方法的建立及应用[J].中国兽医学报,2016,36(7):1131-1134.
[3]陶岳,李新萍,林为民,等.绵羊肺炎支原体对肺及肺外脏器影响的研究[J].中国畜牧兽医,2007,34(2):98-99.
[4]江锦秀,林裕胜,张靖鹏,等.绵羊肺炎支原体感染的诊断和防治技术研究进展[J].福建农业学报,2019,34(12):1463-1470.
[5]白方方,武昱孜,靳蒙蒙,等.巢式PCR检测猪鼻支原体方法的建立及应用[J].中国兽医学报,2013,33(7):1007-1010.
[6]李大伟,张彦明,黄灿平,等.应用巢式PCR方法检测牛支原体肺炎[J].中国动物检疫,2010,27(4):28-29.
[7]吉玛,娘洛,张淑云.猪肺炎支原体巢式PCR诊断方法的建立及应用[J].家畜生态学报,2014,35(3):53-57.
[8]黄海军,高其双,彭霞,等.细胞支原体巢式PCR检测方法的建立及应用[J].湖北农业科学,2014,53(3):690-693.
[9]胡东伟,丁帅,胡守锋,等.应用巢式PCR对恶性疟原虫培养中支原体污染的检测[J].中国病原生物学杂志,2012,7(1):32-33,29.
[10]何卫新,康立超,杨华,等.羔羊肺炎病原分离鉴定[J].中国兽医杂志,2013,49(4):37-39.
[11]黄海碧.绵羊肺炎支原体检测方法的建立及黏附蛋白的研究[D].呼和浩特:内蒙古农业大学,2016.
[12]MACKAY J,NISBET D,FOGGIE A.Isolation of pleuropneumonia.like organisms(Genus Mycoplasma)from case of sheep pulmonary adenomatosis(SPA)[J].Vet Rec,1963,75(21):550-551.
[13]MANLOVE K,BRANAN M,BAKER K,et al.Risk factors and productivity losses associated with Mycoplasma ovipneumoniae infection in United States domestic sheep operations[J].Prev Vet Med,2019,168:30-38.
[14]黄秀君,童俊青,万洁,等.攀枝花山羊的绵羊肺炎支原体感染血清学调查[J].畜牧与兽医,2015,47(8):154.
[15]韩林梅,吴翠兰,李军,等.广西牛羊主要呼吸道疫病的血清学调查[J].今日畜牧兽医,2018,34(10):17-19.
[16]梁小军,沈志鹏,许斌,等.泰妙菌素治疗绵羊肺炎霉形体病的效果观察[J].宁夏农林科技,2002,43(6):17-36.
[17]THIRKELL D,SPOONER R K,JONES G E,et al.Cross.reacting antigens between Mycoplasma ovipneumoniae and other species of mycoplasma of animal origin,shown by ELISA and immunoblotting with reference antisera[J].Vet Microbiol,1991,26(3):249-261.
[18]SEN A,GUPTA D,JAGANI R.Rapid in.situ hybridization and immunohistochemistry:A pilot comparative study of two rapid diagnostic techniques for establishing monoclonality in plasma cell dyscrasias[J].Med J Armed Forces India,2020,76(1):103-108.
[19]屈勇剛,剡根强,陈宏伟,等.绵羊肺炎支原体PCR检测方法的建立[J].石河子大学学报(自然科学版),2005,23(6):687-689.
[20]李媛,陶岳,阿依吐拉·肉孜,等.从湖羊肺脏中分离绵羊肺炎支原体的鉴定[J].中国预防兽医学报,2006,28(4):375-379.
[21]冯旭飞,王远微,李定霏,等.绵羊肺炎支原体和溶血性曼氏杆菌双重PCR检测方法的建立及应用[J].中国预防兽医学报,2014,36(10):788-791.
[22]储岳峰,高鹏程,赵萍,等.应用双重PCR方法检测羊支原体肺炎病原[J].畜牧与兽医,2009,41(12):23-26.
