微藻在蓝碳中的作用机制及影响因素
2024-03-11李清毅张国民王新烨宋鑫博储菲菲李珂
李清毅 张国民 王新烨 宋鑫博 储菲菲 李珂
摘要 结合文献计量的方法,聚焦近年来的研究热点,分析微藻在蓝碳中的作用机制及影响因素。结果表明,温室气体CO2增加不仅会影响微藻初级生产力和有机碳循环途径,而且会影响整个海洋碳通量与生物泵功能;气温上升则主要影响微藻与细菌群落组成,进而影响海域生态过程。微藻与细菌的相互关系与协同作用直接影响海洋水柱中碳沉积过程,两者的协变关系不仅受温度、光照等自然因素影响,而且受到气候变化与人为活动干扰,进而改变微藻-细菌耦合碳流途径。
关键词 蓝碳;微藻;细菌;作用机制;影响因素;文献计量
中图分类号 X145 文献标识码 A 文章编号 0517-6611(2024)03-0071-06
doi:10.3969/j.issn.0517-6611.2024.03.017
Mechanism of Action and Influence Factor of Microalgae in Blue Carbon
Abstract By combining bibliometric methods and focusing on recent research hotspots,the mechanism of action and influencing factors of microalgae in blue carbon were analyzed.The results showed that the increase of greenhouse gas CO2 would not only affect the primary productivity and organic carbon cycling pathway of microalgae,but also affect the whole ocean carbon flux and biological pump function.Rising temperature mainly affect the composition of microalgae and bacteria community,and then influence on the marine ecological process.The mutual and synergistic interaction between microalgae and bacteria directly affect the carbon deposition process in the ocean water column.The covariation relationship between microalgae and bacteria was not only affected by natural factors such as temperature and light,but also affected by climate change and human activities,thus changing the coupling carbon flow pathway of microalgae and bacteria.
Key words Blue carbon;Microalgae;Bacteria;Mechanism of action;Influencing factors;Bibliometrics
2020 年,国家主席习近平在第 75 届联合国大会一般性辩论上提出中国“努力争取 2060 年前实现碳中和”的宏伟目标,为实现这一目标,减排(减少向大气中排放 CO2)和增汇(增加对大气 CO2的吸收)是两条根本路径。目前,世界各国都在积极发展和储备碳捕集、利用与封存(CCUS)技术,而对增汇手段的探索较为薄弱。即便充分利用了替代能源,
实现碳中和目标仍有巨大的负排放缺口,必须同时采取减排和增汇措施[1]。海洋作为占据了地球表面71%的大生态系统,每年约可吸收30%人类活动排放的CO2,并且储碳周期可达数千年之久[2-3]。随着海洋碳汇潜力被国际社会认可,“蓝碳”近年来成为研究的热点。据联合国环境署、粮农组织和教科文组织、政府间海洋学委员会联合发布的《蓝碳报告》,蓝碳占全球光合作用捕获碳的55%,因此,蓝碳意义重大[4-5]。其中,微藻作为海洋中重要的初级生产者,其生产的有机碳总量约为高等植物的7倍,固碳总量远高于全世界陆地植物的固碳总量[6]。微藻通过光合作用将大气中的CO2转移到海洋碳库中,起到了驱动海洋碳沉积的“引擎”作用,该“引擎”通过生物泵(biological pump,BP)[7]和海洋微型生物碳泵(microbial carbon pump,MCP)[8]实现了海洋碳捕获。其本质上是颗粒有机碳 (particulate organic carbon,POC) 的输出过程、溶解有机碳(dissolved organic carbon,DOC)的转化和惰性溶解有机碳(recalcitrant DOC,RDOC)的产生过程[9]。经过一系列生物的同化和异化代谢途径,有机碳转变为POC,其中,约50%的POC转化成DOC[10],之后异养微生物又利用DOC产生RDOC,正是这部分RDOC 逃逸了生物的利用和操控、进入水体长期积累,构成了海洋水柱储碳[11]。由此可见,海洋中的碳捕获、碳输入、碳传输和碳沉积等过程都离不开微藻,以及微藻与细菌等微生物间复杂的相互作用。该研究深入剖析了微藻在海洋碳捕获与碳沉积中的作用、微藻与细菌协同关系对海洋蓝碳的影响机制及其影响因素,为蓝碳增汇提供了重要理论支撑。
1 微藻在蓝碳中的作用及影响因素
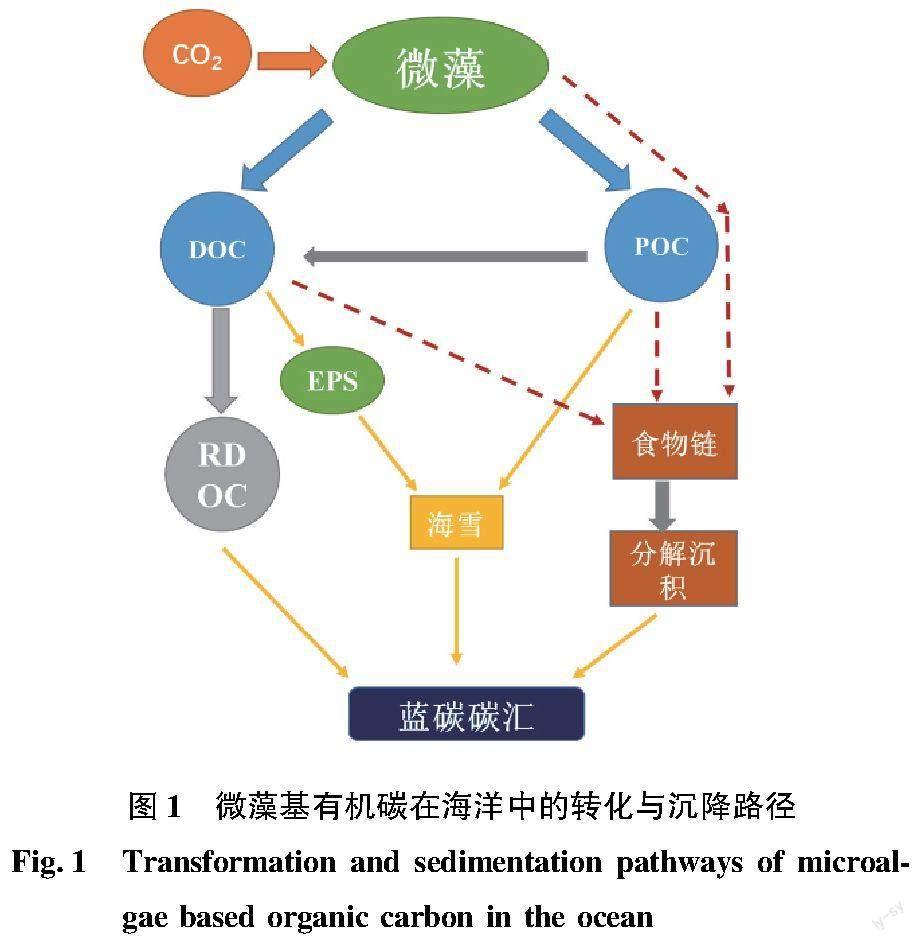
1.1 微藻基有机碳的海洋沉积途径
微藻固定的有机碳可分为POC和DOC两种形式。DOC由微藻直接分泌或由POC转变而来,被细菌摄食后可进一步转变为RDOC被长期贮存在海洋水体中。POC可直接或在微藻产生的胞外多糖(extracellular polysaccharide,EPS)作用下聚集沉积至海底,亦可通过食物链传递至高营养级,随生物排泄或死亡分解沉积至海底(图1)。在真光层中,有机碳的沉积数量和质量很大程度上取决于微藻群落组成[12]。海洋中微藻种类丰富,包括硅藻、甲藻、球石藻、藍藻、绿藻和金藻等,不同藻类因其细胞大小和细胞壁组成不同而导致其沉降速度不同。蓝藻和青绿藻等微型浮游植物由于体积小、沉降速度慢(<0.5 m/d),很难将有机碳从表层海水输入到深层海水,其产生的有机碳以进入微食物环为主。而硅藻等大细胞微藻(2~500 μm)则可通过快速沉降将有机碳转移至深层海水。由于硅藻细胞壁上的二氧化硅可以起到“压舱”的作用,其沉降速率可到达35 m/d。球石藻上覆盖的碳酸钙不仅可以作为压舱物,并且可以促进微藻颗粒聚集,从而提高沉降速率(5 m/d)[13-14]。每年约有11 Gt碳通过微藻输入海洋内部,若无微藻固碳过程,大气中的CO2浓度将比现在高出400 mg/L[15-16]。
1.2 海洋微藻固碳的影响因素
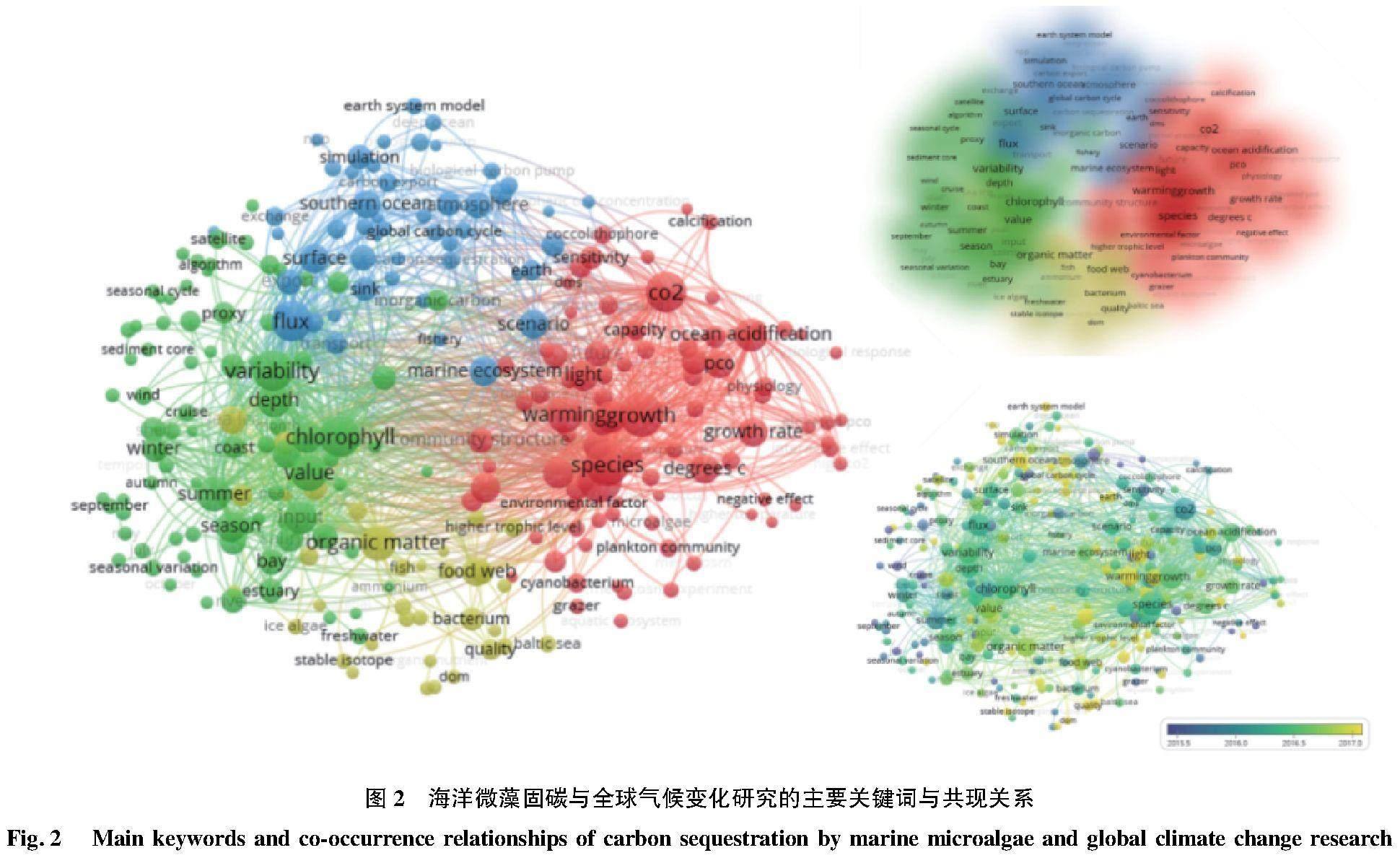
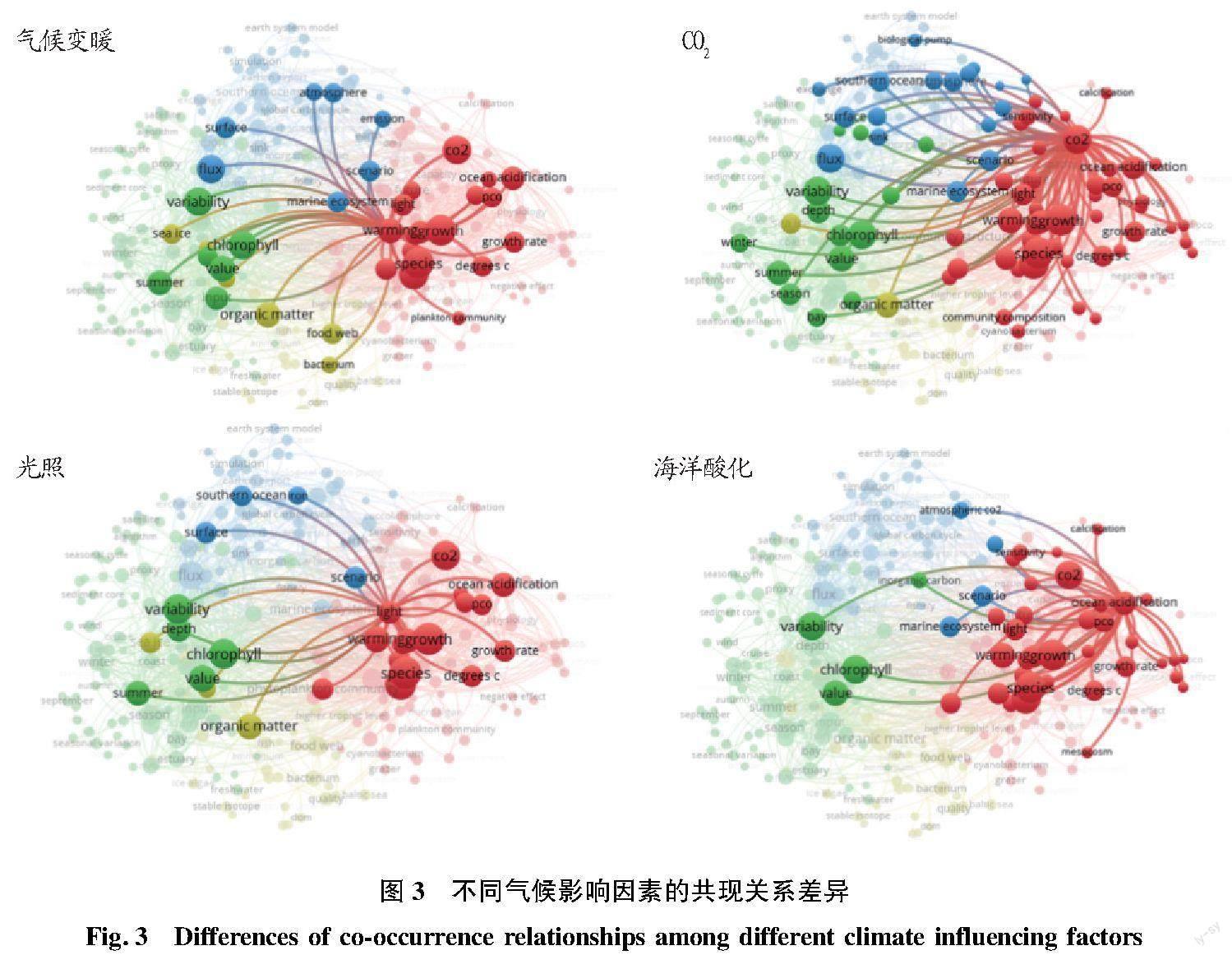
微藻通过碳循环过程影响全球气候的同时,也受到全球气候变化的影响。以海洋微藻、碳和全球气候变化为主题,在Web of Science数据库中进行检索,检索结果利用VOSviewer软件进行可视化分析,结果表明(图2),全球气候变化导致的温度、碳浓度和光照波动以及海洋酸化等是影响海洋微藻对碳循环贡献的主要因素,研究最广泛。其中,CO2影响涉及范围最广,宏观至全球碳循环、海洋碳通量及生物泵功能,微观至微藻种群组成与结构、初级生产力、叶绿素合成、有机物质积累、多类型有机碳输入与输出过程等(图3)。CO2浓度的升高一方面有利于刺激微藻的生长,提高固碳速率[17],另一方面却会引起海水酸化,破坏钙化浮游植物的钙化过程,加重紫外线对细胞的伤害[18],反而不利于碳沉积。除微藻钙化过程外,海洋酸化还会影响微藻生长、微藻种群组成、无机碳循环过程等。与其他影响因素不同,目前针对海洋酸化的研究不涉及其季节性和地域性,并且针对海洋酸化对碳循环过程影响的研究也鲜见报道。
针对气候变暖,海洋生态群落的响应是主要方向,如微藻与细菌物种分布、有机物波动,及其引发的食物链、微食物环的改变等(图3)。海洋温度上升可以同时提高微藻呼吸和光合作用速率,但对呼吸作用的促进效果比对光合作用的促进效果显著,甚至出现群体呼吸作用高于光合作用的现象,导致海洋的净生产力下降,甚至导致海域由自养型向异型转变。然而,有些微藻如聚球藻、海链藻等在对“高温”的长期适应过程中,可启动代谢补偿机制,以维持甚至提高光合/呼吸比,保障了气候变暖条件下微藻的固碳功能[19]。此外,气候变暖还会加强低纬度和中纬度地区的热层结,阻止营养物质从深水进入上混合层,加剧微藻的營养限制[20],影响群落组成分布,进而改变整个海域的生态过程[21]。另一方面,上混合层变浅却有利于增强光照的可获得性,反而促进了微藻光合作用和固碳进程[22-23]。因此,光照对海洋微藻固碳的影响与升温有相似性,但更多体现在表层海水微藻生长和叶绿素积累过程上,并且在南大洋区域研究较多。 除了人为导致的全球气候变化影响外,也有研究开始关注微塑料对海洋微藻固碳作用的影响[24]。
2 微藻-细菌体系在蓝碳中的作用及影响因素
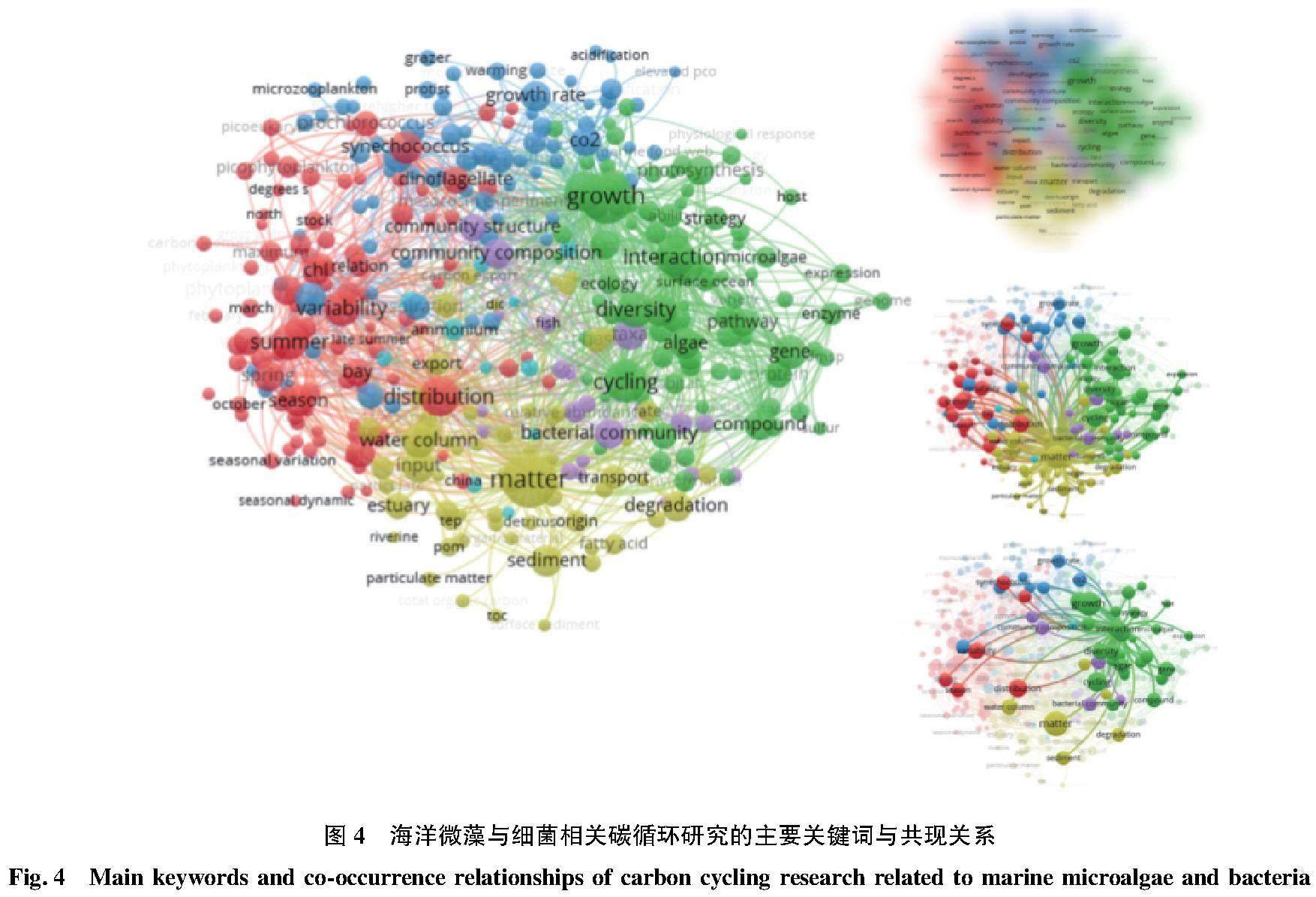
微藻与细菌从数量上在海洋生态系统中占据绝对优势,构成了有机碳颗粒的主体部分。微藻与细菌之间天然的、紧密的联系很大程度上决定了海洋碳汇的储量与性质。以海洋微藻、碳和细菌为主题,在Web of Science数据库中进行检索,检索结果的可视化分析表明(图4),微藻与细菌之间的相互作用(绿色部分)与两者之间的质量传递(黄色部分)是该领域的研究热点,其次是微藻与细菌群落相互关系的影响因素研究,包括季节与地理环境等自然因素(红色部分),以及气候变暖、CO2浓度上升、海洋酸化、放牧等人为干扰因素(蓝色部分)。
2.1 微藻与细菌的相互作用
微藻与细菌的相互作用宏观上可以改变两者的种群分布和群落结构,微观上可以调节两者的基因表达和代谢通路,进而影响碳物质在海洋水柱中的分布与沉积过程。微藻和细菌之间存在着共栖、互利共生、捕食等关系,因此,细菌群落的多样性和组成通常与微藻的生物量和初级产量共变[25-26]。微藻通过光合作用将无机碳转变为有机碳,处于指数生长期的藻类细胞可释放的DOC占其每日总固碳量的10%,并且当细胞受到环境压力时DOC 的释放量会大大增加[27-29]。约50%的海洋光合产物通过不稳定DOC池从微藻转移到异养细菌,细菌利用微藻渗出或细胞裂解产生的溶解有机碳,形成“碳流”,在全球碳循环中起到重要作用[30]。反之,细菌通过矿化作用分解转化有机碳过程中产生氮磷等营养物质供自养型微藻利用,同时也可为兼养型微藻提供碳源[31]。异养细菌还可通过分泌维生素B12、对铁极具亲和力的小有机分子铁载体等促进微藻生长固碳过程[32-33]。除营养物质交换过程外,微藻与细菌之间还存在着密切的信号物质和基因交流过程影响彼此生长、推动菌藻协同进化[34]。然而,由于在海洋和海岸带等开放水域中,细菌对微藻产生的有机碳获得性降低,微藻与细菌的协变程度低于淡水水域,甚至微藻基有机碳不能满足细菌所需碳源,细菌还需要从浮游动物摄食、病毒裂解和外部输入DOC等途径获取碳源以保证生长[35]。因此,探究细菌与微藻协变关系的影响因素,进一步提高细菌对微藻基碳源的可利用性也是增加海洋碳汇的重要途径之一。
2.2 微藻与细菌协变关系的影响因素
水域的类型、环境条件、水文特征等都是影响微藻-细菌相互关系的重要因素。水体营养物质较少可能会导致微藻与细菌从互利共生的关系转变为捕食关系[36]。水体温度的升高会提高微藻光合作用效率,刺激细胞产物渗出[37],同时提高异养微生物的生物量积累和呼吸速率[38]。考虑到温度升高同时刺激菌藻的代谢,两者的相互作用也可能会随着温度的升高而加剧,从而改变水生生态系统的碳等营养循环[36-37]。光照是微藻光合作用活性的主要制约因素,直接决定了微藻初级生产力,另一方面,光通过有机物的光降解直接影响了异养过程,从而刺激细菌的生长和分解活性[39]。光也可以通过抑制微藻不稳定有机碳的渗出或其他微藻媒介间接影响异养生物[40]。此外,光照还可以通过光能异养菌的生理响应直接作用于细菌群体,例如,好氧不产氧光合异养细菌(aerobic anoxygenic phototrophic,AAP)。这类细菌需要微藻产生的DOC维持生长,受到微藻的协同制约[11],但却可以利用光能合成ATP供给细胞异养代谢,从而减少了呼吸作用对有机碳的消耗,进而起到增加海洋储碳的作用,当光照不足时,AAP的呼吸作用将受到抑制[41]。由于水生生态系统中光照和温度高度协同的时空变化,光照和温度的耦合效应对微藻-细菌协同作用的影响也颇为重要。
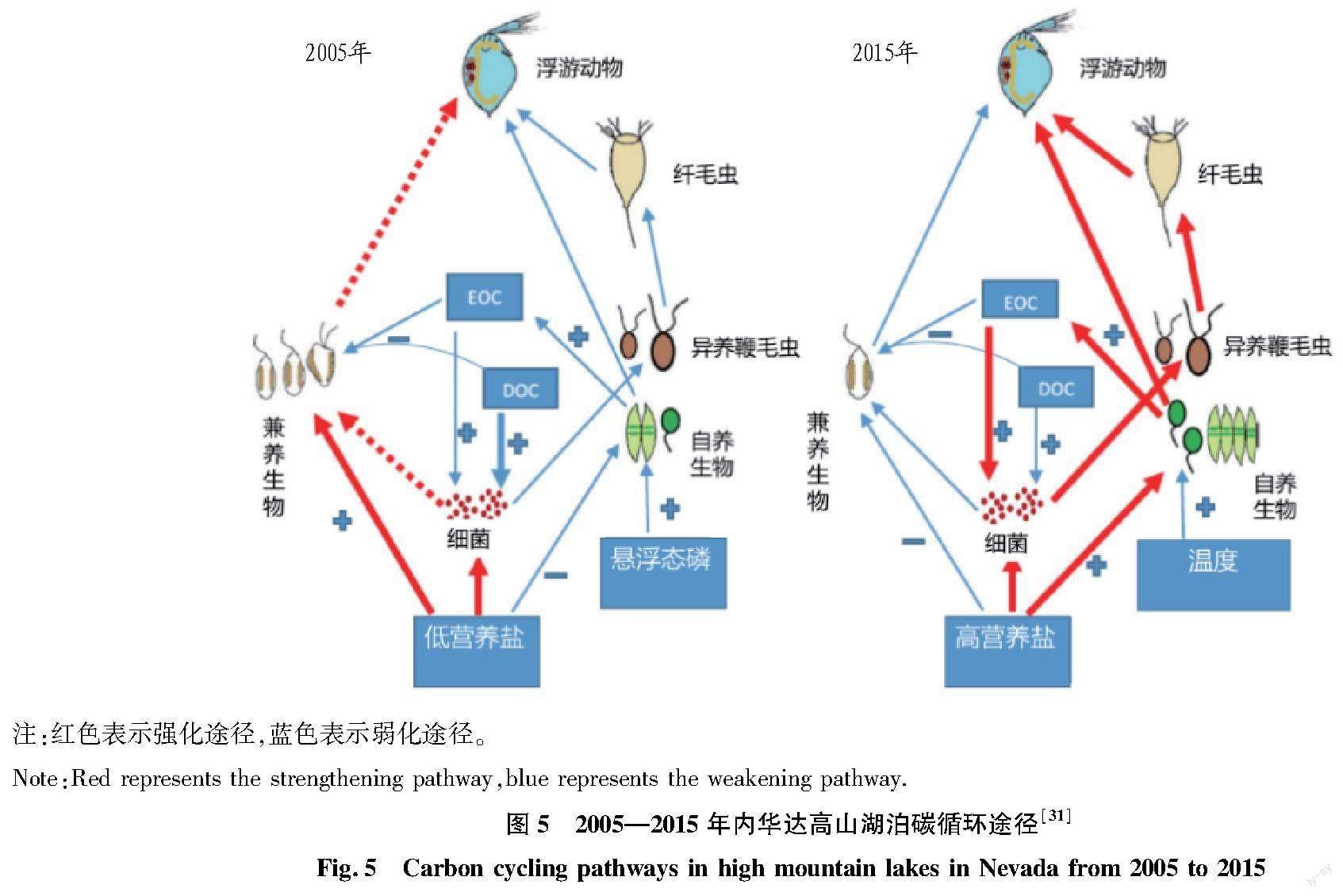
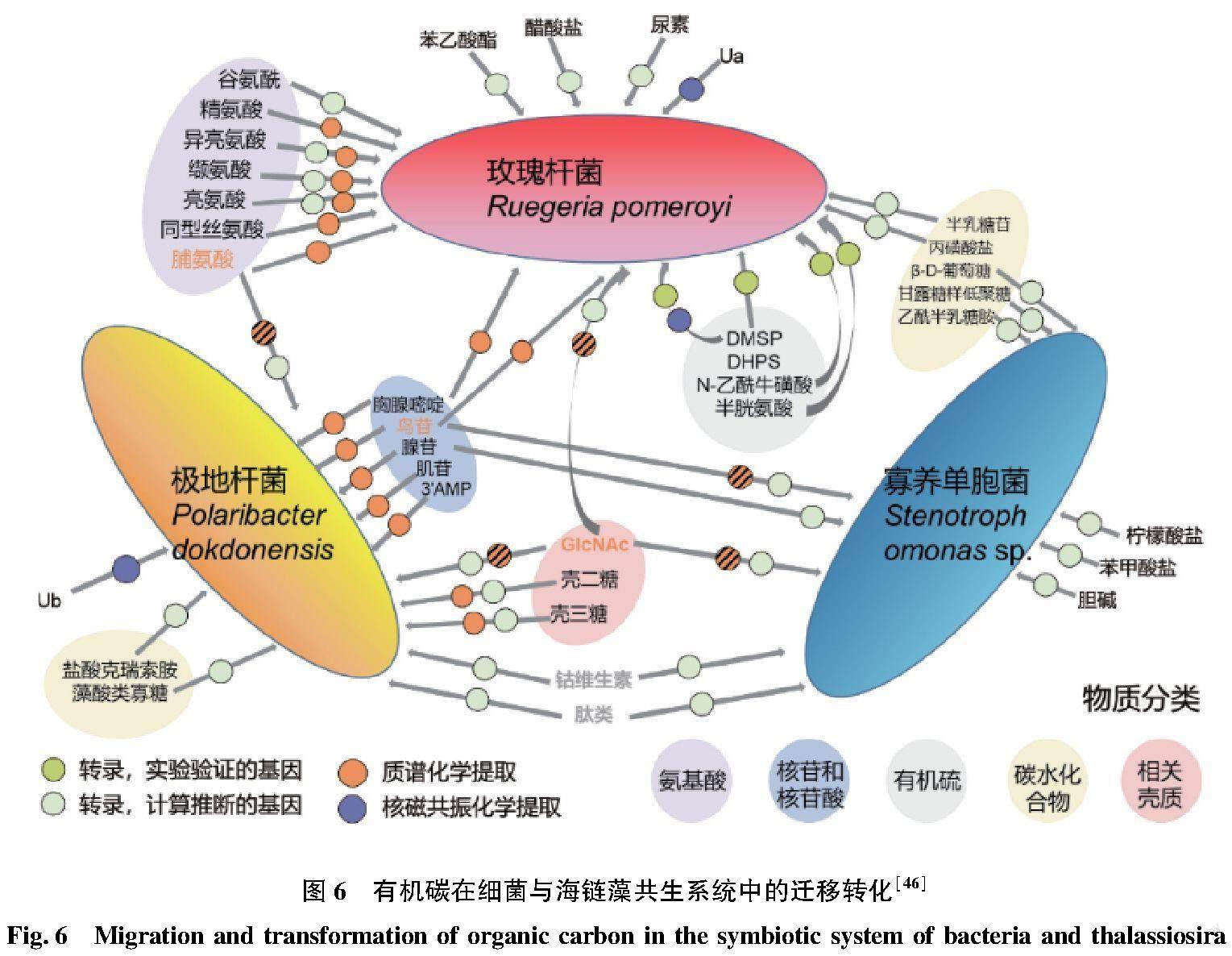
微藻-细菌的耦合关系,以及通过微生物循环的碳流亦受到气候变化与人类活动干扰的影响。全球气候变化可能会导致微生物功能多样性的降低,改变微生物群落结构,甚至切断微生物循环与高营养级的联系,从而改变整个水域的碳循环过程。如图5所示,随着环境温度升高,空气气溶胶的增加,内华达高山湖泊中碳在自养生物-异养生物食物链中的迁移过程加强,而兼养生物中碳代谢途径减弱[31]。放牧则会导致海洋细菌对微藻渗出碳源的依赖程度降低,而更多地利用病毒或捕食者产生的有机碳[42]。在以往对微藻-细菌耦合作用研究中,主要研究了微藻对细菌代谢及群落结构的影响,进而分析微生物循环对碳循环的作用,但对海洋及海岸带微藻-细菌的食物网中的碳流动过程和分配机制的研究较少[43]。事实上,细菌对微藻基有机碳的利用是具有选择性和针对性的(图6),如红杆菌(Rhodobacterales)对小分子的微藻代谢产物利用性较好,而黄杆菌(Flavobacteriales)则对高分子碳水化合物的利用性更高[44-45]。在没有竞争的情况下,细菌利用微藻代谢物的重叠程度很低[46]。
3 结论
海洋蓝碳增汇是实现碳中和目标的重要途径。作为驱动海洋碳循环生物泵和微生物泵的“引擎”,微藻在蓝碳中的地位举足轻重。微藻通过光合作用捕集大气中的CO2,通过碳沉积和微食物环将有机碳转移至深层海水或海洋水柱中长期贮存。基于文献计量的可视化分析表明,海洋微藻的固碳作用受CO2浓度、光照、温度和海洋酸化的影响,其中CO2浓度的波动不仅在微观尺度上影响了微藻的初级生产力和有机碳迁移过程等,还在宏观尺度上影响了海洋碳通量和生物泵功能。微藻对气温升高的响应则主要表现在中等尺度的生态群落上,如微藻与细菌群落结构等。微藻与细菌之间相互影响、协同变化的关系决定了碳在海洋水柱中的分布与沉积,提高细菌对微藻基碳源的可利用性有利于增加海洋碳汇。全球气候变化和人类活动干扰下,海洋微藻和细菌群落结构与组成会发生变化,在此情形下的微藻-细菌耦合关系和碳流途径将是海洋碳汇研究的重要方向之一。
参考文献
[1]焦念志.研发海洋“负排放”技术支撑国家“碳中和”需求[J].中国科学院院刊,2021,36(2):179-187.
[2] BOYD P W,CLAUSTRE H,LEVY M,et al.Multi-faceted particle pumps drive carbon sequestration in the ocean[J].Nature,2019,568(7752):327-335.
[3] FRIEDLINGSTEIN P,O'SULLIVAN M,JONES M W,et al.Global carbon budget 2020[J].Earth system science data,2020,12(4):3269-3340.
[4] 焦念志,梁彥韬,张永雨,等.中国海及邻近区域碳库与通量综合分析[J].中国科学:地球科学,2018,48(11):1393-1421.
[5] 段克,刘峥延,李刚,等.滨海蓝碳生态系统保护与碳交易机制研究[J].中国国土资源经济,2021,34(12):37-47.
[6] 李静,温国义,杨晓飞,等.海洋碳汇作用机理与发展对策[J].海洋开发与管理,2018,35(12):11-15.
[7] CHISHOLM S W.Stirring times in the Southern Ocean[J].Nature,2000,407(6805):685-687.
[8] JIAO N Z,HERNDL G J,HANSELL D A,et al.Microbial production of recalcitrant dissolved organic matter:Long-term carbon storage in the global ocean[J].Nature reviews microbiology,2010,8(8):593-599.
[9] 张瑶,赵美训,崔球,等.近海生态系统碳汇过程、调控机制及增汇模式[J].中国科学:地球科学,2017,47(4):438-449.
[10] ANDERSON T R,TANG K W.Carbon cycling and POC turnover in the mesopelagic zone of the ocean:Insights from a simple model[J].Deep sea research part II:Topical studies in oceanography,2010,57(16):1581-1592.
[11] 焦念志,骆庭伟,张瑶,等.海洋微型生物碳泵:从微型生物生态过程到碳循环机制效应[J].厦门大学学报(自然科学版),2011,50(2):387-401.
[12] HERNDL G J,REINTHALER T.Microbial control of the dark end of the biological pump[J].Nature geoscience,2013,6(9):718-724.
[13] COLLINS S,ROST B,RYNEARSON T A.Evolutionary potential of marine phytoplankton under ocean acidification[J].Evolutionary applications,2014,7(1):140-155.
[14] BASU S,MACKEY K.Phytoplankton as key mediators of the biological carbon pump:Their responses to a changing climate[J].Sustainability,2018,10(3):1-18.
[15] SANDERS R,HENSON S A,KOSKI M,et al.The biological carbon pump in the North Atlantic[J].Progress in oceanography,2014,129:200-218.
[16] BOYD P W.Toward quantifying the response of the oceans' biological pump to climate change[J].Frontiers in marine science,2015,2:1-15.
[17] 李珂,李清毅,郭文文,等.高碳与光调控对微藻捕集CO2的影响机制[J].化工进展,2020,39(11):4600-4607.
[18] GAO K S,ZHANG Y,HDER D P.Individual and interactive effects of ocean acidification,global warming,and UV radiation on phytoplankton[J].Journal of applied phycology,2018,30(2):743-759.
[19] BARTON S,JENKINS J,BUCKLING A,et al.Evolutionary temperature compensation of carbon fixation in marine phytoplankton[J].Ecology letters,2020,23(4):722-733.
[20] BOYCE D G,LEWIS M R,WORM B.Global phytoplankton decline over the past century[J].Nature,2010,466(7306):591-596.
[21] VAN DE WAAL D B,LITCHMAN E.Multiple global change stressor effects on phytoplankton nutrient acquisition in a future ocean[J].Philosophical transactions of the royal society B:Biological sciences,2020,375(1798):1-8.
[22] GREBMEIER J M,MOORE S E,OVERLAND J E,et al.Biological response to recent Pacific Arctic Sea ice retreats[J].Eos,transactions American gophysical union,2010,91(18):161-162.
[23] DONEY S C,RUCKELSHAUS M,DUFFY J E,et al.Climate change impacts on marine ecosystems[J].Annual review of marine science,2012,4:11-37.
[24] SHEN M C,YE S J,ZENG G M,et al.Can microplastics pose a threat to ocean carbon sequestration?[J].Marine pollution bulletin,2020,150:1-3.
[25] SIMEK K,NEDOMA J,ZNACHOR P,et al.A finely tuned symphony of factors modulates the microbial food web of a freshwater reservoir in spring[J].Limnology and oceanography,2014,59(5):1477-1492.
[26] CAMARENA-GMEZ M T,LIPSEWERS T,PIIPARINEN J,et al.Shifts in phytoplankton community structure modify bacterial production,abundance and community composition[J].Aquatic microbial ecology,2018,81(2):149-170.
[27] TEIRA E,SERRET P,FERNNDEZ E.Phytoplankton size-structure,particulate and dissolved organic carbon production and oxygen fluxes through microbial communities in the NW Iberian coastal transition zone[J].Marine ecology progress series,2001,219:65-83.
[28] BENEDIKT M,DAVID L K.Dynamics and molecular composition of dissolved organic material during experimental phytoplankton blooms[J].Marine chemistry,2001,75(3):185-199.
[29] 焦念志,張传伦,李超,等.海洋微型生物碳泵储碳机制及气候效应[J].中国科学:地球科学,2013,43(1):1-18.
[30] FUHRMAN J A,AZAM F.Thymidine incorporation as a measure of heterotrophic bacterioplankton production in marine surface waters:Evaluation and field results[J].Marine biology,1982,66(2):109-120.
[31] GONZLEZ-OLALLA J M,MEDINA-SNCHEZ J M,LOZANO I L,et al.Climate-driven shifts in algal-bacterial interaction of high-mountain lakes in two years spanning a decade[J].Scientific reports.2018,8(1):1-12.
[32] COALE K H,FITZWATER S E,GORDON R M,et al.Control of community growth and export production by upwelled iron in the equatorial Pacific Ocean[J].Nature,1996,379(6566):621-624.
[33] VRASPIR J M,BUTLER A.Chemistry of marine ligands and siderophores[J].Annual review of marine science,2009,1:43-63.
[34] 王慧,蔡潤林,甘永亮,等.海洋浮游植物和藻际细菌的相互作用关系及其在海洋生态系统中的重要作用[J].汕头大学学报(自然科学版),2022,37(3):3-21.
[35] FOUILLAND E,MOSTAJIR B.Revisited phytoplanktonic carbon dependency of heterotrophic bacteria in freshwaters,transitional,coastal and oceanic waters[J].FEMS microbiology ecology,2010,73(3):419-429.
[36] PAVER S F,KENT A D.Direct and context-dependent effects of light,temperature,and phytoplankton shape bacterial community composition[J].Ecosphere,2017,8(9):1-14.
[37] GU L Y,WYATT K H.Light availability regulates the response of algae and heterotrophic bacteria to elevated nutrient levels and warming in a northern boreal peatland[J].Freshwater biology,2016,61(9):1442-1453.
[38] MANNING D W P,ROSEMOND A D,GULIS V,et al.Nutrients and temperature additively increase stream microbial respiration[J].Global change biology,2018,24(1):e233-e247.
[39] POPE C A,HALVORSON H M,FINDLAY R H,et al.Light and temperature mediate algal stimulation of heterotrophic activity on decomposing leaf litter[J].Freshwater biology,2020,65(7):1210-1222.
[40] KUEHN K A,FRANCOEUR S N,FINDLAY R H,et al.Priming in the microbial landscape:Periphytic algal stimulation of litter-associated microbial decomposers[J].Ecology,2014,95(3):749-762.
[41] PIWOSZ K,VRDOLJAK A,FRENKEN T,et al.Light and primary production shape bacterial activity and community composition of aerobic anoxygenic phototrophic bacteria in a microcosm experiment[J].Msphere,2020,5(4):1-100.
[42] FOUILLAND E,TOLOSA I,BONNET D,et al.Bacterial carbon dependence on freshly produced phytoplankton exudates under different nutrient availability and grazing pressure conditions in coastal marine waters[J].FEMS microbiology ecology,2014,87(3):757-769.
[43] MORAN M A,KUJAWINSKI E B,STUBBINS A,et al.Deciphering ocean carbon in a changing world[J].Proceedings of the national academy of sciences of the United States of America,2016,113(12):3143-3151.
[44] LANDA M,BURNS A S,ROTH S J,et al.Bacterial transcriptome remodeling during sequential co-culture with a marine dinoflagellate and diatom[J].ISME journal,2017,11(12):2677-2690.
[45] AVCI B,KRGER K,FUCHS B M,et al.Polysaccharide niche partitioning of distinct Polaribacter clades during North Sea spring algal blooms[J].ISME journal,2020,14(6):1369-1383.
[46] FERRER-GONZLEZ F X,WIDNER B,HOLDERMAN N R,et al.Resource partitioning of phytoplankton metabolites that support bacterial heterotrophy[J].ISME journal,2021,15(3):762-773.
