纳米氧化铈在阿霉素诱导心脏毒性中的作用及其对P53基因表达的影响
2024-03-08李俊奇韩轩茂蔺雪峰袁敏
李俊奇 韩轩茂 蔺雪峰 袁敏
[摘要] 目的 研究納米氧化铈在阿霉素心脏毒性损伤中的作用及其对P53基因表达的影响,探讨纳米氧化铈对阿霉素心脏毒性损伤的作用机制。方法 培养H9C2心肌细胞,随机分为5组:对照组、模型组(1μmol/L阿霉素)、纳米氧化铈组(10μg/ml纳米氧化铈)、实验组(1μmol/L阿霉素+10μg/ml纳米氧化铈)、阳性对照组(1μmol/L阿霉素+10μmol/L右丙亚胺)。建立阿霉素心脏毒性损伤模型,CCK-8法检测心肌细胞的存活率;生化法检测心肌细胞内乳酸脱氢酶(lactic dehydrogenase,LDH)、丙二醛(malondialdehyde,MDA)的含量;流式细胞仪检测心肌细胞内活性氧(reactive oxygen,ROS)水平及细胞凋亡率;Western blot检测心肌细胞中Bax、Bcl-2及P53蛋白的表达。结果 与对照组相比,模型组的细胞存活率下降,细胞LDH、MDA含量上升,细胞内ROS水平和凋亡率增加,Bax和P53蛋白表达量升高,Bcl-2蛋白表达量下降,且Bcl-2/Bax比值下降(均P<0.001);与模型组相比,实验组细胞存活率上升,细胞LDH、MDA含量下降,细胞ROS含量和凋亡率下降,Bax和P53蛋白表达量降低,Bcl-2蛋白表达量升高,且Bcl-2/Bax比值升高(均P<0.001)。结论 纳米氧化铈能有效预防阿霉素诱导的心脏毒性损伤,其作用可能与下调P53基因的表达,抑制细胞凋亡相关。
[关键词] 纳米氧化铈;阿霉素;心脏毒性;P53基因;细胞凋亡
[中图分类号] R541.9 [文献标识码] A [DOI] 10.3969/j.issn.1673-9701.2024.05.015
Role of cerium oxide nanoparticles in doxorubicin-induced cardiotoxicity and its effect on P53 gene expression
LI Junqi1,2, HAN Xuanmao2, LIN Xuefeng2, YUAN Min1,2
1.Baotou Medical College, School of Graduate Studies, Baotou 014000, Inner Mongolia, China; 2.the First Department of Cardiology, the First Affiliated Hospital of Baotou Medical College, Inner Mongolia University of Science and Technology, Baotou 014000, Inner Mongolia, China
[Abstract] Objective To study the effect of nano-ceria on doxorubicin-induced cardiotoxic injury and its effect on P53 gene expression, and to explore the mechanism of nano-ceria on doxorubicin-induced cardiotoxic injury. Methods H9C2 myocardial cells were cultured and randomly divided into five groups: control group, model group (1μmol/L adriamycin), nano-cerium oxide group (10μg/ml nano-cerium oxide), experimental group (1μmol/L adriamycin +10μg/ml nano-cerium oxide), and positive control group (1μmol/L adriamycin+10μmol/L dexperimine). The adriamycin induced cardiotoxicity model was established, and the viability of myocardial cells was measured by CCK-8 method. The contents of lactate dehydrogenase (LDH) and malondialdehyde (MDA) in myocardial cells were detected by biochemical method. The levels of reactive oxygen (ROS) and the apoptosis rate in myocardial cells were detected by flow cytometry. The expressions of Bax, Bcl-2 and P53 proteins in myocardial cells were detected by Western blot. Results Compared with the control group, the cell viability was decreased in the model group, the cell LDH and MDA contents were increased, the intracellular ROS level and apoptosis rate were increased, the expressions of Bax and P53 proteins were increased, and the expression of Bcl-2 protein was decreased, and the ratio of Bcl-2/Bax was decreased (all P<0.001). Compared with the model group, the experimental group showed increased cell viability, decreased cell LDH and MDA contents, decreased cell ROS content and apoptosis rate, decreased Bax and P53 protein expressions, and increased Bcl-2 protein expression, and the Bcl-2/Bax ratio was increased (all P<0.001). Conclusion Ceria nanoparticles can effectively prevent adriamycin-induced cardiotoxic injury, and its effect may be related to the down-regulation of P53 gene to inhibit cardiomyocyte apoptosis.
[Key words] Cerium oxide nanoparticles; Anthracyclines; Cardiotoxicity; P53 gene; Apoptosis
蒽环类药物是一类抗肿瘤药物,包括阿霉素(doxorubicin,DOX)、表阿霉素和柔红霉素等,因不可替代的疗效,是目前肿瘤药物化疗中最有效和最广泛的药物[1-2]。然而,蒽环类药物被证明存在不可忽视的剂量依赖性心脏毒性,会导致不同程度的心肌收缩功能障碍,进一步发展为心肌病,最终导致心力衰竭,使蒽环类药物的临床应用受到严重限制[3-4]。细胞凋亡是蒽环类药物心脏毒性的重要机制之一,P53基因在调控细胞凋亡信号通路中发挥着至关重要的作用[5-7]。
最近,纳米材料和稀有金属在生物医学领域表现出良好的应用前景,且开发更加安全有效地预防保护蒽环类药物心脏毒性的药物已成为目前的研究热点[8-9]。纳米氧化铈(cerium oxide nanoparticles,CeO2NPs)是一种稀有金属氧化物颗粒,既具有稀有金属的特性又具备纳米材料的优势,研究发现,纳米氧化铈具有自主价态转换能力和酶模仿活性等特点,可缓解心肌缺血再灌注损伤导致的心肌细胞凋亡[10-12]。本研究通过建立蒽环类药物心脏毒性损伤模型,证明纳米氧化铈在阿霉素心脏毒性中的作用,并通过观察P53基因的表达,探讨纳米氧化铈对阿霉素心脏毒性的作用机制。
1 材料与方法
1.1 细胞
H9C2大鼠心肌细胞株购自武汉普诺赛生命科技有限公司,批号CL-0089,培养于内蒙古包头医学院转化医学中心细胞培养箱内,温度37℃,氧气浓度21%,二氧化碳浓度5%。
1.2 药物与试剂
氧化铈(<25nm,美国Sigma-Aldrich公司);盐酸阿霉素、右丙亚胺(dextrazoxane,Dex)盐酸盐(上海源叶生物公司);DMEM高糖培养基(美国Gibco公司);CCK-8检测试剂盒、细胞凋亡检测试剂盒(上海碧云天生物公司);ROS检测试剂盒(上海翊圣生物公司);乳酸脱氢酶(lactic dehydrogenase,LDH)、丙二醛(malondialdehyde,MDA)检测试剂盒(南京建成生物公司);抗-GAPDH、山羊抗兔IgG(北京博奥森生物公司);Bax多克隆抗体、Bcl-2兔多克隆抗体(美国Signalway Antibody公司);p53抗体(美国AffinitY公司)。
1.3 仪器与设备
细胞CO2培养箱(日本松下公司);倒置光学显微镜(日本奥林巴斯公司);L530R型离心机(湖南湘仪仪器公司);KQ2200DE型数控超声波清洗器(中国昆山公司);ELx-808型酶标仪(美国伯腾仪器公司);流式细胞仪(美国安捷伦科技公司);JYD-650型超声波细胞破碎仪(上海之信仪器公司);DYY-7C型电泳仪电源(北京六一仪器厂);DYCZ-24DN型迷你电泳槽(北京六一仪器厂);JY-ZY5型湿转转印系统槽(北京君意东方电泳设备公司);M1703940型半干转印系统槽(美国伯乐Bio-Rad公司);TVO.63XC-MO型成像系统(广州市明美科技公司)。
1.4 造模与干預
正常培养细胞,将生长状态良好的H9C2心肌细胞随机分成5组:(1)正常对照组:用含正常培养基在细胞培养箱中培养24h;(2)模型组:用含1μmol/L阿霉素的培养基在细胞培养箱中处理细胞24h;(3)纳米氧化铈组:用含10μg/ml纳米氧化铈的培养基在细胞培养箱中处理细胞24h;(4)实验组:用含1μmol/L阿霉素和10μg/ml纳米氧化铈的混合培养基在细胞培养箱中共同处理细胞24h;(5)阳性对照组:用含10μmol/L右丙亚胺和1μmol/L阿霉素的混合培养基在细胞培养箱中共同处理细胞24h。
1.5 CCK-8法检测
H9C2细胞在96孔板中按照实验分组药物处理24h,除去孔内旧培养基,向每孔加入含有100μl培养基和10μl CCK-8继续孵育4h,孵育结束后置于酶标仪450nm处检测吸光度(A值)。
1.6 LDH活性检测
H9C2细胞以1×105 cell/mL的密度接种到6孔板中,按照实验分组药物处理24h,收集细胞到离心管内,离心后弃上清,加入提取液后重悬细胞沉淀,冰上超声波破碎细胞(功率200W,超声3s间隔10s,重复3次);8000g 4℃低温离心机离心10min,取上清置于冰上待测。酶标仪预热30min以上,调节波长至450nm下测定A值。
1.7 MDA含量检测
H9C2细胞以1×105 cell/mL密度接种到6孔板中,按照实验分组药物处理24h,使用细胞裂解液裂解细胞,12 000g离心10min,取上清加入200μL MDA检测工作液,混匀后100℃水浴加热15min。水浴后冷却至室温,1000g室温离心10min,取200μL上清加入到96孔板中,酶标仪预热30min后在酶标仪532nm处测定吸光度(A值)。
1.8 活性氧(reactive oxygen,ROS)测定
H9C2细胞以1×105 cell/ml密度接种到6孔板中,按照实验分组药物处理24h,弃去旧培养基,用不含血清及双抗的纯细胞培养基洗涤1次,每孔加入的20μmol/L DCFH-DA 1ml,37 ℃下孵育20min,中间每隔5min晃匀1次,使探针充分与细胞接触。PBS洗涤3次去除多余的DCFH-DA探针,最后用流式细胞仪检测在488nm激发波长和535nm发射波长处的荧光信号强度。
1.9 细胞凋亡检测
H9C2细胞以1×105 cell/ml密度接种到6孔板中,按照实验分组药物处理24h,除去旧培养基,使用不含EDTA 的胰酶消化细胞1.5min,加入完全培养基终止消化,将细胞吹打下来,转移至EP离心管内,800g离心5min收集细胞沉淀。加入PBS溶液中继续吹打洗涤2次,同样条件下离心收集细胞沉淀。于细胞沉淀中加入1×缓冲液工作液,吹打重悬细胞沉淀,使细胞浓度达到1×106 cell/mL。吸取100μl至新的EP离心管中,加入5μl Annexin V-FITC和10μl PI,轻轻混匀后室温避光孵育20min后,管内加入400μl 1×缓冲液工作液,震荡混匀使用流式细胞仪尽快检测。
1.10 Western blot法检测
将实验各组细胞经裂解液裂解后,冰浴静置20min,混匀后4℃,12000r/min离15min后取上清液,BCA法进行蛋白定量。上样缓冲液与适当蛋白匀浆混匀后,置于沸水中加热10min后冷却至室温,以凝胶电泳分离并转膜,TBST洗膜5min,5%脱脂奶粉,4℃过夜。加入稀释的相应一抗(P53、Bcl-2、Bax抗体均按照1∶1000比例稀释,GAPDH 1∶2000),摇床孵育2h,TBST洗膜3次,每次5min。加入二抗(1∶1000)配制进行37℃摇床孵育1h,TBST洗膜3次,每次5min,结束后显色,测量条带灰度值,并以目标条带与内参条带灰度的比值反映目标蛋白的表达情况。
1.11 统计学方法
采用SPSS 22.0统计学软件对数据进行处理分析,实验结果均以均数±标准差(![]() )表示,单因素方差分析(ANOVA)分析组间差异,采用GraphPad Prism 7.0进行分析与制图,以P<0.05为差异有统计学意义。
)表示,单因素方差分析(ANOVA)分析组间差异,采用GraphPad Prism 7.0进行分析与制图,以P<0.05为差异有统计学意义。
2 结果
2.1 纳米氧化铈对阿霉素心脏毒性损伤细胞活力的影响
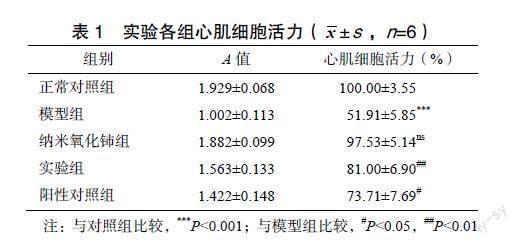
CCK-8实验结果显示,与对照组相比,模型组细胞存活率下降;与模型组相比,实验组细胞存活率上升差异有统计学意义(P<0.01),見表1。
2.2 纳米氧化铈对阿霉素心脏毒性损伤细胞内氧化应激的水平
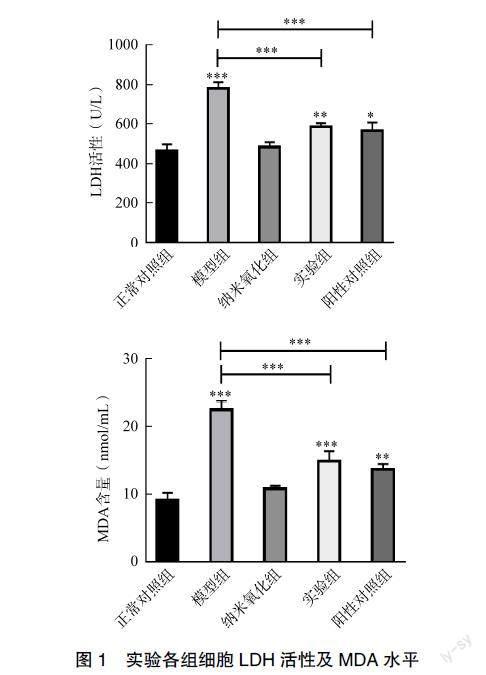
与正常对照组相比,模型组细胞LDH、MDA含量上升(P<0.001);与模型组相比,实验组细胞LDH、MDA含量下降有统计学意义(P<0.001),见图1。
2.3 纳米氧化铈对阿霉素心脏毒性损伤细胞Bax、Bcl-2、P53蛋白表达的影响
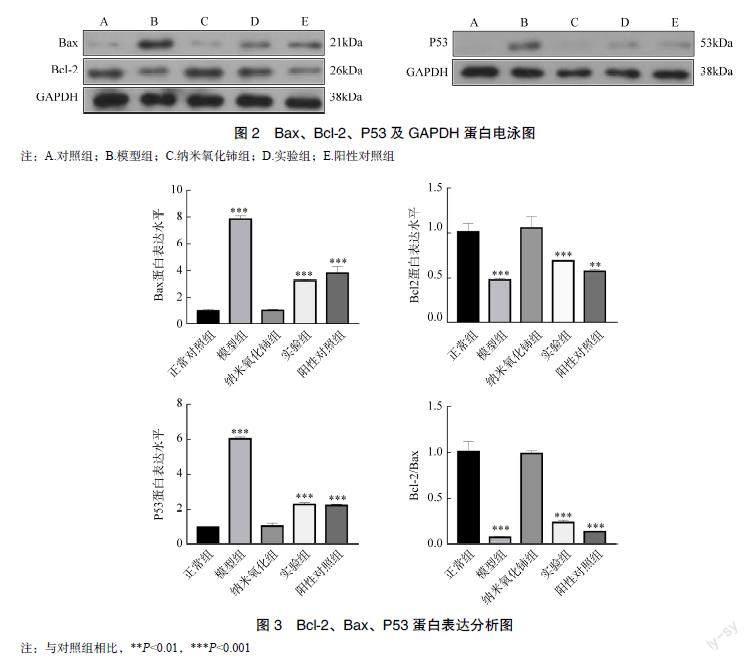
Western blot法检测结果显示,与正常对照组相比,模型组Bax、P53蛋白表达量升高,Bcl-2蛋白表达量下降,且Bcl-2/Bax比值下降(均P<0.001);与模型组相比,实验组Bax、P53蛋白表达量降低,Bcl-2蛋白表达量升高且Bcl-2/Bax比值升高(均P<0.001),见图2、图3。
2.4 纳米氧化铈对阿霉素心脏毒性损伤细胞凋亡的影响
与正常对照组相比,模型组活细胞数量减少,细胞凋亡比重明显升高;与模型组相比,实验组活细胞数量增加,细胞凋比重下降,差异有统计学意义(均P<0.001),见图4。
2.5 纳米氧化铈对阿霉素心脏毒性损伤细胞ROS水平的影响
与正常对照组相比,模型组的细胞ROS水平升高(P<0.001),与模型组相比,实验组的ROS水平下降(P<0.001),差异有统计学意义(图5)。
3 讨论
阿霉素诱导心脏毒性最常见的机制之一是氧化应激和细胞凋亡,即阿霉素引起心肌细胞氧化应激后,会产生ROS、MDA、LDH等氧化应激产物[5]。由于心肌细胞的不可再生性,一旦这些氧化应激产物超过正常水平,就会对心肌细胞产生损伤,进而导致心肌细胞凋亡[13-14]。本研究经阿霉素处理后的心肌细胞活力降低、LDH和MDA含量增加、ROS水平升高。证明氧化应激参与了阿霉素诱导的心脏毒性。
目前纳米氧化铈已成为各领域广泛关注的新兴材料,在纳米氧化铈的分子结构中,铈离子通常以稳定的Ce4+价形式存在,在正常条件下形成立方晶格结构(萤石型),晶格中的氧不稳定易脱落,形成氧空缺[15-17]。为了维持晶格结构中电荷平衡,会有一部分的Ce4+转化为Ce3+,然而Ce3+在有氧条件下具有还原性,会在氧气中又被氧化成Ce4+,这一循环正是纳米氧化铈具有抗氧化能力的原因[18]。本实验研究结果表明,单加纳米氧化铈组的细胞活力、LDH和MDA含量、细胞内ROS水平均无明显差异(P>0.05),证明纳米氧化铈在此浓度下无毒性;阿霉素与纳米氧化铈共处理组细胞活力上升、LDH和MDA含量下降、ROS水平降低。证明纳米氧化铈能够降低阿霉素诱导的氧化应激损伤,进而减轻蒽环类药物的心脏毒性。
P53基因通过Bax/Bcl-2,Fas/Apol,IGF-BP-3等蛋白,可发挥对细胞凋亡的调控作用[19-21]。Bcl-2 可阻止凋亡形成因子如细胞色素C等从线粒体释放出来,具有抗凋亡作用;而Bax可与线粒体上的电压依赖性离子通道相互作用,介导细胞色素C的释放,具有凋亡作用,P53可以上调Bax的表达水平,以及下调Bcl-2的表达共同完成促进细胞凋亡作用[22-23]。本实验研究结果表明,阿霉素组的Bax、P53表达量增加,Bcl-2蛋白表达量降低,Bcl-2/Bax蛋白比值减小,流式检测凋亡比重升高;证明阿霉素使心肌细胞发生了凋亡。阿霉素与纳米氧化铈共处理组的Bax、P53表达量下降,Bcl-2蛋白表达量上升,Bcl-2/Bax蛋白比值增大,流式细胞仪检测细胞凋亡比重降低。由此证明,纳米氧化铈可能通过下调P53、Bax以及上调Bcl-2,抑制蒽环类诱导的细胞凋亡。
綜上所述,纳米氧化铈可减轻阿霉素引起的心肌细胞氧化应激和细胞凋亡,抑制蒽环类药物的心脏毒性;本实验发现,纳米氧化铈能够下调P53的表达,抑制阿霉素诱导的细胞凋亡,因此,纳米氧化铈对蒽环类药物心脏毒性的保护作用可能与P53的表达有关。
利益冲突:所有作者均声明不存在利益冲突。
[参考文献]
[1] MARTINS-TEIXEIRA M B, CARVALHO I. Antitumour anthracyclines: progress and perspectives[J]. Chem Med Chem, 2020, 15(11): 933–948.
[2] JASRA S, ANAMPA J. Anthracycline use for early stage breast cancer in the modern era: a review[J]. Curr Treat Options Oncol, 2018, 19(6): 30.
[3] NICOLAZZI M A, CARNICELLI A, FUORLO M, et al. Anthracycline and trastuzumab-induced cardiotoxicity in breast cancer[J]. Eur Rev Med Pharmacol Sci, 2018, 22(7): 2175–2185.
[4] JAIN D, ARONOW W. Cardiotoxicity of cancer chemotherapy in clinical practice[J]. Hosp Pract (1995), 2019, 47(1): 6–15.
[5] NEBIGIL C G, DESAUBRY L. Updates in anthracycline mediated cardiotoxicity[J]. Front Pharmacol, 2018, 9: 1262.
[6] ICHIKAWA Y, GHANEFAR M, BAYEVA M, et al. Cardiotoxicity of doxorubicin is mediated through mitochondrial iron accumulation[J]. J Clin Invest, 2014, 124(2): 617–630.
[7] SABAPATHY K, LANE D P. Understanding p53 functions through p53 antibodies[J]. J Mol Cell Biol, 2019, 11(4): 317–329.
[8] NEFEDOVA A, RAUSALU K, ZUSINAITE E, et al. Antiviral efficacy of cerium oxide nanoparticles[J]. Sci Rep, 2022, 12(1): 18746.
[9] CHARBGOO F, AHMAD M B, DARROUDI M. Cerium oxide nanoparticles: green synthesis and biological applications[J]. Int J Nanomedicine, 2017, 12: 1401–1413.
[10] DAS S, DOWDING J M, KLUMP K E, et al. Cerium oxide nanoparticles: applications and prospects in nanomedicine[J]. Nanomedicine (Lond), 2013, 8(9): 1483–1508.
[11] KIM J, HONG G, MAZALEUSKAYA L, et al. Ultrasmall antioxidant cerium oxide nanoparticles for regulation of acute inflammation[J]. ACS Appl Mater Interfaces, 2021, 13(51): 60852–60864.
[12] BALDIM V, BEDIOUI F, MIGNET N, et al. The enzyme-like catalytic activity of cerium oxide nanoparticles and its dependency on Ce(3+) surface area concentration[J]. Nanoscale, 2018, 10(15): 6971–6980.
[13] BHAGAT A, SHRESTHA P, KLEINERMAN E S. The innate immune system in cardiovascular diseases and its role in doxorubicin-induced cardiotoxicity[J]. Int J Mol Sci, 2022, 23(23).
[14] CHEN Y, SHI S, DAI Y. Research progress of therapeutic drugs for doxorubicin-induced cardiomyopathy[J]. Biomed Pharmacother, 2022, 156: 113903.
[15] KONG C Y, GUO Z, SONG P, et al. Underlying the mechanisms of doxorubicin-induced acute cardiotoxicity: oxidative stress and cell death[J]. Int J Biol Sci, 2022, 18(2): 760–770.
[16] NIU J, WANG K, KOLATTUKUDY P E. Cerium oxide nanoparticles inhibit oxidative stress and nuclear factor-kappa B activation in H9c2 cardiomyocytes exposed to cigarette smoke extract[J]. J Pharmacol Exp Ther, 2011, 338(1): 53–61.
[17] WU Y, YANG Y, ZHAO W, et al. Novel iron oxide-cerium oxide core-shell nanoparticles as a potential theranostic material for ROS related inflammatory diseases[J]. J Mater Chem B, 2018, 6(30): 4937–4951.
[18] SANGOMLA S, SAIFI M A, KHURANA A, et al. Nanoceria ameliorates doxorubicin induced cardiotoxicity: Possible mitigation via reduction of oxidative stress and inflammation[J]. J Trace Elem Med Biol, 2018, 47: 53–62.
[19] NAGPAL I, YUAN Z M. The basally expressed p53-mediated homeostatic function[J]. Front Cell Dev Biol, 2021, 9: 775312.
[20] CHEN D, ZHENG X, KANG D, et al. Apoptosis and expression of the Bcl-2 family of proteins and P53 in human pancreatic ductal adenocarcinoma[J]. Med Princ Pract, 2012, 21(1): 68–73.
[21] WU S, LAN J, LI L, et al. Sirt6 protects cardiomyocytes against doxorubicin induced cardiotoxicity by inhibiting P53/Fas-dependent cell death and augmenting endogenous antioxidant defense mechanisms[J]. Cell Biol Toxicol, 2021, 39(1): 237–258.
[22] SHEN Y, WHITE E. p53-dependent apoptosis pathways[J]. Adv Cancer Res, 2001, 82: 55–84.
[23] MORADIPOUR A, DARIUSHNEJAD H, AHMADIZADEH C, et al. Dietary flavonoid carvacrol triggers the apoptosis of human breast cancer MCF-7 cells via the p53/Bax/Bcl-2 axis[J]. Med Oncol, 2022, 40(1): 46.
(收稿日期:2023–04–09)
(修回日期:2023–11–16)
