赤芍抗炎活性的物质基础及作用机制研究进展
2024-03-07倪嘉挺袁旭曹庆宇庞成国陈元金韩华董培良
倪嘉挺,袁旭,曹庆宇,庞成国,陈元金,韩华✉,董培良
(1. 黑龙江中医药大学,黑龙江 哈尔滨 150040;2. 黑龙江中医药大学中医药研究院,黑龙江 哈尔滨 150040)
炎症是一种复杂的生物学反应,是机体对损伤、感染或刺激的一种非特异性防御性反应。炎症反应包括血管扩张、渗出和组织细胞的移动,并伴随着局部的红、肿、热、痛等症状。炎症反应通常对机体是有利的,然而严重的炎症可能会危及生命安全。研究表明,关节炎、角膜炎、高血糖、高血压和癌症等诸多疾病都与炎症反应有密切的联系。
赤芍为毛茛科植物芍药(PaeonialactifloraPall)或川赤芍(PaeoniaveitchiiLynch)的干燥根。其味苦,性微寒,具有清热凉血,散瘀止痛的功效[1]。目前赤芍在临床上常用于治疗胰腺炎、肝炎和腮腺炎等疾病[2-4]。相关研究表明,赤芍的多个化学成分对炎症均有一定的治疗作用[5]。因此,本文通过对近期国内外赤芍抗炎活性的物质基础及其作用机制方面的相关文献进行收集和整理,探索赤芍发挥抗炎作用的主要活性成分及靶点通路,以期为赤芍抗炎作用的进一步研究及抗炎药物的研发提供思路和参考。
1 赤芍抗炎活性物质基础
赤芍中含有多种活性成分,如萜类、挥发油、酚酸、黄酮类、鞣质等,均可发挥抗炎作用,用于各种炎症性疾病的治疗。赤药发挥抗炎作用的主要活性成分见表1。
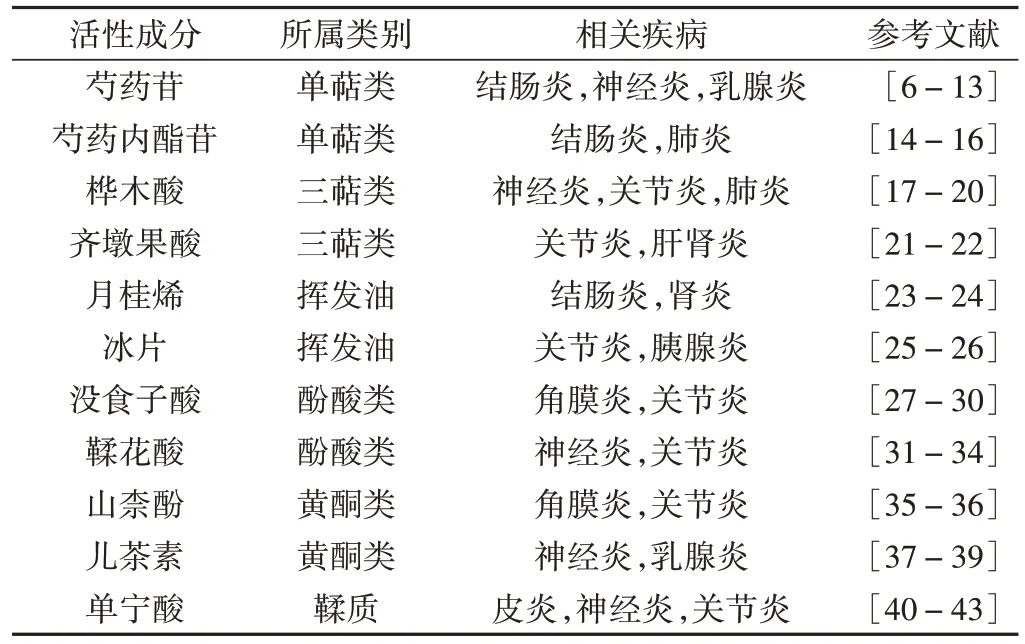
表1 赤芍发挥抗炎作用的主要活性成分
1.1 萜类
萜类化合物是一类由甲戊二羟酸衍生而来且分子结构以异戊二烯单元为基本构成单元的化合物,是赤芍的主要化学成分之一。目前在赤芍中已鉴定得到64种单萜类化合物以及27种三萜类化合物[5]。
1.1.1 芍药苷
芍药苷作为赤芍的主要标志物之一,在萜类化学物中成分含量高,且具有良好的药理活性。化学结构见图1。芍药苷能够减少LPS对小鼠脑组织的损伤,降低MPO、iNOS的活性,同时降低TNF-α、IL-1β及NO的产生,通过抑制NF-κB 信号通路发挥抗炎作用[6];芍药苷还能通过抑制NF-κB 信号通路降低COX2 蛋白酶活性,从而实现对溃疡性结肠炎的治疗效果[7-9]。在LPS 诱导的A549 细胞炎性损伤模型中,芍药苷可以促进自噬体形成,增加LC3Ⅱ的表达,降低p62的表达,从而抑制IL-1β、IL-6和TNF-α的产生。可见,芍药苷能通过AMPK/mTOR信号通路发挥抗炎作用[10]。
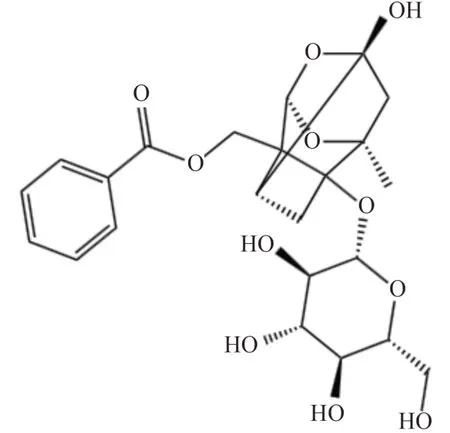
图1 芍药苷化学结构
芍药苷可以抑制LPS诱导的小胶质细胞神经炎症中炎症介质NO、IL-1β 和TNF-α 的产生,从而发挥抗炎作用[11]。在乳腺炎小鼠模型中,芍药苷能够抑制细胞焦亡的发生,进而起到抗炎的效果,其可通过抑制Caspase-1、Caspase-11、NLRP3、GSDMD 等关键因子的激活,以及减少IL-18、IL-1β、LDH 等炎性因子的释放来实现这一作用[12]。此外,芍药苷还可以抑制高糖诱导的SV40 MES 13 细胞的炎症反应,减少IL-6、IL-1β、TNF-α 的产生,其抗炎机制可能与抑制ERK/p38MAPK信号通路的激活有关[13]。
1.1.2 芍药内酯苷
芍药内酯苷也是赤芍主要的抗炎活性成分之一,能够有效的缓解炎症症状。化学结构见图2。黄梅等[14]采用TNBS 和乙醇混合液灌肠的方式建立大鼠溃疡性结肠炎模型,发现芍药内酯苷能够有效地抑制IL-1β、TNF-α 和COX-2 的表达,同时降低MDA活性并提高SOD活性,芍药内酯苷的抗炎作用与NFκB/COX-2信号通路有关。WANG 等[15]采用DSS诱导小鼠急性结肠炎模型,发现芍药内酯苷可以抑制骨髓过氧化物酶的活性,降低免疫炎症反应,并提高结肠组织中的Foxp3 mRNA水平,芍药内酯苷可以抑制肾上腺素同源异构体,激活磷酸化的NF-κBp65 和IκBα,从而抑制磷酸化的p38MAPK、ERK 和JNK,其抗炎机制可能与抑制NF-κB和MAPK信号通路激活有关。
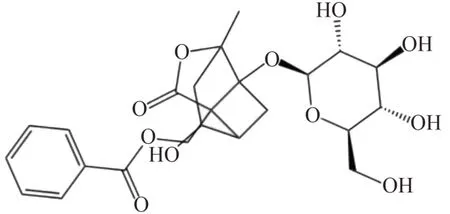
图2 芍药内酯苷化学结构
CAI 等[16]采用OVA 诱导哮喘小鼠肺部炎症模型,芍药内酯苷可明显减少哮喘小鼠模型外周血嗜酸性粒细胞数量、肺和BLALF 中的炎症细胞因子,芍药内酯苷可降低炎症相关因子IL-1β、IL-6、TNF-α 的表达,减少磷酸化的JNK、ERK、p38、NF-κBp65 和IκBα的表达,表明芍药内酯苷可能通过MAPK/NF-κB 信号通路发挥抗炎作用。
1.1.3 桦木酸
桦木酸化学结构见图3。LI 等[17]采用LPS 诱导BV-2 小胶质细胞神经炎症模型,发现桦木酸可以促进BV-2小胶质细胞的M2极化,抑制M1极化,进一步的研究表明桦木酸通过激活CaMKKβ依赖的AMPK 通路发挥抗神经炎症作用。此外,桦木酸可以显著下调TNF-α 诱导的类风湿关节炎成纤维样滑膜细胞中IL-1β、IL-6、IL-8和IL-17A mRNA表达,进一步的研究表明桦木酸可能通过阻断NF-κB、IκBα和IKK信号通路来减少炎症介质的产生,从而发挥抗炎作用[18]。

图3 桦木酸化学结构
有研究者采用CLP诱导脓毒性急性肺损伤模型,发现10 mg/kg和30 mg/kg 剂量的桦木酸能显著减轻肺损伤,改善肺组织病理变化并减少蛋白质和中性粒细胞浸润,进一步的研究表明,桦木酸具有降低细胞因子、细胞间黏附分子-1、单核细胞趋化蛋白-1 和基质金属蛋白酶-9 的表达能力,其抗炎机制可能与NF-κB信号通路的激活有关。此外,桦木酸可以减轻由λ-角叉菜胶引起的小鼠足部肿胀,并抑制炎症因子的表达,包括IL-1α、IL-1β、IL-5、IL-6、GM-CSF、KC和MCP-1等,进一步的研究表明,桦木酸可以抑制磷酸化的JNK、p38 和ERK,表明桦木酸可以通过抑制MAPK/COX-2/PGE2信号通路发挥抗炎作用[20]。
1.1.4 齐墩果酸
齐墩果酸对LPS 诱导的RAW264.7 细胞中的炎症因子产生有抑制作用,包括NO、IL-1β、IL-6、TNF-α、PGE2的产生,同时还能减少MafK 的表达和p65乙酰化水平,这表明齐墩果酸可能通过抑制NF-κB 信号通路来抑制炎症介质的产生,从而发挥抗炎作用[21]。
ALQRAD 等[22]采用TAA 诱导急性肝肾损伤小鼠模型,发现齐墩果酸显著提高了小鼠体内的SOD 和GSH 水平,同时降低MDA 和NOx的含量。进一步的实验表明,齐墩果酸通过改善NF-κB/TNF-α 信号通路和细胞因子的释放来对抗炎症反应,并能够降低TNF-α、IL-1β 和 NF-κBp65 的水平。齐墩果酸化学结构见图4。

图4 齐墩果酸化学结构
1.2 挥发油
挥发油是赤芍中除萜类成分外能够反映赤芍主要药用价值的另一大类成分,是一种存在于植物体内的油状液体,具有挥发性。到目前为止,国内外学者已从赤芍中分离出该类成分144种[5]。
1.2.1 月桂烯
ALMARZOOQI 等[23]采用DSS 诱导结肠炎模型,发现月桂烯可以通过减少促炎细胞因子的表达,包括IL-6、IL-1β和TNF-α,并在组织病理学上恢复结肠长度,保护绒毛和隐窝损伤,防止黏膜下水肿,还能降低ERK、JNK、p38 和NF-κBp65 的磷酸化,显示其可以通过抑制MAPK/NF-κB通路发挥抗炎作用。
在大鼠肾脏炎症模型中,月桂烯可以明显提高CAT、GSH、SOD 水平,并降低MDA 含量。进一步的研究表明,月桂烯可以显著降低IL-4、IL-10和iNOS的表达,同时抑制NF-κBp65 的磷酸化,表明月桂烯可能通过影响NF-κB 信号转导通路来保护大鼠肾脏炎症[24]。月桂烯化学结构见图5。
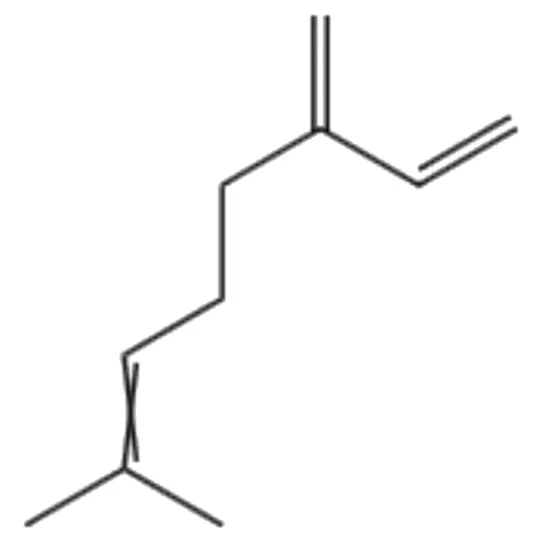
图5 月桂烯化学结构
1.2.2 冰片
孙淑萍等[25]采用LPS 致RAW264.7 细胞炎症模型,发现冰片能够有效抑制LPS 诱导的炎症介质NO、iNOS 的表达,进一步研究还显示冰片可以降低ERK、JNK、p38 和p65 的磷酸化,这表明其抗炎机制可能与激活Nrf2 蛋白、抑制MAPK 信号通路和NF-κB 信号通路有关。
BANSOD 等[26]利用小鼠脑核蛋白诱导的急性胰腺炎模型,发现冰片通过降低髓过氧化物酶活性以及抑制促炎细胞因子(如白细胞介素和TNF-α)的水平,减轻胰腺炎症。此外,冰片还显著增加了Nrf2 和SOD1的表达,同时降低了磷酸化NF-κBp65 的表达。进一步的研究表明,冰片能够显著抑制急性胰腺炎小鼠模型中TNFα、IL-1β、IL-6和iNOS的表达,表明冰片可能通过调节Nrf2/NF-κB 通路来减少氧化损伤,从而改善胰腺炎症。冰片化学结构见图6。
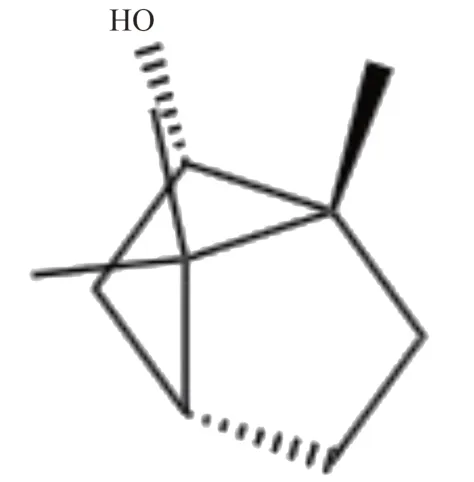
图6 冰片化学结构
1.3 酚酸类化合物
酚酸类化合物也是赤芍的主要成分之一,是一类同一苯环上具有多个羟基的化合物。目前从赤芍中一共发现了21种酚酸类化合物[5]。
1.3.1 没食子酸
栾淞莹[27]在烟曲霉菌性角膜炎小鼠模型中,发现没食子酸可以降低COX-2 和LOX-1 的表达。组织病理学结果显示,没食子酸能减少烟曲霉菌菌丝形成、增加细胞膜通透性、降低孢子黏附,同时能减少中性粒细胞的募集和浸润,并降低炎症因子IL-1β、TNF-α的表达,升高Nrf2 和HO-1 的表达。表明没食子酸可能通过抑制LOX-1 的表达并增强Nrf2/HO-1 信号通路的活性,从而产生抗炎作用。
黄丽华等[28]采用LPS 诱导RAW 264.7 巨噬细胞炎症模型,发现没食子酸可以降低TNF-α、IL-1 和IL-6的产生。进一步的研究显示,没食子酸可以减少LPS 刺激后TLR4 mRNA 和蛋白的产生,并且能够抵抗NF-κB 的激活。这表明没食子酸可能通过激活TLR4/NF-κB 通路来抑制LPS 引发的RAW 264.7 巨噬细胞的炎症反应。赵芳等[29]采用香烟烟雾诱导小鼠慢性阻塞性肺疾病模型,发现没食子酸能够显著抑制中性粒细胞、淋巴细胞和巨噬细胞的浸润,降低IL-6、TNF-α和IL-1β的水平,减少肺组织中的氧化还原失衡,表明没食子酸的抗炎机制可能与抑制IL-13/STAT6 信号通路的活性有关。CAI 等[30]采用LPS 诱导IPEC-J2细胞炎症模型,发现没食子酸能降低TNF-α和IL-8 的水平,进一步的研究显示没食子酸能够抑制NF-κB 和IκBα 的磷酸化,表明没食子酸的抗炎作用机制可能是抑制NF-κB 信号通路的激活。没食子酸化学结构见图7。
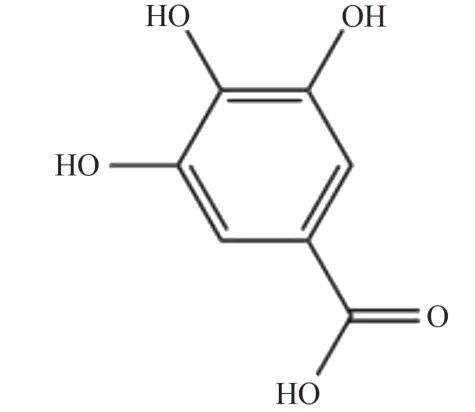
图7 没食子酸化学结构
1.3.2 鞣花酸
鞣花酸能够抑制LPS 诱导的小胶质细胞NLRP3炎性体的激活,从而减少促炎因子TNF-α、IL-1β 和IL-18 的产生,表明其可通过影响NLRP3/NF-κB 信号通路发挥神经炎症保护作用[31]。IGLESIAS 等[32]采用TNF-α 诱导Caco-2细胞肠道炎症模型,发现鞣花酸可以抑制IL-6 和IL-8 的产生,降低MLCK 基因表达和MLC 的磷酸化,表明其抗炎机制可能与抑制NF-κB和ERK1/2信号通路的激活有关。
DORNELLES 等[33]在LPS 诱导的大鼠神经炎症模型中,发现鞣花酸能够抑制认知障碍,通过显著降低胶质细胞表达,减轻磷酸化Tau 和氧化损伤,从而改善抗氧化系统和调节免疫系统反应发挥神经炎症保护作用。此外,鞣花酸可以抑制骨关节炎模型中iNOS、COX-2、NO、TNF-α、PGE2和IL-6的表达,进一步的研究表明鞣花酸可以减少MMP-13和ADAMTS-5的产生,并增加Ⅱ型胶原和聚集蛋白的生成,这说明鞣花酸可能通过阻断NF-κB 信号传导途径来发挥抗炎作用[34]。鞣花酸化学结构见图8。

图8 鞣花酸化学结构
1.4 黄酮类化合物
黄酮类化合物是指两个具有酚羟基的苯环(A 与B 环)通过中间三碳原子相互联结而成的一系列化合物,其基本母核为2-苯基色原酮,目前从赤芍中一共发现了20 种黄酮类化合物[5],其中以山柰酚和儿茶素为代表。
1.4.1 山柰酚
山柰酚可以减轻烟曲霉菌性角膜炎小鼠角膜中的真菌负荷、抑制炎症过程中炎性细胞(如炎性Ⅱ细胞)的募集以及减少炎症相关介质IL-1β、TNF-α、MIP-2 的表达,从而在真菌性角膜炎中发挥保护作用,进一步的研究结果表明山柰酚的抗炎作用是通过发挥对模式识别受体Dectin-1 和促炎通路p38MAPK的抑制性调控来实现的[35]。山柰酚可以下调LPS诱导的RAW 264.7细胞中促炎因子IL-1β、TNF-α、IL-6表达水平,上调IL-1Rα的表达水平,进一步研究发现山柰酚可以下调p-JNK/JNK 蛋白表达水平,表明其通过MAPK 信号通路发挥抗炎作用[36]。山柰酚化学结构见图9。
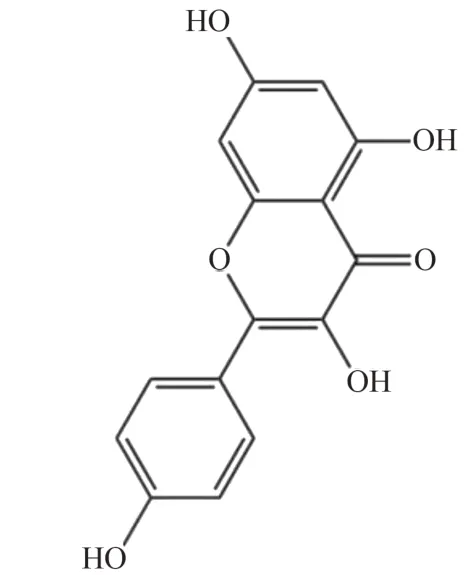
图9 山柰酚化学结构
1.4.2 儿茶素
儿茶素在LPS诱导的BV-2细胞炎症模型中具有显著的抗炎作用,它能够显著降低TNF-α 和IL-1β的产生,减少BV-2细胞的趋化作用,并抑制NF-κB/p65 的磷酸化,这表明儿茶素可能通过抑制NF-κB 信号通路的激活来发挥抗炎作用[37]。儿茶素可以改善金黄色葡萄球菌脂磷壁酸诱导的小鼠乳腺炎模型中腺泡密集增生、细胞脱落坏死、中性粒细胞浸润的组织病理变化。进一步的研究结果表明,儿茶素可以减少促炎因子IL-1β、IL-6 和TNF-α 的产生,并且降低NFκBp65 和IκBα 的磷酸化水平,这表明它可能通过抑制NF-κB信号通路的激活来发挥抗炎作用[38]。此外,儿茶素还可以通过抑制TLR2 介导的MAPK 通路和NFκB 通路来调控MAC-T 细胞和小鼠乳腺炎症反应,上调Nrf2 蛋白表达,增加HO-1、NQO1、SOD、CAT 等抗氧化酶活性,减少MAC-T 细胞和小鼠乳腺组织的氧化应激损伤,从而发挥抗炎作用[39]。儿茶素化学结构见图10。

图10 儿茶素化学结构
1.5 鞣质
鞣质,又称单宁,是一类结构比较复杂的多元酚类化合物,目前从赤芍中一共发现了9 种鞣质类化合物[5]。单宁酸可以改善DfE 诱导的小鼠皮肤皮炎模型中小鼠皮肤角化过度、角化不全、棘层增生、肥大细胞和炎症细胞浸润等症状,下调IFNc和IL-4水平,并抑制TNF-α、HMGB1、RAGE、ERK1/2、COX-2、IL-1β和PPARc 的表达,表明单宁酸可能通过阻断NF-κB信号通路上的PPARc 蛋白来实现其抗炎作用[40]。除此之外,单宁酸还能抑制NLRP3 炎性体激活,阻断Caspase-1裂解并抑制IL-1β分泌,并通过抑制NFκB/p65 核定位来抑制NF-κB 信号激活,从而发挥抗炎作用[41]。
LPS 通过Toll 样受体4 高度激活LPS 诱导的BV-2 小胶质细胞神经炎症模型中BV2 细胞,导致ROS、NO、PGE2、IL-6 和IL-1β 的产生增加。单宁酸以剂量依赖的方式逆转了LPS诱导的BV2细胞的所有神经炎症效应,表明其抗炎机制可能与抑制ROS 的生成和NF-κB 信号通路的激活有关[42]。单宁酸可以抑制人软骨细胞炎症和大鼠骨关节炎模型中NOS2、COX-2、IL-6、TNF-α、NO、PGE2的表达,进一步研究发现单宁酸还能下调MMP-3、MMP-13、ADAMTS4、ADAMTS5,并上调COL2A1 和ACAN,表明其抗炎机制可能与抑制MAPK 和NF-κB 信号通路的激活有关[43]。单宁酸化学结构见图11。

图11 单宁酸化学结构
2 小结
炎症反应是一个复杂的过程,其主要发展过程为:致炎因子的识别→激活信号通路→炎症介质产生→肥大细胞、中性粒细胞和巨噬细胞等活化→引发炎症级联反应[44]。抗炎药物主要是通过干扰炎症过程中的一个或多个步骤来发挥其抗炎作用,研究表明赤芍在调节炎症过程中通过控制AMPK、MAPK、NF-κB、STAT6 和HO-1 信号传导途径,有效地抑制炎症介质的生成,以达到抗炎作用。芍药抗炎机理见图12。

图12 赤芍发挥抗炎作用的主要机制
中药本身具有多种活性成分,在治疗疾病的过程中表现出多靶点、多环节整合调节的特点。赤芍中的多种活性成分具有不同的抗炎机制,表明赤芍中的活性成分可能通过多种途径和机制协同发挥抗炎作用。
