益智醇提物抗抑郁活性研究
2024-03-07甘安娜王诗宇晋炎君吴博颜廷旭贾英
甘安娜,王诗宇,晋炎君,吴博,颜廷旭,贾英
(沈阳药科大学功能食品与葡萄酒学院,辽宁 沈阳 117004)
抑郁症是一种常见的精神障碍,患者表现为心境低落、精神沮丧、焦虑恐慌、意志活动、反应力减退等症状,是一种被公认为具有高患病率、高致残率、高致死率的慢性精神疾病[1]。世界卫生组织指出,随着时间的推移,抑郁症的患者将会逐年增加,预计到2030 年,西方国家抑郁症的患病率预计将会排在首位。抑郁症的发病机制及生理病因尚未明确,故其药物治疗效果及预后康复并不如人意[2]。我国抑郁症发病率也存在逐年上升趋势,且目前主要的抗抑郁药物治疗效果满足不了患者的需求,而中医药凭借其副作用小等优点,越来越广泛地应用于抑郁症的临床治疗中[3]。
益智(sharp-leaf glangal fruit)是姜科山姜属的多年生植物益智(AlpiniaoxyphyllaMiq.)的干燥成熟果实,始载于《本草拾遗》[4],为中国四大南药之一[5]。主产于海南、广东、广西、福建等地,为海南道地药材,是卫生部公布的药食同源的药材之一[6]。2020 版《中华人民共和国药典》记载本品性温味辛,入脾、胃经,有温脾止泻、摄唾涎、肾虚遗尿、小便频数、遗精白浊的功效[7]。现代药理和临床研究表明,益智具有镇静、镇痛、抗肿瘤、抗应激、抗氧化、抗衰老、强心、抗溃疡、止泻、降血脂和保肝提高记忆力等作用。益智的黄酮类化合物有抗抑郁的活性[8],为了更好地了解益智治疗抑郁的作用机制,本实验从氧化应激以及炎症的方向研究益智的抗抑郁作用。
1 材料
1.1 动物
健康昆明种SPF级小鼠,由沈阳药科大学动物管理中心提供,雄性,体质量约25 g,合格证号:SCXK(辽)2020-0001。
1.2 药材
益智(辽宁省沈阳市同仁堂药店)经沈阳药科大学功能食品与葡萄酒学院贾英教授鉴定为益智(sharpleaf glangal fruit),是姜科(Zingiberaceae)多年生植物益智(AlpiniaoxyphyllaMiq.)的干燥成熟果实。
1.3 药品与试剂
羧甲基纤维素钠(国药集团化学试剂有限公司,批号:20190318);生理盐水(辰欣药业股份有限公司,批号:230314D04);95%乙醇(沈阳市富康消毒药剂厂,批号:20220322);氟西汀、DPPH、ABTS、VC(大连美伦科技有限公司,批号:M0905A、CHB210105、S0929C、F0221A);冰醋酸、铁氰化钾、水杨酸、过氧化氢、盐酸(山东禹王实业有限公司,批号:20200418、20150507、20220801、20190105、20220519);过硫酸钾、邻苯三酚(西陇化工股份有限公司,批号:20210121、20200928);超氧化物歧化酶(SOD)测试盒(碧云天生物技术有限公司,批号:122921220922);谷胱甘肽过氧化物酶(GSH-Px)测定试剂盒、一氧化氮合成酶(NOS)分型测试盒(南京建成生物科技有限公司,批号:20211120、20201028);环氧合酶-2(COX-2)测试盒、核因子-κB(NF-κB)ELISA 检测试剂盒、炎症小体(NLRP3)ELISA 检测试剂盒、白介素-1β(IL-1β)ELISA检测试剂盒(上海酶联生物科技有限公司,批号:ml0442236-J、ml063331、ml037234、mIC50300-1)。
1.4 仪器
BP210S 型电子分析天平(德国Sartorius 公司);数显电热恒温水浴锅HH-4(国华电器有限公司);KQ5200B 型超声波清洗器(昆山市超声仪器有限公司);DZTW 调温电热套(北京市永光明医疗仪器厂);离心机TGL-16C(上海安亭科学仪器厂);Varioskan Flash 酶标仪(默飞世尔科技公司);旋转蒸发仪RE-52A(上海亚荣生化仪器厂);BP210S 型电子分析天平(德国Sartorius 公司);真空泵SHZ-Ⅲ(上海亚荣生化仪器厂);ZS-ZFT 自发活动视频分析系统(安徽淮北正华生物仪器设备有限公司);DY89-Ⅱ匀浆机(宁波新芝生物科技有限公司)。
2 方法
2.1 益智醇提物的制备
取益智干燥品400 g,粉碎,加10 倍体积的95%乙醇加热回流提取3 次,每次2 h。过滤后,合并滤液,减压回收乙醇至无醇味,蒸干后,收集益智提取物浸膏60.5 g。益智醇提物浸膏需用CMC-Na 溶液助溶。
2.2 二甲苯致小鼠耳肿胀实验
小鼠经环境适应性喂养一周后,将小鼠随机分为对照组(Control 组)、阿司匹林组(Aspirin 组)、益智醇提物低剂量给药组(AOY treated groupⅠ组)和益智醇提物高剂量给药组(AOY treated group Ⅱ组),每组10只。对照组灌胃给予CMC-Na;阿司匹林组灌胃给予阿司匹林肠溶片溶液(200 mg/kg);益智醇提物低剂量给药组灌胃给予益智醇提物150 mg/kg;益智醇提物高剂量给药组灌胃给予益智醇提物300 mg/kg。
小鼠连续给药7 d,每日1次,给药剂量0.01 mL/g。末次给药后30 min,将小鼠耳朵用蒸馏水冲洗,取100%二甲苯50 μL 均匀涂于小鼠右耳前后两面致炎。1 h后用游标卡尺测量给予二甲苯前后的耳廓厚度,计算耳肿胀度和肿胀度的抑制率。
2.3 小鼠棉球肉芽肿实验
小鼠经环境适应性喂养一周后,将小鼠随机分为对照组(Control 组)、阿司匹林(Aspirin 组)、益智醇提物低剂量给药组(AOY treated groupⅠ组)和益智醇提物高剂量给药组(AOY treated groupⅡ组),每组10 只。对照组灌胃给予CMC-Na;阿司匹林组灌胃给予阿司匹林肠溶片溶液(200 mg/kg);益智醇提物低剂量给药组灌胃给予益智醇提物150 mg/kg;益智醇提物高剂量给药组灌胃给予益智醇提物300 mg/kg。
小鼠连续给药7 d,每日1次,给药剂量0.01 mL/g。腹腔注射水合氯醛400 mg/kg 麻醉,在小鼠的背部正中央去毛用碘酒消毒,75%酒精棉脱碘后,用手术剪刀开0.5 cm 长的小口,用眼科镊子将质量为5 mg 的灭菌棉球植入皮下,随即缝合小鼠皮肤。末次给药后24 h,打开切口,将棉球连同周围结缔组织一起取出,剔除脂肪组织,在80 ℃烘箱中恒温干燥12 h 后,称重,将称得的重量减去棉球重量(5 mg),即得肉芽肿重量。
2.4 抗氧化活性实验
2.4.1 DPPH自由基清除能力的测定
参照文献[9]中的方法做适当修改。用无水乙醇制备浓度为6.5 × 10-5mol/L 的DPPH 自由基(•DPPH)储备液,在试管中依次加入不同浓度的供试品溶液1.5 mL和DPPH 自由基储备液2.5 mL,摇匀并于暗处静置30 min,在517 nm 波长处测定其吸光度分别记为Ai(i= 1~10);以1.5 mL无水乙醇代替供试品溶液测得的吸光度为空白吸光度记为A0;以无水乙醇代替DPPH自由基储备液测得的吸光度为供试品本底吸光度记为Aj;每个浓度同时做3个平行样,取吸光度的平均值,以VC做阳性对照,按照以上方法处理并测定吸光度,计算供试品溶液对DPPH的抑制率,并计算出IC50值。
2.4.2 ABTS自由基清除能力的测定
参照文献[10]中的方法做适当修改。用无水乙醇制备浓度为7.00 mmol/L 的 ABTS 溶液,量取ABTS 溶液10 mL 加入提前配好的2.45 mmol/L K2S2O8水溶液10 mL,在避光的条件下室温放置过夜,形成一定浓度的ABTS 自由基(•ABTS+)储备液,下一步实验前用无水乙醇稀释至734 nm 波长处吸光度为(0.700 ± 0.02)左右,备用。在试管中依次加入不同浓度的供试品溶液0.1 mL 和稀释后的ABTS 自由基溶液5.0 mL,充分混匀后避光放置6 min,在734 nm 波长处测其吸光度Ai(i= 1~10);以0.1 mL 无水乙醇代替供试品溶液测得的吸光度为空白吸光度记为A0;以5.0 mL 无水乙醇代替ABTS 溶液测得的吸光度为供试品本底吸光度记为Aj;每个浓度同时做3 个平行样,取吸光度的平均值,以VC 做阳性对照,按公式(1)计算供试品对ABTS自由基的抑制率,并计算出IC50值。
2.4.3 羟基自由基清除能力的测定
参照文献[11]中的方法做适当修改。在试管中加入配好的9 mmol/L 硫酸亚铁溶液1.0 mL 和9 mmol/L水杨酸-乙醇溶液2.0 mL,混匀,不同浓度的供试品溶液2.0 mL,加入8.8 mmol/L过氧化氢溶液2.0 mL启动反应,37 ℃水浴放置30 min后于510 nm 处测得吸光值Ai(i= 1~10),以2.0 mL 无水乙醇代替供试品溶液测得的吸光度为空白吸光度记为A0,以2.0 mL 无水乙醇代替水杨酸-乙醇溶液测得的吸光度为本底吸光度记为Aj。每个浓度同时做3 个平行样,取吸光度的平均值,以VC 做阳性对照,按公式(1)计算样品对•OH自由基的抑制率,并计算出IC50值。
2.4.4 超氧阴离子清除能力的测定
参照文献[12]中的方法做适当修改。在试管中加入提前配制好的50 mmol/L Tris-HCl 缓冲液(pH =8.2)4.5 mL和蒸馏水4.2 mL,充分混匀,于25 ℃水浴中放置20 min,取出后立即加入用HCl配制的3 mmol/L邻苯三酚0.3 mL,空白管中用HCl 代替邻苯三酚HCl 溶液,迅速摇匀,然后在325 nm 每隔30 s 测定一次吸光值A,邻苯三酚的自氧化速率A1是在线性范围内每1 min 吸光度的增加值。取Tris-HCl 缓冲液4.5 mL、供试品1.0 mL 和蒸馏水3.2 mL 混匀,其他步骤同上,邻苯三酚的自氧化速率A2是在线性范围内每1 min 吸光度的增加值。每个浓度同时做3 个平行样,取吸光度的平均值,以VC 做阳性对照,按公式(2)计算样品对•O2-的抑制率,并计算出IC50值。
2.5 慢性不可预知温和应激(CUMS)小鼠模型实验
造模方式:①禁食24 h;②禁水24 h;③斜笼饲养24 h;④无垫料饲养24 h;⑤昼夜颠倒12 h;⑥湿笼饲养24 h;⑦噪声4 h;⑧冰水游泳5 min;⑨夹尾1 min。以上造模方式必须随机单独进行4周。
小鼠适应一周后,将48只小鼠随机分为6组,具体分组及给药情况如下:空白组(Control 组)灌胃给予CMC-Na;CUMS 组(CUMS)灌胃给予CMC-Na;CUMS- 阳性药组(CUMS-FLU)腹腔给予氟西汀(12 mg/kg);空白给药组(Control-AOY)灌胃给予益智醇提物(300 mg/kg);CUMS-益智醇提物低剂量给药组(CUMS-AOYⅠ)灌胃给药(150 mg/kg);CUMS-益智醇提物高剂量给药组(CUMS-AOYⅡ)灌胃给药(300 mg/kg)。
其中CUMS 组、CUMS-阳性药组、CUMS-益智醇提物低剂量给药组和CUMS-益智醇提物高剂量给药组小鼠进行连续4 周的CUMS 造模。实验进行到第7 天时,空白组和CUMS 组小鼠分别连续3 周灌胃给予0.5%CMC-Na,每天1 次;CUMS-阳性药组连续3 周腹腔注射给予FLU,每天1 次;空白给药组、CUMS-益智醇提物高剂量给药组以及CUMS-益智醇提物低剂量给药组连续3 周给予益智醇提取物,每天1 次。实验第28 天时对各组小鼠依次进行糖偏好实验,第29 天后进行强迫游泳实验以及悬尾实验,第30 天处死动物,迅速取出小鼠全脑,将其放在生理盐水中低温保存,将大脑中的海马组织取出放在-80 ℃超低温冰箱进行保存,并按试剂盒说明对其进行生化检测。
2.5.1 糖偏好实验(SPT)
将小鼠放到一个含有两瓶浓度都为1%的糖水水瓶的笼子当中适应24 h,然后断水24 h,再将小鼠放在笼中饲养,并在该笼左右放进2 只水瓶,水瓶中分别装有100 mL糖水和100 mL水,12 h之后记录糖水和水的消耗情况。
2.5.2 强迫游泳实验(FST)
将小鼠放进一个装有水的烧杯中(烧杯高25 cm,直径14 cm,水深10 cm),水温控制在24~26 ℃。一次实验进行6 min,小鼠适应时间为2 min,然后观察记录小鼠后4 min 的游泳情况。其中小鼠不动的标志是只做基本的保持头部不下沉的运动。
2.5.3 悬尾实验(TST)
将小鼠尾巴固定在30 cm 高度的横杆上,头部向下,一次实验进行6 min,小鼠适应2 min,然后观察记录小鼠后4 min 的挣扎情况。小鼠不动的标志是为只做基本的保持头部向下不动的行为。
2.6 生化指标检测
按照试剂盒说明书进行操作处理试剂,并根据标准品的浓度及相对应的吸光度值,计算出标准曲线的直线回归方程,再根据样品的吸光度值,计算出对应的SOD、GSH-Px、iNOS、COX-2、NF-κB、NLRP3 和IL-1β样品浓度。
2.7 统计学方法
采用SPSS19.0 统计软件进行分析,行为学实验数据和生化指标测定数据均以±s表示,各组之间参数比较采用One-way ANOVA 和Student'st-test 进行统计学分析。P< 0.05为差异具有统计学意义。
3 结果
3.1 各组小鼠耳肿胀情况比较
小鼠的左耳在实验结束后耳廓厚度并无明显的差异,可以排除小鼠之间的个体差异的影响。小鼠右耳耳廓经二甲苯致炎后,出现了明显的肿胀,与空白组比较,阿司匹林组(P< 0.01,抑制率58.34%)、益智醇提物高低剂量给药组(P< 0.01,抑制率41.67%、25.00%)表现出显著的肿胀抑制作用。结果表明,益智醇提物能够抑制二甲苯所造成小鼠的急性炎症,且高剂量的AOY给药效果更好。结果见表1。
表1 各组小鼠耳肿胀实验结果比较(±s)

表1 各组小鼠耳肿胀实验结果比较(±s)
注:与Control组比较,**P < 0.01。
组别Control组Aspirin组AOY treated groupⅠ组AOY treated groupⅡ组抑制率/%—58.34 25.00 41.67 n 10 10 10 10左耳/mm 0.15 ± 0.01 0.16 ± 0.01 0.16 ± 0.02 0.16 ± 0.02右耳/mm 0.28 ± 0.03 0.21 ± 0.02**0.25 ± 0.02 0.23 ± 0.03**肿胀程度/mm 0.12 ± 0.02 0.05 ± 0.02**0.09 ± 0.01**0.07 ± 0.03**
3.2 各组小鼠棉球肉芽肿情况比较
与空白组比较,阿司匹林组(P< 0.01,抑制率48.60%)、益智醇提物高剂量给药组(P< 0.01,抑制率35.49%)以及益智醇提物低剂量给药组(P< 0.05,抑制率14.77%)表现出显著的肿胀抑制作用。结果表明,益智醇提物能够抑制小鼠的慢性炎症,且高剂量的AOY给药效果更好。结果见表2。
表2 各组小鼠棉球肉芽实验结果比较(±s)
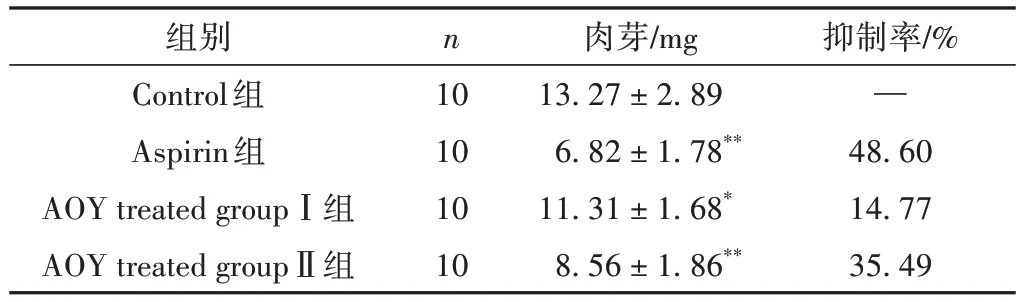
表2 各组小鼠棉球肉芽实验结果比较(±s)
注:与Control组比较,*P < 0.05,**P < 0.01。
组别Control组Aspirin组AOY treated groupⅠ组AOY treated groupⅡ组抑制率/%—48.60 14.77 35.49 n 10 10 10 10肉芽/mg 13.27 ± 2.89 6.82 ± 1.78**11.31 ± 1.68*8.56 ± 1.86**
3.3 益智醇提物对自由基清除能力的影响
3.3.1 益智醇提物对DPPH自由基清除能力
DPPH 是一种稳定的氮中心的自由基,广泛用于定量测定中药和食品的抗氧化能力。益智醇提物在0.2~80 mg/mL 范围内,随着浓度的升高DPPH 自由基的清除能力增强,当浓度为2 mg/mL 时,清除能力达93.1%,接近VC水平,IC50= 0.36 mg/mL。结果见表3。
表3 不同浓度AOY DPPH自由基清除能力比较(±s)
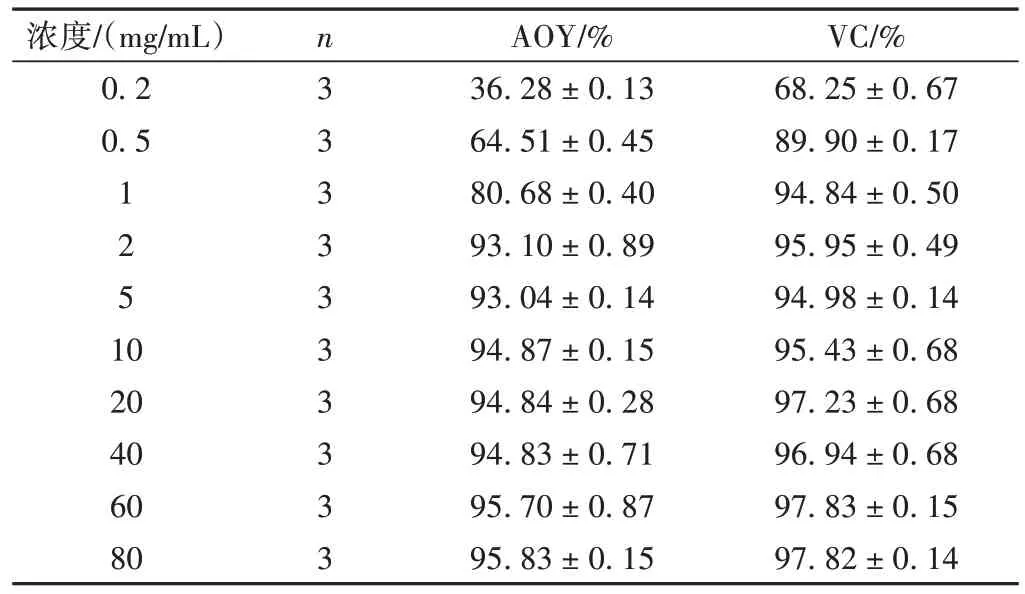
表3 不同浓度AOY DPPH自由基清除能力比较(±s)
浓度/(mg/mL)0.2 0.5 1 2 5 10 20 40 60 80 n3 3 3 3 3 3 3 3 3 3 AOY/%36.28 ± 0.13 64.51 ± 0.45 80.68 ± 0.40 93.10 ± 0.89 93.04 ± 0.14 94.87 ± 0.15 94.84 ± 0.28 94.83 ± 0.71 95.70 ± 0.87 95.83 ± 0.15 VC/%68.25 ± 0.67 89.90 ± 0.17 94.84 ± 0.50 95.95 ± 0.49 94.98 ± 0.14 95.43 ± 0.68 97.23 ± 0.68 96.94 ± 0.68 97.83 ± 0.15 97.82 ± 0.14
3.3.2 益智醇提物对ABTS自由基清除能力
在适当的氧化剂作用ABTS 可氧化成绿色的ABTS自由基,当有抗氧化剂存在时可抑制自由基的产生,在734 nm 处测定吸光度可计算供试品的抗氧化能力。益智醇提物在0.2 ~ 80 mg/mL范围内,随着浓度的升高ABTS 自由基的清除能力增强,当浓度为5 mg/mL时,清除能力达95.8%,接近VC水平,IC50= 1.92 mg/mL。结果见表4。
表4 不同浓度AOY ABTS自由基清除能力比较(±s)
浓度/(mg/mL)0.2 0.5 1 2 5 10 20 40 60 80 n3 3 3 3 3 3 3 3 3 3 AOY/%14.62 ± 0.33 24.61 ± 0.24 32.36 ± 0.17 54.76 ± 0.17 95.80 ± 0.18 97.35 ± 0.18 97.35 ± 0.19 98.77 ± 0.25 97.45 ± 0.18 98.66 ± 0.17 VC/%80.33 ± 0.21 94.95 ± 0.18 98.41 ± 0.21 99.16 ± 0.16 99.96 ± 0.16 99.37 ± 0.21 98.34 ± 0.20 98.84 ± 0.19 99.06 ± 0.16 99.50 ± 0.21
3.3.3 益智醇提物对羟基自由基清除能力
羟基自由基的反应活性很高,若将反应体系加入水杨酸能够有效捕捉羟基自由基,同时产生有色物质,在510 nm 波长处有强吸收。益智醇提物在0.2~80 mg/mL范围内,随着浓度的升高羟基自由基的清除能力增强,当浓度为20 mg/mL 时,清除能力达90.1%,接近VC水平,IC50= 7.18 mg/mL。结果见表5。
表5 不同浓度AOY羟基自由基清除能力比较(±s)
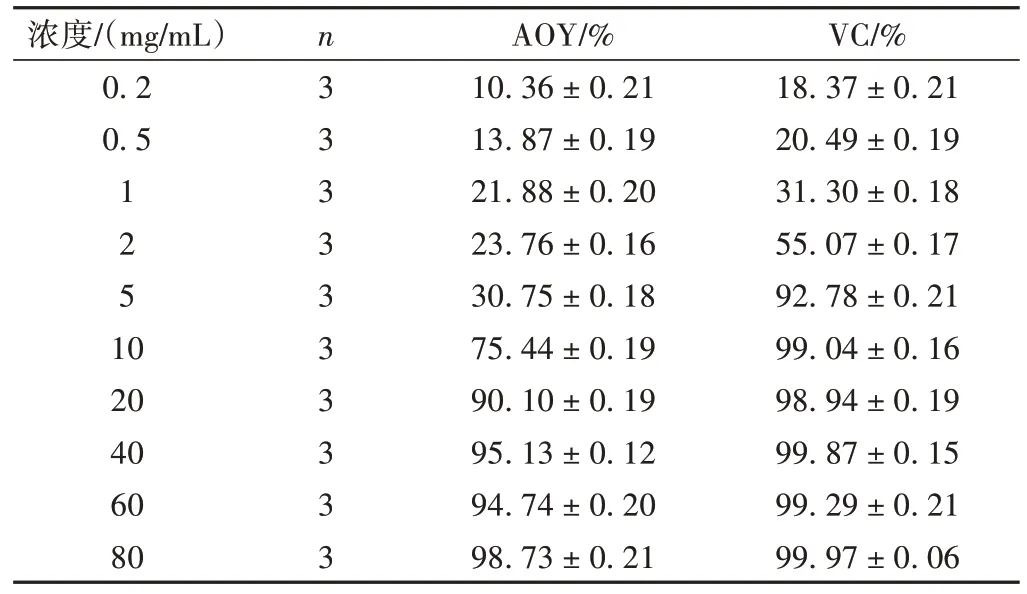
表5 不同浓度AOY羟基自由基清除能力比较(±s)
浓度/(mg/mL)0.2 0.5 1 2 5 10 20 40 60 80 n3 3 3 3 3 3 3 3 3 3 AOY/%10.36 ± 0.21 13.87 ± 0.19 21.88 ± 0.20 23.76 ± 0.16 30.75 ± 0.18 75.44 ± 0.19 90.10 ± 0.19 95.13 ± 0.12 94.74 ± 0.20 98.73 ± 0.21 VC/%18.37 ± 0.21 20.49 ± 0.19 31.30 ± 0.18 55.07 ± 0.17 92.78 ± 0.21 99.04 ± 0.16 98.94 ± 0.19 99.87 ± 0.15 99.29 ± 0.21 99.97 ± 0.06
3.3.4 益智醇提物对超氧阴离子清除能力
邻苯三酚在碱性条件下可发生自氧化反应并释放超氧阴离子(·O2-),生成的中间产物有色且该中间产物在325 nm 波长处有较强吸收。益智醇提物在0.2~80 mg/mL范围内,随着浓度的升高超氧阴离子的清除能力增强,当浓度为80 mg/mL时,清除能力达90.6%,从趋势看可接近VC水平,IC50= 15.21 mg/mL。结果见表6。
表6 不同浓度AOY超氧阴离子清除能力比较(±s)

表6 不同浓度AOY超氧阴离子清除能力比较(±s)
浓度/(mg/mL)0.2 0.5 1 2 5 10 20 40 60 80 VC/%40.62 ± 0.30 44.13 ± 0.32 82.20 ± 0.30 95.41 ± 0.43 96.14 ± 0.33 97.62 ± 0.30 99.13 ± 0.33 98.60 ± 0.29 98.87 ± 0.25 99.23 ± 0.33 n3 3 3 3 3 3 3 3 3 3 AOY/%24.92 ± 0.29 28.43 ± 0.30 34.09 ± 0.22 36.93 ± 0.30 42.04 ± 0.33 44.12 ± 0.25 55.21 ± 0.24 69.80 ± 0.30 80.65 ± 0.34 90.60 ± 0.29
3.4 各组小鼠糖偏好实验(SPT)结果比较
造模后,CUMS 组小鼠糖水偏好指数明显低于Control 组(P< 0.01);与CUMS 组比较,CUMS-FLU组、CUMS-AOY Ⅰ组和CUMS-AOYⅡ组的糖水偏好指数显著升高(P< 0.01,P< 0.05)。结果提示,氟西汀和AOY 高、低剂量均能缓解抑郁模型小鼠的抑郁症状。结果见表7。
表7 各组小鼠糖水偏好指数比较(±s)

表7 各组小鼠糖水偏好指数比较(±s)
注:与Control 组比较,##P < 0.01;与CUMS 组比较,*P < 0.05,**P <0.01。
糖水偏好指数/%60.77 ± 6.60 45.69 ± 7.32##59.48 ± 6.92**58.61 ± 6.80 56.78 ± 5.76*59.37 ± 6.27**组别Control组CUMS组CUMS-FLU组Control-AOY组CUMS-AOYⅠ组CUMS-AOYⅡ组n8 8 8 8 8 8
3.5 各组小鼠强迫游泳实验(FST)结果比较
造模后,与Control 组比较,CUMS 组小鼠FST 比较静止时间显著增加(P< 0.01);与CUMS 组比较,CUMS-FLU 组和CUMS-AOY Ⅰ组和CUMS-AOYⅡ组小鼠FST 静止时间显著减少(P< 0.01,P<0.05)。结果提示,氟西汀和AOY 高、低剂量均能缓解抑郁模型小鼠的抑郁症状。结果见表8。
表8 各组小鼠FST静止时间比较(±s)

表8 各组小鼠FST静止时间比较(±s)
注:与Control 组比较,##P < 0.01;与CUMS 组比较,*P < 0.01,**P <0.01。
FST静止时间/s 87.17 ± 11.15 116.7 ± 8.88##102.4 ± 6.10**85.24 ± 1.53 104.7 ± 8.47*100.6 ± 8.17**组别Control组CUMS组CUMS-FLU组Control-AOY组CUMS-AOYⅠ组CUMS-AOYⅡ组n8 8 8 8 8 8
3.6 各组小鼠悬尾实验(TST)结果比较
造模后,与Control 组比较,CUMS 组小鼠TST 静止时间显著增加(P< 0.01);与CUMS 组比较,CUMSFLU 组和CUMS-AOY Ⅰ组和CUMS-AOYⅡ组小鼠TST 静止时间显著减少(P< 0.01,P< 0.05)。结果提示,氟西汀和AOY 高低剂量均能缓解抑郁模型小鼠的抑郁症状。结果见表9。
表9 各组小鼠TST静止时间比较(±s)

表9 各组小鼠TST静止时间比较(±s)
注:与Control 组比较,##P < 0.01;与CUMS 组比较,*P < 0.05,**P <0.01。
TST静止时间/s 97.58 ± 7.80 123.40 ± 8.55##109.50 ± 6.94**106.90 ± 5.70 109.90 ± 5.09**112.00 ± 6.84*组别Control组CUMS组CUMS-FLU组Control-AOY组CUMS-AOYⅠ组CUMS-AOYⅡ组n8 8 8 8 8 8
3.7 各组小鼠海马中SOD、GSH-Px、iNOS、COX-2、NF-κB、NLRP3和IL-1β水平比较
与Control 组比较,CUMS 组小鼠海马中SOD 和GSH-Px的活力显著降低(P< 0.01);与CUMS组比较,CUMS-FLU组和CUMS-AOY Ⅰ组和CUMS-AOYⅡ组小鼠海马中SOD的活力显著升高(P< 0.01),GSHPx变化趋势与SOD 相似(P< 0.01)。这说明氟西汀和AOY能通过增强模型组小鼠海马当中的SOD和GSHPx 的活力来缓解CUMS 小鼠的抑郁症状。Control-AOY组中SOD和GSH-Px的活力值虽然较Control组的活力值低,但是没有统计学意义,这说明AOY不会对空白组小鼠的SOD 和GSH-Px 的活力产生显著性影响。结果见表10。
表10 小鼠海马中的SOD和GSH-Px活力比较(±s)

表10 小鼠海马中的SOD和GSH-Px活力比较(±s)
注:与Control组比较,##P < 0.01;与CUMS组比较,**P < 0.01。
组别Control组CUMS组CUMS-FLU组Control-AOY组CUMS-AOYⅠ组CUMS-AOYⅡ组GSH-Px/(U/mg protein)151.28 ± 4.07 134.84 ± 6.61##147.37 ± 3.57**145.94 ± 3.60 145.36 ± 4.34**147.33 ± 2.85**n8 8 8 8 8 8 SOD/(U/mg protein)25.07 ± 0.06 24.04 ± 0.16##24.94 ± 0.17**24.94 ± 0.11 24.66 ± 0.32**25.00 ± 0.10**
与Control 组比较,CUMS 组小鼠iNOS 含量显著升高(P< 0.01);与CUMS 组比较,CUMS-FLU 组和CUMS-AOY Ⅰ组和CUMS-AOYⅡ组小鼠iNOS 含量显著降低(P< 0.05)。与Control组比较,CUMS组小鼠COX-2 含量显著增加(P< 0.01);与CUMS 组比较,CUMS-FLU 组和CUMS-AOY Ⅰ组和CUMS-AOYⅡ组小鼠COX-2 含量显著减少(P< 0.01,P< 0.05)。Control-AOY组小鼠海马中iNOS与COX-2的含量与Control组比较无统计学意义。结果见表11。
表11 各组小鼠海马中iNOS 和COX-2蛋白表达情况比较(±s)

表11 各组小鼠海马中iNOS 和COX-2蛋白表达情况比较(±s)
注:与Control 组比较,##P < 0.01;与CUMS 组比较,*P < 0.05,**P <0.01。
COX-2/(U/L)16.73 ± 1.43 25.28 ± 2.48##16.96 ± 2.40**17.65 ± 1.74 22.11 ± 1.48*21.14 ± 1.66**组别Control组CUMS组CUMS-FLU组Control-AOY组CUMS-AOYⅠ组CUMS-AOYⅡ组n8 8 8 8 8 8 iNOS/(U/mL)1.17 ± 0.42 1.83 ± 0.17##1.42 ± 0.22*1.27 ± 0.11 1.43 ± 0.19*1.46 ± 0.22*
与Control 组比较,CUMS 组小鼠NF-κB 含量显著升高(P< 0.01);与CUMS 组比较,CUMS-FLU 组和CUMS-AOY Ⅰ组和CUMS-AOYⅡ组小鼠NF-κB含量显著降低(P< 0.01,P< 0.05)。与Control 组比较,CUMS组小鼠NLRP3含量显著升高(P< 0.01);与CUMS组比较,CUMS-FLU组和CUMS-AOY Ⅰ组和CUMSAOYⅡ组小鼠NLRP3 含量显著降低(P< 0.01)。与Control组比较,CUMS组小鼠IL-1β 含量显著升高(P<0.01);与CUMS组比较,CUMS-FLU 组含量和CUMSAOY Ⅰ组和CUMS-AOYⅡ组小鼠IL-1β含量显著降低(P< 0.01,P< 0.05)。与空白组比较,Control-AOY组小鼠海马中NF-κB、NLRP3和IL-1β的含量无统计学意义。结果见表12。
表12 各组小鼠海马中NF-κB、NLRP3和IL-1β蛋白表达情况比较(±s)

表12 各组小鼠海马中NF-κB、NLRP3和IL-1β蛋白表达情况比较(±s)
注:与Control组比较,##P < 0.01;与CUMS组比较,*P < 0.05,**P < 0.01。
IL-1β/(pg/mL)51.07 ± 1.09 74.45 ± 1.07##57.57 ± 1.18**55.72 ± 1.61 60.92 ± 1.60*52.08 ± 1.12**组别Control组CUMS组CUMS-FLU组Control-AOY组CUMS-AOYⅠ组CUMS-AOYⅡ组n8 8 8 8 8 8 NF-κB/(pg/mL)215.70 ± 1.30 310.60 ± 1.73##290.50 ± 1.36**243.60 ± 1.61 296.50 ± 1.86*259.50 ± 1.23**NLRP3/(pg/mL)166.40 ± 1.40 318.70 ± 1.71##191.40 ± 1.81**195.50 ± 1.53 192.60 ± 1.65**252.30 ± 1.70**
4 讨论
炎症发生、氧化应激都是抑郁发病的风险因素,会引发或加重抑郁病变。研究表明,抑郁症患者常伴促炎细胞因子水平的升高,如肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、IL-1β和IL-6等[13],类风湿关节炎等与炎症相关性疾病常与抑郁症共病[14]。抗抑郁药能够在一定程度上降低抑郁症患者的炎症标志物水平,非甾体抗炎药等抗炎药物也被发现具有一定抗抑郁作用[15-16]。神经炎症和脑内的氧化应激发生与人的生理和病理现象有密切的关系,能够导致脑内神经元的损伤,以及一系列危及人体的不良危害。大量研究显示,氧化应激损伤与多种疾病如神经退行性疾病、高血压、肿瘤、糖尿病等密切相关,也参与了抑郁症的发生和发展[17]。自由基是呼吸链的重要产物之一,可以通过攻击DNA 碱基、蛋白质以及膜脂质诱导细胞产生过氧化反应,从而引起细胞损伤。通常,自由基可通过机体自身的抗氧化应激系统将其清除,包括SOD、GSH-PX 和CAT 等,但当自由基水平超过机体清除能力时,机体负荷过大产生脂质过氧化损伤,干扰细胞正常功能,参与抑郁症的发生。本实验通过小鼠耳肿胀实验、小鼠棉球肉芽肿观察小鼠的肿胀率、肉芽肿增长情况,证明了益智醇提物具有良好的抗炎活性;又通过考察AOY 对自由基的清除能力,证明了益智醇提物具有良好的抗氧化活性。
益智具有神经保护的作用,并且其黄酮类成分作用于BDNF靶点有一定的抗抑郁活性[8],为了进一步研究益智的抗抑郁作用机制,本实验建立了CUMS 小鼠抑郁模型,CUMS 可使小鼠海马中SOD 含量以及GSH-Px含量下降。谷胱甘肽(GSH)是非酶促抗氧化系统的一个重要组成部分,包括还原型(GSH)和氧化型(GS-SG)两种形式[18]。谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)是机体内广泛存在的一种重要的过氧化物分解酶,它能催化GSH 变为GSSG,使有毒的过氧化物还原成无毒的羟基化合物,从而保护细胞膜的结构及功能不受过氧化物的干扰及损害。GSH 的变化与GSH-Px 和GLR(谷胱甘肽还原酶)的酶活性相关,CUMS 小鼠海马内GSHPx 降低致使GSH 变为GSSG 反应速率减慢,小鼠氧化态成分增加,过氧化物增加,机体产生氧化反应,进一步使机体氧化生物标志物增加,如ROS、MDA 等。转录因子核因子-κB(NF-κB)是影响氧化应激和脑损伤相关的重要因素[19]。ROS 等氧化因子的激活导致IκB 的蛋白水解降解,伴随NF-κB 的p50 和p65 异源二聚体产生核易位,致使NF-κB 靶基因进行转录,产生NF-κB[20]。在CUMS 小鼠中,SOD 以及GSH-Px 含量下降,诱导海马内促氧化剂-抗氧化剂平衡向促氧化剂状态转变,激活核转录因子-κB(NF-κB),而经氟西汀和AOY 治疗后,可改善上述情况。研究表明,NF-κB 的过度激活,可导致环氧合酶-2(COX-2)的转录,并与NOS2 5'侧翼区中的κB 元件相互作用,引发iNOS 基因转录[21-22]。COX-2的激活可能导致额外的自由基和炎性细胞因子的释放[23],以及前列腺素的生物合成,进一步促进细胞产生炎症反应,产生炎症因子。在CUMS 小鼠海马中NF-κB 受谷胱甘肽系统的影响,有明显的增加,进而诱导iNOS、COX-2 含量增加,产生炎症反应,使NLRP3 和IL-1β 炎症相关因子含量增加。经氟西汀和AOY 治疗后,均能产生回调的现象。本实验设立Control-AOY 组,结果显示,益智提取物对于正常小鼠无显著性影响,一定程度上表明益智提取物对于动物不会产生毒性作用。
以上结果表明,AOY 作用于炎症反应和氧化应激系统从而发挥抗抑郁的作用。
