基于定量CT分析维持性血液透析患者腰椎骨密度与体质成分的相关性
2024-03-01吕磊翟建李培刘奇峰方世武
吕磊,翟建,李培,刘奇峰,方世武
随着各种血液净化技术的不断涌现和发展,维持性血液透析(maintenance hemodialysis,MHD)患者的数量明显增加,其骨质疏松的发病率也逐渐增高,不仅严重影响患者生活质量,而且也已成为透析患者死亡的独立危险因素[1]。骨密度(bone mineral density,BMD)值作为当前诊断骨质疏松症的首要指标,其影响因素有很多,也一直是研究的热点。体质成分指的是身体内各种成分的含量,主要由骨骼、肌肉和脂肪3部分组成[2],能反映人体的体质情况、形体特征,维持性血液透析患者体成分对骨密度影响的研究并不多,其关系并未明确。体质成分的测量方法有很多,包括生物电阻抗法、双能X线法、磁共振成像法、定量CT(quantitative computed tomography,QCT)法及水下称重法等。QCT因其独特的技术优势,现在已经成为体成分(肌肉、骨骼、脂肪)测量的“金标准”[3-4]。本研究利用QCT法测量维持性血液透析患者的体成分信息,分析其与骨密度的关系,发现骨量异常的危险因素,旨在为MHD患者骨质疏松的防治提供依据,现报道如下。
材料与方法
1.研究对象
回顾性分析我院2014年7月-2022年8月MHD患者共106例。入组标准:①所有患者影像资料完整,最低扫描层面要达到L3中心层面;②患者每周透析2~3次,每次透析4h,最低透析龄为3个月;③年龄>25岁,病史资料完整。排除标准:①影像及临床资料不全;②恶性肿瘤,白血病,淋巴瘤等其他恶性血液系统疾病患者,长期糖皮质激素治疗及免疫抑制剂者;③严重急慢性炎症,外伤、骨折、内分泌系统疾病患者等。本研究为回顾性研究,已通过本院伦理委员会批准,免除患者知情同意。
2.研究方法
一般资料及临床实验室指标:入院后搜集患者的一般资料,包括年龄、性别、透析时长;临床实验室指标包括血清钙(calcium,Ca)、磷(phosphorus,P)、血清总胆固醇(Total cholesterol,TC)、甘油三酯(triglyceride,TG)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇( low- density lipoprotein cholesterol,LDL-C)、血清白蛋白(Albumin,ALB)等。
QCT测量患者的体成分:Philips Brilliance 64 CT机上获得影像资料传送至美国Mindways软件公司开发研制的QCT骨密度检测软件(QCT-PRO),半自动进行骨、肌及脂肪的测量。CT扫描参数:管电压120 kV ,管电流250 mA,螺距1.375 ,FOV 500 mm×500 mm,矩阵512×512。以下测量均由2位住院医师在主任医师的指导下完成的,为了减少偏移,在仔细勾画的同时,所有测量结果均取两位医师测量的平均值视为最终测量结果。
骨密度的测量:利用骨密度分析模块,测量L1及L2松质骨骨密度,ROI放置在松质骨的中心,注意避开血管、硬化及皮质骨(图1)。依据QCT骨质疏松诊断标准[5],将入组的106例患者按照骨密度测量结果分为骨量正常组及骨量异常组(骨量减低者及骨质疏松者)。
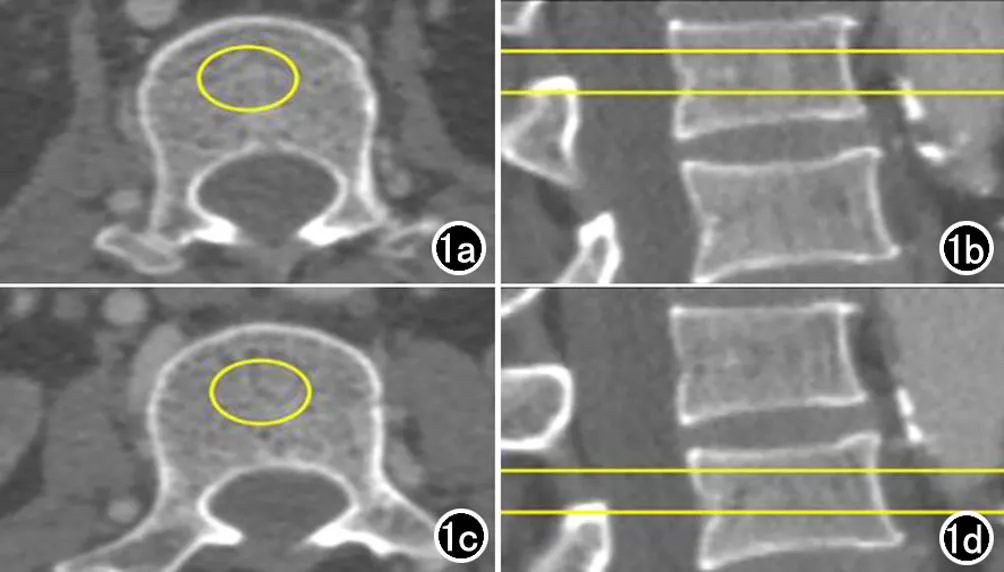
图1 腰椎骨密度测量示意图。a)于L1椎体中部层面椎体中心勾画ROI(黄圈); b) 在矢状面重组图像上确定L1椎体中部水平(黄线); c) 于L2椎体中部层面椎体中心勾画ROI(黄圈); d) 在矢状面重组图像上确定L2椎体中部水平(黄线)。
腹部脂肪含量的测量(图2):L2/L3层面为评估全腹部脂肪含量的最佳层面[6],本研究选用L3中心层面;利用“tissue composition”模块软件对脂肪组织自动染色,自动得出皮下脂肪(subcutaneous adipose tissue,SAT)、腹内脂肪(visceral adipose tissue,VAT)及腹部总脂肪(total adipose tissue,TAT)。
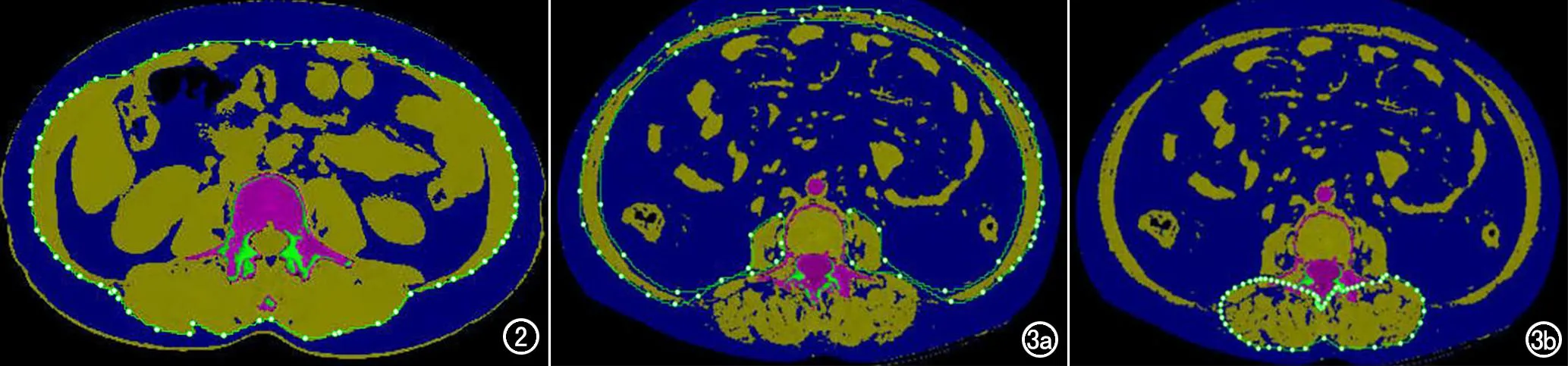
图2 绿色光圈外蓝色代表皮下脂肪含量,光圈内则代表腹腔内脂肪含量。 图3 实测图。a) 绿色光圈内的区域面积即为腹壁肌群面积,绿色光圈内的蓝色脂肪面积即为腹壁肌群脂肪含量; b) 椎旁肌群面积和肌肉内脂肪含量的测量。
肌肉含量及肌肉内脂肪含量的测量(图3):同样利用“tissue composition”模块进行测量。研究证实第三腰椎椎体水平骨骼肌面积(skeletal muscle area at the third lumbar vertebral plane,L3-SMA)最能反映全身肌肉质量[7]。本研究为确保测量结果的准确性,分别测量L3水平椎旁肌群及腹壁肌群面积和肌内的脂肪含量,两者相加得到L3-SMA,L3层面肌肉内的脂肪含量(L3-intramuscular fat,L3-IMAT)。
3.统计学分析

结 果
1.维持性血液透析患者骨量状况
106例MHD患者中骨量正常者占57.55%(61例),骨量异常者占42.45%(45例),其中骨量减低者占26.41%(28例),骨质疏松者占16.04%(17例)。在17例骨质疏松患者中女性占比70.59%(12例)高于男性29.41%(5例)。
2.骨量正常组和骨量异常组体成分及临床资料的比较
骨量正常组的BMD高于骨量异常组的BMD,差异具有统计学意义(t=14.927,P<0.001),而两组间的性别(χ2=1.892,P=0.169)、透析龄(Z=-0.363,P=0.717)、TG(Z=-0.022,P=0.982)、HDL-C(Z=-1.218,P=0.223)、ALB(t=0.307,P=0.759)及Ca(t=0.372,P=0.711)水平差异无统计学意义。骨量异常组的年龄(t=-4.46,P<0.001)、TC(t=-2.215,P=0.029)、LDL-C(t=-2.191,P=0.031)及P(t=-2.175,P=0.032)水平均高于骨量正常组,差异具有统计学意义。在两组的体成分信息对比方面,骨量异常组的VAT(Z=-3.714,P<0.001)、SAT(Z=-2.010,P=0.044)、TAT(Z=-3.327,P<0.001)、L3-SMA(t=2.335,P=0.021)及L3-IMAT(Z=-5.085,P≤0.001)高于骨量正常组,差异具有统计学意义(表1)。

表1 骨量正常组和骨量异常组体质成分及临床资料的比较
3.腰椎BMD与体成分及各指标的相关性分析
表2所示MHD患者的腰椎BMD与L3-SMA呈正相关(r=0.264,P=0.006),与年龄(r=-0.514,P<0.001)、VAT(r=-0.413,P<0.001)、SAT(r=-0.268,P=0.006)、TAT(r=-0.392,P<0.001)、L3-IMAT(r=-0.515,P<0.001)及TC(r=-0.208,P=0.032)呈负相关。透析龄、TG、HDL-C、LDL-C、ALB、Ca及P与腰椎BMD无明显相关性(P>0.05)。
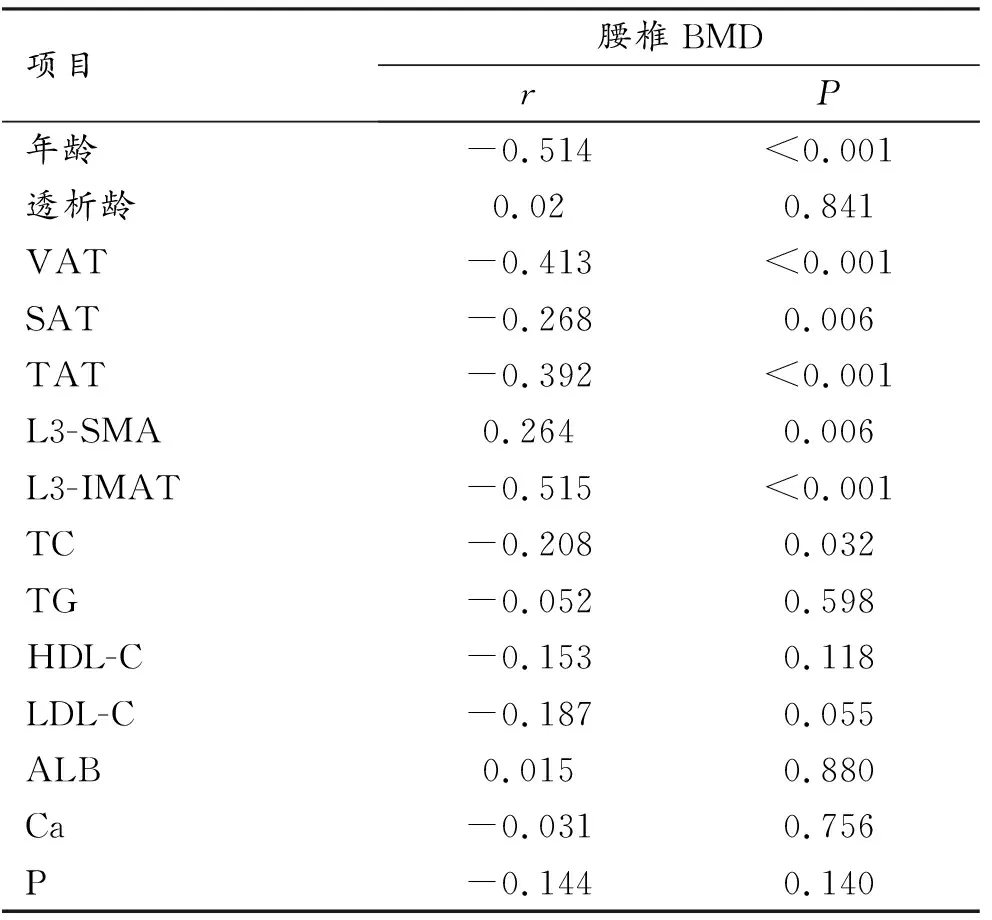
表2 腰椎BMD与体成分及各指标的相关性分析
4.维持性血液透析患者骨量异常危险因素的Logistic回归分析
将年龄、L3-IMAT、VAT、P纳入多因素Logistic回归。结果显示高血磷(OR=3.393,95%CI:1.405~8.196,P=0.007)、高龄(OR=1.071,95%CI:1.026~1.118,P=0.002)及高L3-IMAT(OR=1.080,95%CI:1.025~1.138,P=0.004)是MHD患者发生骨量异常的危险因素(表3)。

表3 维持性血液透析患者骨量异常危险因素的Logistic回归分析
讨 论
骨质疏松症是指因各种原因导致的骨质流失,BMD下降的全身性代谢性疾病[8],在除外外伤等诱发骨折的因素后,骨质疏松是最常见的骨折原因。骨质疏松性骨折是MHD患者的常见并发症,不仅增加患者的痛苦感,而且因为一系列连锁反应,加重患者生存负担,增加患者的死亡率[9]。因此,探索MHD患者BMD与各个指标的关系,发现BMD下降的危险因素具有重要的临床意义。
肥胖与骨强度下降和骨质疏松有千丝万缕的联系,以往常常用臀围、腰围、体重及body mass index来评价肥胖,均有一定的片面性,因其反映的是整体肥胖情况。现普遍认为测量不同部位的脂肪含量具有更加重要的临床意义,高水平VAT比SAT具有更大的危害性。本研究利用QCT测量MHD患者L3层面的腹部脂肪组织,显示VAT、SAT、TAT与BMD呈负相关,这与Wang[10]研究结果相一致,不仅仅是MHD患者,在健康的人群中也有学者认为BMD与腹部脂肪组织存在负相关性,Wang[11]研究了320名女性,发现L4层面VAT、SAT、TAT与BMD呈负相关。脂肪组织的过度蓄积不仅影响形体美观,增加骨骼及肌肉的机械负荷,而且对骨代谢有不利影响,脂肪组织具有重要的内分泌功能,能分泌多种激素及脂肪因子,如瘦素、脂联素、雌激素、肿瘤坏死因子α及白细胞介素6等,这些物质通过多种复杂的途径影响骨的形成和吸收,参与骨质疏松的形成与发展[12]。各种脂肪因子的合成及分泌紊乱将会破坏骨平衡,破骨细胞活性相对增加,最终导致骨质流失、骨质疏松[13]。
骨骼和肌肉在解剖及功能上联系紧密,它们共同参与机体的运动行为,肌肉产生的机械刺激可促进成骨细胞的活动,增加BMD,学者发现肌肉可产生多种化学物质来提高BMD[14],骨密度下降往往伴有肌肉的丢失。骨质疏松症与肌肉减少症常常相伴发生,有学者将二者的异常作为“活动功能障碍综合征”(dysmobility syndrome)[15]进行研究,这些都表明骨骼和肌肉存在正相关性。本研究发现L3-SMA与BMD存在正相关性,这与以上观点相一致。Cherif[16]发现了全身肌肉与骨密度正相关,肌肉是影响骨密度的关键积极因素。
IMAT也是目前研究的热点,QCT在测出SMA的同时,自动计算出了IMAT。对肌进行评价时测量IMAT比肌肉的大小更有意义[17],本研究发现L3-IMAT与BMD之间存在负相关性,且是MHD患者骨量异常的独立危险因素。IMAT组织过量浸润对BMD有不良影响。IMAT对骨密度的影响是多方面的,更多的是通过对肌肉的不利影响来间接导致BMD的下降。日本的一项研究学者发现IMAT对肌肉功能的影响甚至要大于肌肉含量对肌肉功能的影响[18],也有研究指出IMAT的增加也会导致肌肉质量的降低[19]。IMAT的过度蓄积会导致机体炎症状态,增加胰岛素抵抗程度,同腹部脂肪组织一样,IMAT组织也具有内分泌功能,这些都可能是其导致BMD下降原因。因此MHD患者在保证自身安全的同时,应该积极参与适量运动,合理的膳食,这些都可减少腹部脂肪及肌肉内脂肪的蓄积对BMD产生的不良影响。
本研究分析了BMD与MHD患者的临床资料及血液生化指标的关系,发现年龄与BMD呈负相关,多因素Logistic回归显示高龄是MHD患者骨量异常的独立危险因素,可能是由于高龄患者活动减少,体内激素水平下降及营养吸收不良有关。年龄作为MHD患者骨质疏松的传统危险因素,以往很多研究已经得到证实。关于血脂与BMD的关系一直有很大争议存在,本研究发现透析患者的BMD与TC呈负相关,而与其他血脂指标无相关性。GO[20]发现腰椎BMD与TC、LDL-C及HDL-C无关;有研究报道TC、TG、LDL-C及HDL-C呈负相关,这也是目前多数研究所支持的观点[21-22];少数研究认为血脂与BMD正相关[23]。血脂对骨密度的影响是多方面的,之所以出现多种不同的结果,可能是由于纳入研究的人群特征不同所导致的。MHD患者血脂与BMD的关系还需要更加深入的研究。
本研究结果显示MHD患者血清P、Ca与BMD无相关性,与其他学者研究结果一致[24],但是多因素Logistic回归分析发现血磷是MHD患者骨量异常的独立危险因素,可见高磷血症是MHD患者发生骨量异常的非传统危险因素,这与LU[25]研究结果相一致。血磷在骨代谢中扮演着极其重要的角色,高磷血症是肾性骨营养不良进展的中心环节,高血磷刺激甲状旁腺细胞产生过多的甲状旁腺激素,甲状旁腺激素导致骨溶解加速,释放出更多血磷,从而形成恶性循环,导致骨代谢紊乱,骨质疏松。因此,MHD患者要注意高磷血症的发生。
本研究存在一些不足。首先,本研究是一个单中心研究,纳入样本量不足。其次,利用QCT测量的只是最能代表全身体成分的单个层面的信息,并不能完全反映整体的体成分。最后,利用L3-SMA诊断肌肉减少症的标准并未统一,以往有大样本(2115例)研究提出L3-SMI(L3-SMA除以身高的平方)诊断肌少症的标准为男性<52.4 cm2/m2,女性38.5 cm2/m2[26],得到了一定的认可,但本研究未能分析肌肉减少症与骨量异常的关系。
综上所述,本研究基于QCT技术,发现MHD患者BMD与体成分密切相关,并分析骨量异常的相关危险因素,QCT体成分分析具有重要的临床意义,尤其是在骨质疏松症的早期发现方面。
