多方位MRI影像组学预测局部进展期直肠癌新辅助放化疗疗效
2024-03-01周晓俞杨筠刘学焕包翠萍董龙春刘筠
周晓俞, 杨筠,刘学焕, 包翠萍, 董龙春,刘筠
结直肠癌是我国常见的消化道肿瘤之一,发病率和死亡率均呈上升趋势[1]。局部进展期直肠癌(locally advanced rectal cancer,LARC)被定义为侵出肠壁肌层的原发性肿瘤(T3~T4),伴或不伴外周淋巴结转移(N0~N2),且通过影像学或病理学检查无远处转移[2]。术前新辅助放化疗(neoadjuvant chemoradiation,nCRT)后6~8周行全直肠系膜切除术(total mesorectal excision,TME),术后辅助化疗已成为LARC的标准治疗方案[3]。nCRT可以最大限度杀伤肿瘤细胞,缩小肿瘤体积,降低微小转移灶的发生,而且还能提高保肛率,降低复发率,改善预后[4,5]。因此,治疗前准确评判nCRT疗效对临床制定个体化诊疗方案尤为关键。目前影像组学对于nCRT疗效预测大多数是基于横轴面图像肿瘤最大层面的特征,缺乏对病变的整体反映,也有一些研究是基于肿瘤体积的特征,但手动分割耗时较长、可重复性差,临床应用存在局限性[6,7]。本研究基于MRI影像组学方法,手动分割T2WI序列横轴面、矢状面及冠状面图像提取LARC病灶影像组学特征,并联合临床及常规影像特征,构建nCRT疗效预测模型,为临床疗效预判提供参考。
材料与方法
1.研究对象
回顾性搜集2016年1月至2020年7月在天津市人民医院收治的经病理活检及临床、影像综合诊断为LARC,并经nCRT后6~8周接受TME手术的209例患者。病例纳入标准:①经病理证实为直肠癌;②局部进展期,无远处转移;③进行新辅助放化疗;④术后有肿瘤退缩分级的病理资料;⑤MRI图像满足分析要求。病例排除标准:①临床及病理资料不完整;②未完成全部疗程新辅助放化疗;③既往有其他恶性肿瘤史或放化疗治疗史。本研究共搜集357例患者,排除病理资料不完整者110例,病理证实为其他组织类型者23例(黏液腺癌15例,印戒细胞癌6例,腺鳞癌2例),新辅助放化疗疗程不完整者15例,最终209例患者纳入本研究,其中男155例,女54例,年龄28~85岁,平均(58.19±10.16)岁。搜集患者nCRT前年龄、性别、身高、体重、血清癌胚抗原(carcinoembryonic antigen,CEA)、CA199、血红蛋白、中性粒细胞、淋巴细胞等资料,并计算中性粒细胞-淋巴细胞比例(neutrophil-lymphocyte ratio,NLR)。
nCRT方案按照结直肠癌诊疗指南进行,nCRT方案为放疗+卡培他滨化疗:放疗5周,剂量45.0~50.4 Gy/25~28次,单次剂量1.8~2.0 Gy;期间卡培他滨825 mg/m2,每天2次,每周5天。
2.MRI检查方法及图像分析
所有患者nCRT前均行直肠MRI检查,采用3.0T磁共振扫描仪(Siemens magnetom skyra,西门子,德国),18通道相控阵线圈。检查前禁食6~8 h,并清洁灌肠。检查时对患者进行呼吸训练,以减少呼吸及运动伪影。扫描序列包括轴面、矢状面、冠状面T2WI及轴面T1WI,具体扫描参数见表1。
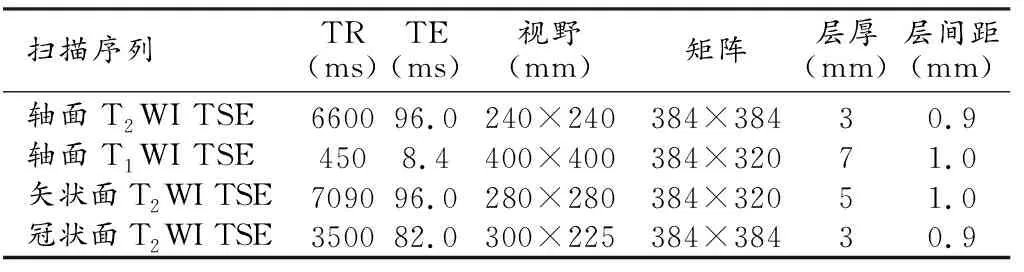
表1 直肠癌MRI扫描序列及参数
MRI图像评估由两位高年资影像诊断医师进行,产生分歧时与另一位高年资医师协商后达成一致。分析指标包括肿瘤长径、肿瘤下缘距肛缘的距离(distance of tumor from the anal verge,DTAV)、直肠癌环周切缘 (circumferential resection margin,CRM)、壁外血管侵犯(extramural venous invasion,EMVI)、T分期、N分期等常规影像特征。CRM是指直肠肿瘤浸润最深处与直肠系膜筋膜之间的最短距离,CRM≤1 mm为环周切缘阳性,反之为阴性[8]。EMVI定义为在固有肌层以外的脉管系统中存在肿瘤细胞,根据文献标准将EMVI分成0~4级,0~2级为EMVI阴性,3~4级为EMVI阳性[9]。参照美国癌症联合委员会(American joint committee on cancer,AJCC)第7版TMN分期标准,将直肠癌分为四期,局部进展期直肠癌包括T3期和T4期。T3期:肿瘤突破固有肌层侵入直肠周围组织;T4 期:肿瘤侵犯腹膜及邻近组织、器官 (如直肠系膜筋膜、前列腺、精囊腺、膀胱及阴道等)。N分期阳性:淋巴结短径≥1 cm或淋巴结短径为0.5~1.0 cm,淋巴结边界不清,边缘毛糙,形态不规则,内部信号不均匀;反之为N分期阴性。
3.病理退缩分级
直肠癌术后标本由高年资病理专家按照第七版AJCC病理退缩分级(tumor regression grading,TRG)标准进行分级:0级,病理组织中无癌细胞残留;1级,病理组织中有单个或小簇癌细胞残留;2级,病理组织中仍有残留癌灶伴有间质纤维化;3级,病理组织中仅少数或者未见癌细胞消退[10]。TRG0~1级定义为nCRT反应良好(Good responders,GR),TRG2~3级定义为nCRT反应不良(non-good responders,non-GR)。
4.影像组学分析
图像分割:从PACS系统中分别将T2WI序列横轴面、矢状面及冠状面肿瘤最大层面图像导入MaZda(版本:4.6.2.0)软件中进行分析,沿病灶边缘手动勾画感兴趣区(region of interest,ROI),尽量包含全部病灶,同时避开含气肠腔、直肠系膜、血管等非病灶组织,每幅图像勾画两次ROI,如果产生分歧,则邀请其他高年资诊断医师指导。
影像组学特征提取及筛选:每个ROI均可提取直方图、梯度、灰度共生矩阵(grey level cooccurrence matrics,GLCM)、游程矩阵(run-length matrics,RLM)、几何、自回归模型以及小波特征等379个影像组学特征,删除有缺失值的特征,剩余特征采用组内相关系数(intraclass correlation coefficient,ICC)对两次提取的结果进行一致性检验,然后筛选一致性较好(ICC≥0.9)的特征计算两次结果的平均值,并对均值进行Z-score标准化,最后采用最小绝对收缩和选择算法(least absolute shrinkage and selection operator,LASSO)进行特征降维,获取最佳特征。
模型构建:根据筛选的特征与对应系数乘积分别计算横轴面、矢状面、冠状面以及联合图像影像组学评分,构建影像组学标签。然后将联合影像组学标签与临床、常规影像特征进行多因素Logistic分析,构建联合预测模型。
模型验证及评估:将患者按照1:1比例随机分为训练组与验证组,对模型进行内部验证。采用受试者工作特征(receiver operating characteristic,ROC)曲线评价模型的预测能力,并使用Delong检验比较不同模型的差异。采用校正曲线评估模型的校正性,并使用Hosmer-Lemeshow检验分析拟合度,评估预测结果与实际状态的一致性。最后通过临床决策曲线(decision curve analysis,DCA)评价模型临床价值。
5.统计学分析
采用SPSS 22.0软件、R语言(Verision 4.0.3)进行统计学分析。计量资料采用Kolmogorov-Smirnov行正态性检验,符合正态分布者以均值±标准差表示,组间比较采用两独立样本t检验;不符合正态分布者以中位数(四分位间距)表示,组间比较采用非参数秩和检验。计数资料以例(%)表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
结 果
1.新辅助放化疗GR组与non-GR组患者的一般资料比较
209例患者中GR组61例(其中TRG0级30例,TRG1级31例),其中男47例,女14例,年龄28~77岁,平均(59.30±10.38)岁;non-GR组148例(TRG2级77例,TRG3级71例),其中男108例,女40例,年龄29~85岁,平均(57.74±10.06)岁。两组在年龄、性别、身体质量指数(body mass Index,BMI)、Hb、CA199等方面差异均无统计学意义(P均>0.05),而non-GR组CEA升高的患者比例明显高于GR组,差异有统计学意义(P<0.05,表2)。
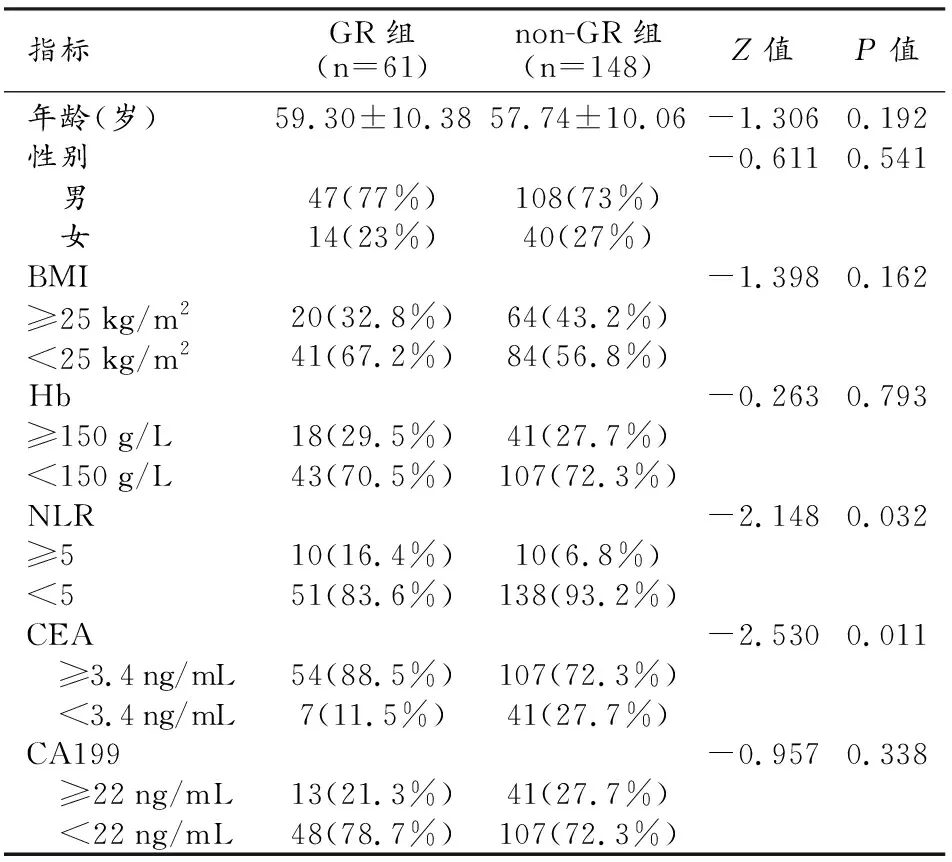
表2 GR组与non-GR组患者的一般资料比较 (n,%)
2.新辅助放化疗GR组与non-GR组的MRI图像特征比较
GR组与non-GR组在肿瘤长径、T分期、N分期、CRM上差异无统计学意义(P>0.05),而non-GR组DTAV≥5 cm、肿瘤长径>5 cm、EMVI阳性(图1、2)的患者比例显著高于GR组,差异有统计学意义(P<0.05,表3)。

图1 直肠中段腺癌患者,男,64岁,T3NO,nCRT反应良好,TRG2级,肿瘤结节状穿透肠壁,病变周围没有明显的血管结构(箭),EMVI 1级(阴性)。 图2 直肠下段腺癌患者,男,85岁,T3N1,nCRT反应良好,TRG2级,肿瘤结节状穿透肠壁,肿瘤邻近血管管腔内可见中等信号,但血管管腔轻度扩张(箭),EMVI 3级(阳性)。 图3 直肠中段腺癌患者,女,58岁,T3N1M0,CRM(-),EMVI(-),局部进展期直肠癌MRI图像分割结果。a)T2WI横轴面图像;b)T2WI矢状面图像;c)T2WI冠状面图像;d)术后病理图片,镜下可见大量癌细胞残留(TRG2级),non-GR组(×40,HE)。

表3 GR组与non-GR组的MRI图像特征比较 (n,%)
3.图像分割
使用MaZda软件在T2WI序列横轴面、矢状面及冠状面图像上手动勾画ROI。勾画ROI应尽量包括全部肿瘤病灶,避开含气肠腔、直肠系膜、血管等非病灶组织(图3、4)。

图4 直肠中段腺癌患者,男,62岁,T3N2M0,CRM(-),EMVI(-),局部进展期直肠癌MRI图像分割结果。a)T2WI横轴面图像;b)T2WI矢状面图像;c)T2WI冠状面图像;d)术后病理图片,镜下未见确切癌细胞残留(TRG0级),GR组(×40,HE)。
4.影像组学特征筛选
基于T2WI序列横轴面(TRA)、矢状面(SAG)及冠状面(COR)图像分别提取出379个影像组学特征,删除28个有缺失值的特征,剩余351个特征计算ICC,其中一致性较好(ICC≥0.9)的特征中TRA 96个,SAG 88个,COR 91个。选择一致性较好的特征并计算两次提取结果的均值,并进行标准化。将标准化后的特征汇总,获得联合图像(COM)特征275个。然后利用LASSO回归模型十倍交叉验证,通过调节不同参数的lambda值获得最小的偏差(图5),最后筛选出最佳的影像组学特征,其中TRA 4个,SAG 5个,COR 2个,COM 7个(表4)。
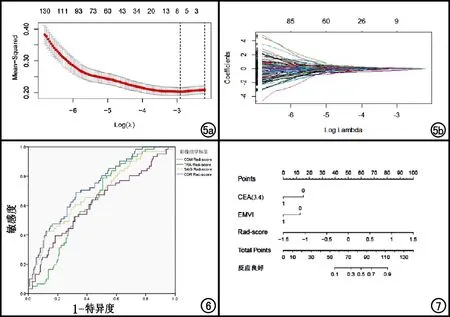
图5 LASSO模型筛选影像组学特征及特征的系数收敛图。a)虚线表示经过10倍交叉验证后选择的log(λ)值,左侧的虚线为最小λ值,右侧虚线为距离最小λ值一个标准误差所对应的λ值;b)每一个影像组学特征在模型中的系数。 图6 不同影像组学标签预测nCRT疗效的ROC曲线。图7 nCRT疗效预测nomogram图。EMVI:1代表阳性,0代表阴性;CEA3.4:0代表CEA≤3.4 ng/mL,1代表CEA>3.4 ng/mL。

表4 LASSO回归筛选的影像组学特征
5.模型构建
影像组学标签构建:将筛选的特征与其对应的回归系数相乘计算影像组学评分,构建影像组学标签,COM、TRA、SAG、COR四个影像组学标签模型预测nCRT疗效的AUC值分别为0.731(95%CI:0.659~0.803)、0.637(95%CI:0.561~0.712)、0.682(95%CI:0.602~0.762)、0.619(95%CI:0.533~0.704,图6),COM影像组学标签的预测效能均高于TRA、SAG、COR三个影像组学标签,AUC值差异有统计学意义(Delong检验,P<0.05)。
nCRT疗效独立预测因素筛选:将单因素分析结果中有统计学差异的因子CEA(3.4)、EMVI、NLR、肿瘤长径(5 cm)、DTAV及COM影像组学标签同时纳入多因素logistic分析,分析结果显示,CEA(3.4 ng/mL)、EMVI及COM影像组学标签是nCRT疗效的独立预测因素(表5)。

表5 多因素logistic分析结果
联合预测模型构建:联合多因素分析筛选出的独立预测因素构建联合预测模型(图7),分别给各独立预测因素赋分,总分越高,LARC新辅助放化疗反应良好的概率越高。其回归方程为logit=-1.369-0.827×EMVI-1.017×CEA(3.4)+2.396×COM Rad-score。
联合预测模型与COM影像组学标签比较:COM影像组学标签与联合预测模型预测nCRT疗效的AUC值分别为0.731(95%CI:0.659~0.803)、0.811(95%CI:0.748~0.874,图8)。联合预测模型的预测效能显著高于COM影像组学标签,两者AUC值差异有统计学意义(Delong检验,P<0.05)。
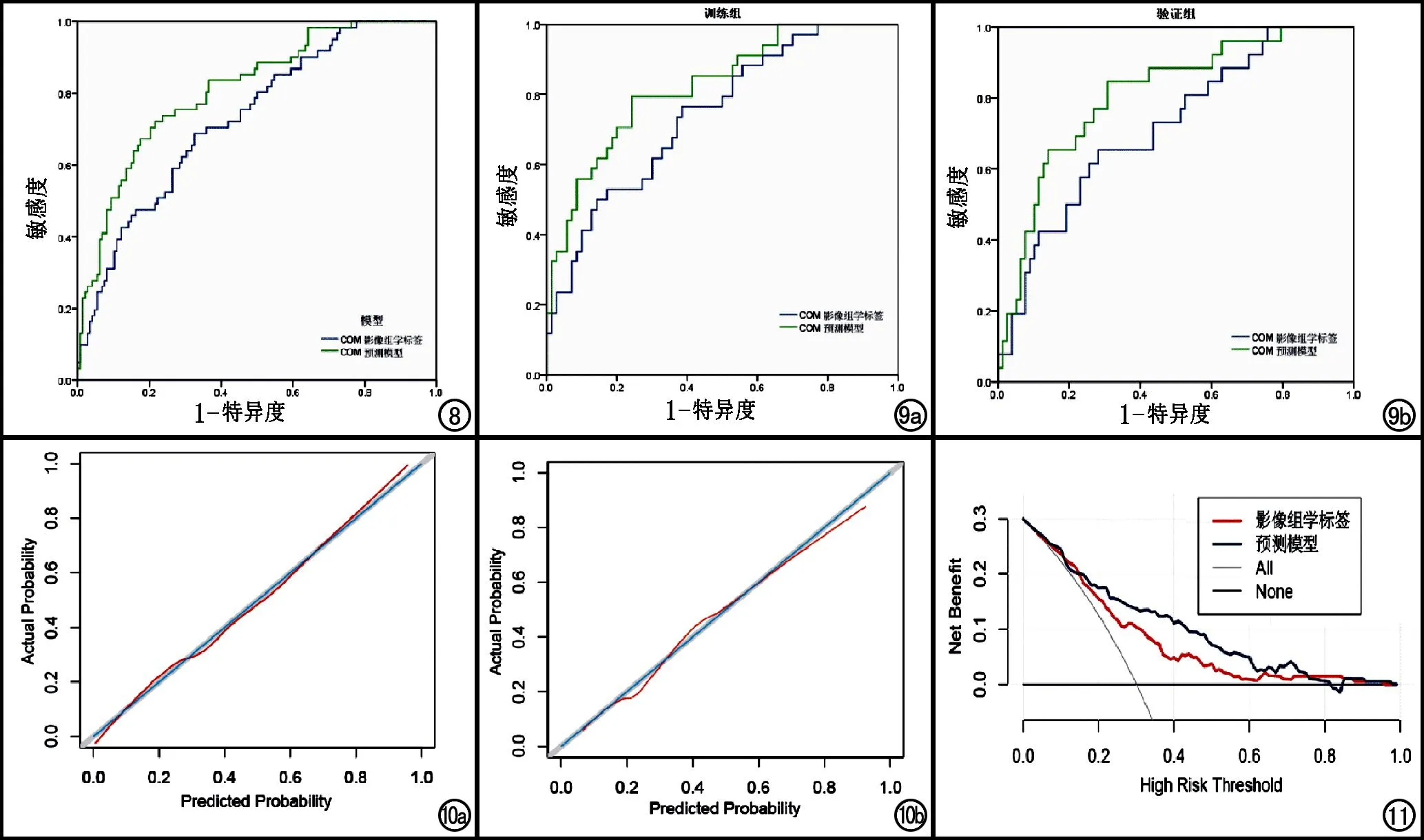
图8 COM影像组学标签与联合预测模型预测nCRT疗效的ROC曲线。 图9 a)COM影像组学标签和联合预测模型在训练组中预测nCRT疗效的ROC曲线;b)COM影像组学标签和联合预测模型在验证组中预测nCRT疗效的ROC曲线。 图10 校准曲线X轴为预测概率,Y轴为实际概率。蓝色实线代表理想曲线,红色实线代表校正曲线。a)COM影像组学标签的校准曲线;b)联合预测模型的校准曲线。图11 COM影像组学标签与联合预测模型的DCA曲线。DCA曲线X轴为阈值概率,Y轴为净获益率。黑线代表全部患者不接受nCRT,灰线代表所有患者均行术前nCRT,红线代表COM影像组学标签,蓝线代表联合预测模型。
6.模型验证及评估
内部验证:COM影像组学标签和联合预测模型在训练组中预测nCRT疗效的AUC值分别为0.744(95%CI:0.646~0.842)、0.824(95%CI:0.740~0.908,图9a);COM影像组学标签和联合预测模型在验证组中预测nCRT疗效的的AUC值分别为0.716(95%CI:0.605~0.828)、0.809(95%CI:0.714~0.903,图9b)。两种模型在训练集和验证集的AUC值差异均无统计学意义(Delong检验,P>0. 05),表明两种模型的组内验证具有较高的可重复性。
校准曲线:校准曲线显示联合预测模型及COM影像组学标签均具有较高的校准度,Hosmer-Lemeshow拟合度检验P值分别为0.481、0.739(图10),均大于0.05。
临床决策曲线:临床决策曲线显示当阈值概率为0.16~0.78时,联合预测模型的净获益率高于COM影像组学标签,说明COM影像组学标签和联合预测模型预测进展期直肠癌nCRT疗效均具有临床实用价值,且联合预测模型的临床实用价值高于COM影像组学标签(图11)。
讨 论
目前,预测LARC新辅助治疗疗效的研究很多,但大多数只研究了其中一种或几种预测因子。本研究最大限度地纳入了临床、影像及血清生物标志物对nCRT疗效有预测价值的因子,并且这些因子在文献中均有相关报道。Liu等[11]研究表明BMI是LARC患者nCRT的独立预后因素,而年龄、性别与肿瘤分化程度、淋巴结转移等病理特征及放化疗的耐受性相关。本研究两组间年龄、性别及BMI差异均无统计学意义。CEA已被证明是预测nCRT反应有价值的标志物[12]。多项研究显示较低的治疗前CEA水平与pCR有一定相关性。本研究多因素分析结果显示CEA是直肠癌nCRT疗效的独立预测因子,与文献报道一致[13]。Chung等[14]认为CA199对预测nCRT疗效很有价值。Song等[15]的多因素分析结果显示治疗前CA199水平与降期显著相关,且nCRT前后CA199之比<1.28可作为nCRT疗效的预测因子[15]。而本研究单因素分析结果显示两组间CA199差异无统计学意义。关于其他肿瘤标志物(如CA125、CA153等)未见相关文献报道。相关研究证实Hb、NLR等对nCRT疗效有一定预测价值[16,17]。本研究结果显示Hb在两组间差异无统计学意义,而NLR可能是直肠癌nCRT疗效的潜在预测因子,这与Ramsay等[17]的研究结果一致,但多因素分析结果显示NLR并不是nCRT疗效的独立预测因子。其他血清标志物(血小板、C-反应蛋白等)也对nCRT疗效有一定预测价值,但AUC值仅为0.387~0.673,预测效能较低[16,18]。
本研究纳入了DTAV、肿瘤长径、T分期、N分期、EMVI、CRM等常规影像特征进行分析。T分期基于肿瘤对肠壁的浸润深度,分期越晚,恶性程度越高,nCRT疗效越差[19]。相关研究表明nCRT前T分期及N分期是PCR的独立预测因子[20]。N分期表示区域淋巴结是否发生转移,通常认为较低的N分期与nCRT后更好的病理反应有关。而本研究单因素分析结果显示两组间T分期和N分期差异无统计学意义,这与Van等[18]的研究结果一致。Engel等[21]的研究结果也显示N分期不能作为nCRT的预测因子。笔者分析认为可能是MRI评估依赖医师的经验,具有一定主观性,并且评价淋巴结转移通常综合了大小、形态、边缘、信号等多种特征,缺乏确切的评判标准,诊断准确度较低。有研究显示肿瘤长径、DTAV均与nCRT疗效明显相关,认为肿瘤长径、DTAV可作为nCRT疗效的预测因子, 肿瘤长径越小,DTAV值越大,nCRT后越可能达到病理完全缓解[12]。本研究结果与其一致,但仅限于单因素分析中,多因素分析结果显示肿瘤长径、DTAV并不是nCRT疗效的独立预测因子。CRM受累不仅是局部复发的独立预测因子,也是nCRT疗效的独立预测因子[22]。本研究结果显示两组间CRM差异无统计学意义,笔者分析认为可能由于解剖评估困难,MRI评估CRM准确性降低。EMVI不仅在LARC患者生存预后及肿瘤复发预测方面发挥着重要作用,也被推荐为预测nCRT疗效的影像学标记物[23]。本研究结果也显示EMVI是nCRT疗效的独立预测因子。Shaish等[24]认为对于小血管(<3mm),MRI并不能准确评估EMVI。也有研究认为EMVI预测nCRT疗效的敏感度及特异度均有限[25]。肿瘤分子生物标志物DNA甲基化、肿瘤免疫微环境、miRNA、APAF-1、Ki67血管内皮生长因子、KRAS、P53、MLH1和MSH2等对nCRT疗效也具有一定的预测价值[26-28],但基因检测昂贵,临床应用价值有限。
本研究提取了游程矩阵特征、灰度共生矩阵特征、几何特征以及小波特征,且多因素分析结果表明影像组学标签是nCRT疗效的独立预测因子,游程矩阵、灰度共生矩阵等特征在预测nCRT疗效中具有重要价值,与文献研究结果一致[29]。本研究首次联合了T2WI序列横轴面、矢状面及冠状面多方位MRI图像手动勾画ROI,既克服了勾画肿瘤体积的费时费力、可重复性差等缺点,也优化了勾画肿瘤单一方位最大层面图像缺乏对病灶整体信息反应的不足,并且构建的影像组学标签模型预测nCRT疗效的AUC值为0.731,高于文献报道(AUC值为0.71)[30]。本研究最大限度纳入了临床、影像对nCRT疗效有预测价值的因子,影像组学标签联合CEA、EMVI等独立预测因子后,模型预测效能进一步提高,AUC值为0.811。Shi等[31]也发现影像组学标签联合独立预测因子后确实能提高模型的预测效能。而且本研究的预测模型在训练组和验证组中也得到了很好的验证,AUC值分别为0.824、0.809,校准曲线也显示很好的校准度。Bibault等[32]采用不同模型预测nCRT疗效,结果显示深度学习神经网络、线性回归和支持向量机模型预测pCR的AUC值分别为0.72、0.52、0.62。而本研究模型的预测效能均高于上述模型,模型可靠性高、操作简单,只需将每例LARC患者nCRT前CEA水平是否高于3.4 ng/mL、EMVI是阳性还是阴性以及影像组学标签评分代入到nomogram图中进行赋分,就可以计算出nCRT反应良好的概率;从而辅助临床在治疗前对nCRT疗效进行预测分层,确定哪些患者可以从nCRT中获益,为评估LARC患者是否需要nCRT提供影像依据。对nCRT无效的患者,及时手术可能是最佳的治疗策略,同时也避免了放化疗的副作用;从而推动个体化治疗,使患者生存预后获得最大收益。
本研究存在以下局限性:首先,本研究为回顾性设计,存在不可避免的选择偏倚,且患者来自同一机构,有待多中心数据进行外部验证;其次,由于DCE-MRI在日常工作中并没有常规使用,并且预测价值较低,而ADC值预测nCRT疗效的敏感度和特异度均不高[33]。而T2WI序列在日常工作中使用更多,并且预测效能更高。故本研究仅研究了T2WI序列影像组学特征,并且仅构建了logistics回归模型,有待增加DCE-T1等序列进一步研究,并构建支持向量机、随机森林等不同预测模型;最后,由于样本量有限,本研究未对pCR单独建模,有待扩大样本量建立pCR模型进一步研究。
综上所述,基于T2WI序列横轴面、矢状面及冠状面图像构建的多方位影像组学标签可作为新的生物标志物在治疗前对LARC患者nCRT疗效进行预测,联合CEA、EMVI等构建的联合预测模型,预测效能进一步提高,可为LARC患者个体化诊疗方案的制定,实现患者最大治疗收益,同时减少不必要的治疗损伤提供重要依据。
