基于三重网络模型的酒精依赖患者静息态动态功能连接分析
2024-03-01曹景超隋文禹喻大华薛婷
曹景超,隋文禹,喻大华,薛婷
酒精依赖(alcohol dependence,AD)属于酒精使用障碍,其特点是对酒精极度渴求,无法控制地持续性摄入[1]。目前饮酒已成为世界公共卫生问题之一[2]。研究发现,长期大量饮酒会导致大脑白质过度流失和认知功能受损,出现认知障碍、神经变性和记忆力衰退等神经精神症状[3]。
功能MRI技术的发展为大脑活动和功能的研究提供了极大的帮助。近年来,有许多研究通过分析大脑网络之间的功能连接变化来分析疾病的发病机制[4]。中央执行网络(central executive network,CEN)、突显网络(salience network,SN)与默认模式网络(default mode network,DMN)是大脑核心神经认知网络,其间的异常交互作用是成瘾神经精神疾病的病理生理学基础[5,6]。有研究发现,大脑在静息状态下的活动也不是一成不变的,而是时刻在变化的[7]。采用动态的方法分析大脑网络的功能变化,可以更清楚地观察到三重网络之间功能连接的变化。目前关于酒精依赖患者大脑三重网络的动态功能连接情况的相关研究还较少,大多数研究探究的是静态脑网络功能连接的变化。因此,本研究使用动态功能网络连接(dynamic function network connectivity,dFNC)分析方法,比较酒精依赖患者和健康被试在静息态下大脑三重网络功能连接的差异,为探索酒精依赖这一成瘾性疾病的病理生理机制提供一定的线索。
材料与方法
1.研究对象
2020年2月-2021年3月在内蒙古科技大学包头医学院第一附属医院招募15例酒精依赖患者和15例年龄与患者组相匹配的健康对照(health control,HC)。酒精依赖组纳入标准:①男性,年龄30~60岁;②符合精神疾病诊断与统计手册(diagnostic and statistical manual of mental disorders,DSM)第四版中酒精依赖的诊断标准;③酒精依赖评估量表(alcohol dependence scale,ADS)评分大于14分;④无其它神经或精神疾病史,如抑郁症、失眠症和精神分裂症等;⑤右利手。对照组的纳入标准:①无精神疾病;②无物质成瘾史;③右手为惯用手。所有被试的排除标准:①存在神经或精神疾病;②除酒精之外有其它物质成瘾史,如吸烟等;③有MRI检查禁忌证;④有高血压、糖尿病和冠心病等疾病;⑤MR扫描期间头部平移运动范围大于2 mm,或转动角度大于2°,或者平均帧间头动距离大于0.2 mm。
本研究经医院伦理委员会批准。所有被试在了解全部的实验内容和注意事项后,签署了知情同意书。
2.功能MRI数据采集
使用Philips Achieva 3.0T磁共振扫描仪上获取所有被试的静息态(rest state,rs)fMRI数据。扫描前将每例被试的头部固定在泡沫垫中,并嘱其佩戴耳塞用于减弱机器噪声。使用EPI序列进行rs-fMRI扫描,扫描参数:TR 2000 ms,TE 30 ms,视野240 mm×240 mm,数据矩阵64×64,翻转角90°,层厚5 mm,层数35,总时间点186。嘱每例被试在扫描过程中要一直保持清醒并闭上眼睛,不要思考任何事情。有两位放射科医师分析所有被试的MRI图像以排除有任何临床无症状性颅内病变。
3.数据预处理
fMRI数据预处理使用DPABI(http://www.rfmri.org/dpabi)软件包[8]。剔除前10个时间点的数据,然后进行时间层校正和头动校正,剔除头部位移大于2 mm或旋转角度大于2°的数据;将校正后的fMRI数据标准化到蒙特利尔神经学研究所(montreal neurological institute,MNI)坐标空间中;随后,对图像进行平滑处理(使用6 mm半高全宽的高斯核);最后,去除Friston 24头动参数、脑白质和脑脊液噪声信号协变量。
4.动态功能连接分析
使用GIFT软件包中的组独立成分分析(group independent component analysis,GICA)将fMRI数据分解成不同的内在连接网络[9]。首先,使用最小描述长度(minimum description length,MDL)算法确定独立成分(independence component,IC)数为63;其次,在个体水平上使用标准规模的主成分分析方法(principal component analysis,PCA)对fMRI数据进行降维,然后在组水平上使用期望最大化(expectation maximization,EM)算法将时间上串联起来的个体数据缩减至63。最后使用GICA反向重建算法得到了63个独立网络成分的空间分布图和时间序列。根据空间模板匹配和视觉检查,从独立成分中挑选出三重网络成分以进行后续的分析[10]。
随后,将挑选出来的三重网络成分进行后处理,以去除剩余的噪声源[11]。后处理步骤主要包括回归6个头动参数、去除时间序列趋势(线性、二次、三次趋势)、去除尖峰和使用0.15 Hz的滤波器进行滤波。
为了观察静息状态下功能连接(FC)的波动,使用22TR滑动窗口方法来计算IC时间序列之间的dFNC[11]。将该窗口与高斯(σ)函数卷积,并以1TR的步长进行滑动,最终每个被试得到154个FC矩阵。
将所有被试的FC矩阵进行k-means聚类分析,通过Elbow标准来确定最佳的聚类数目,并计算受试者的时间属性[12]:①时间分数,即某个状态的时间窗口占所有窗口数的比例;②平均停留时间,即某个状态持续的平均时间;③转换次数,即不同状态之间转换的次数。
5.统计分析
在GIFT软件中使用双样本t检验来评估两组被试在特定状态(某个状态持续的窗口数超过10个)下动态功能连接的差异,并进行错误发现率(false discovery rate,FDR)校正。统计学阈值为P<0.05。为了比较组间的不同属性,使用非参数置换检验(重复10,000次)来评估两组之间时间属性的差异,显著性阈值设为P<0.05,并对时间分数和平均停留时间应用FDR进行校正,然后将有差异的时间属性与ADS评分进行Spearman偏相关分析。
结 果
1.基本临床资料的分析结果
AD组中,有3例被试因头动程度明显而被剔除。因此,最终共12例AD患者和15例健康志愿者被纳入本研究。两组被试的基本临床资料的比较详见表1。两组之间各项临床资料的差异均无统计学意义(P≥0.05)。

表1 人口统计学资料和临床评分
2.dFNC分析结果
将ICs与斯坦福功能感兴趣区域标准模板进行匹配,并通过视觉检查,最终从63个ICs中挑选出18个网络成分。根据其解剖结构及其功能的先验知识[13-14],将18个ICs划分为3个功能网络(图1a),分别是CEN、SN和DMN。为了得到平均静态功能连接矩阵,计算了所有被试整个时间序列中各独立成分之间的Pearson相关性,并对其进行Fisher’s Z变换以提高数据的正态性和可比性(图1b)。每个IC的标签和空间分布情况见图2,峰值激活坐标详见表2。

图1 18个ICs的空间分布图和对应的静态功能连接矩阵。a)18个ICs被分为3个功能网络:中央执行网络(CEN),突显网络(SN),默认模式网络(DMN);b)所有被试的平均静态功能连接矩阵,矩阵左边和对角线的数字表示IC的索引,图中colorbar表示功能连接的Z值。

图2 三重网络的各个独立成分的详细图谱。

表2 18个ICs的峰值激活坐标和脑区名称
使用滑动时间窗方法,每个被试得到154个时间窗,27个被试总共得到4158个窗口。使用k-means聚类算法和Elbow标准确定聚类数目为4。每个聚类表示一种dFNC状态,其中聚类质心由该聚类中所有FC矩阵的中位数所表示。图3a显示了每种状态的聚类质心,图3b显示了每种状态下ICs之间功能连接强度前8%的连接(相关系数的绝对值)。状态1的FC矩阵比例为54%,表现为稀疏连接状态,该状态下脑网络功能连接普遍较弱;状态2的FC矩阵CEN内部有很强的正连接性,其比例为16%;状态3的FC矩阵比例为16%,其特征是CEN内部分强连接,并且SN与其他网络之间存在较强的负连接性;状态4与状态3时连接模式类似,但在CEN内部功能连接减弱,FC矩阵的比例为14%。
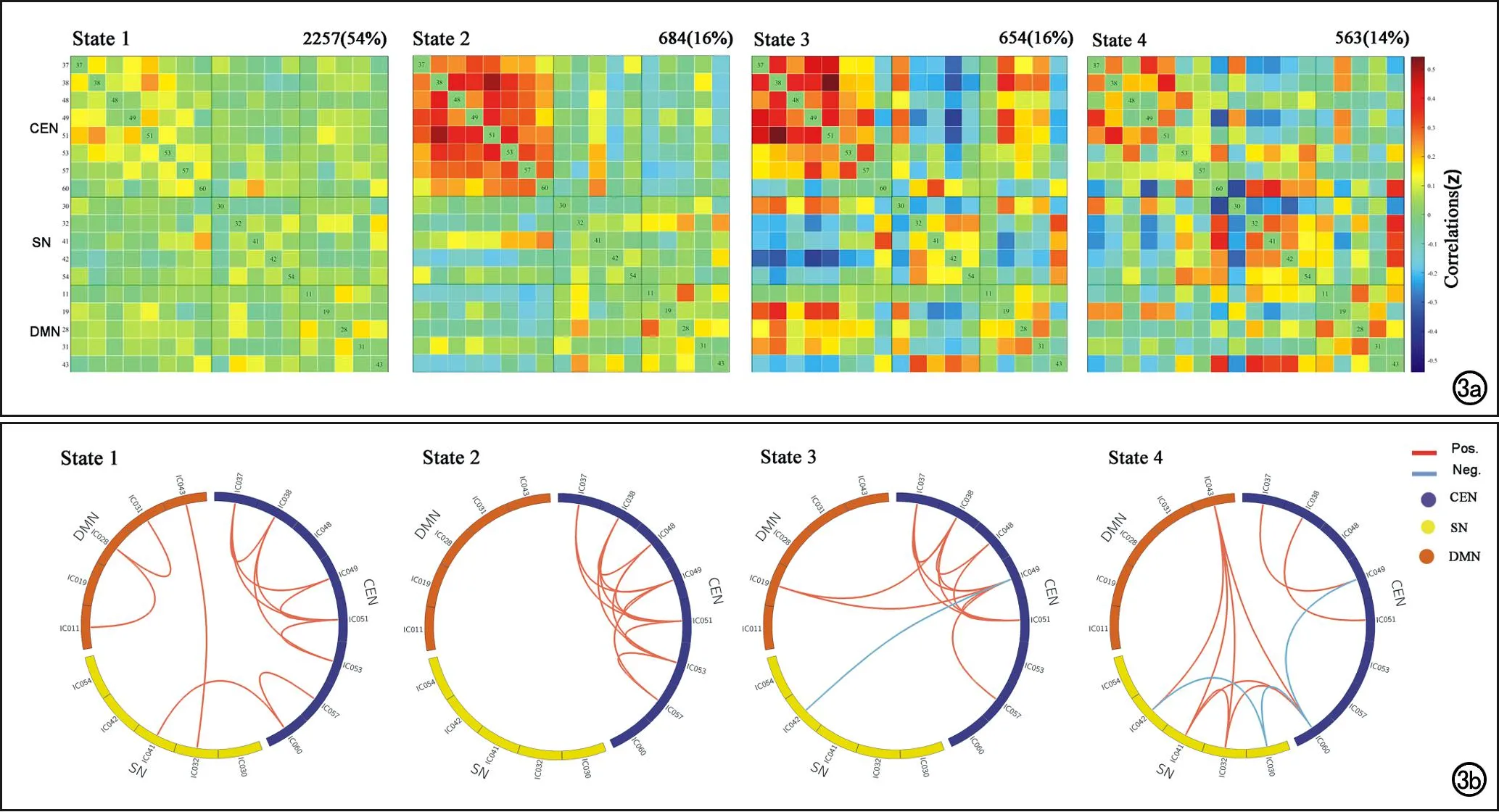
图3 所有被试的聚类分析结果。a)每种状态的聚类质心。每种矩阵最上面显示的是该状态的FC矩阵数目,以及其占所有FC矩阵总数的百分比。颜色条表示的是功能连接的Z值。State 1(54%)表示大规模脑网络功能连接较弱;State 2(16%)表示CEN网络内功能连接较强;State 3(16%)和State 4(14%)表示局部网络内或网络间功能连接较强。b)每种状态下仅显示前8%功能连接(相关系数的绝对值)。圆上每一个矩形框表示一个IC,不同的颜色表示不同的功能网络。矩形之间的连线表示ICs之间的功能连接。红线表示正功能连接,蓝线表示负功能连接。CEN,中央控制网络;SN,突显网络;DMN,默认模式网络。
为了更好地观察两组之间每一状态时dFNC的不同,我们把两组的聚类质心和功能连接强度模式分别显示出来(图4)。HC组中,状态1、2、3和4的FC矩阵比例分别为42.51%、21.17%、22.73%和13.59%,而在AD组中各状态的比例分别为68.99%、10.55%、6.98%和13.48%(图4a)。根据状态出现的数目和每个状态功能连接的特点,可以明显发现AD患者长时间处于稀疏连接模式的状态1,而在CEN内部强耦合的状态2,以及CEN内部分IC之间强连接性,并且SN-CEN之间负耦合的状态3,患者状态数目减少。图4b显示负耦合主要存在于SN与其他网络之间,正耦合主要存在于CEN内部以及CEN与其它网络之间。
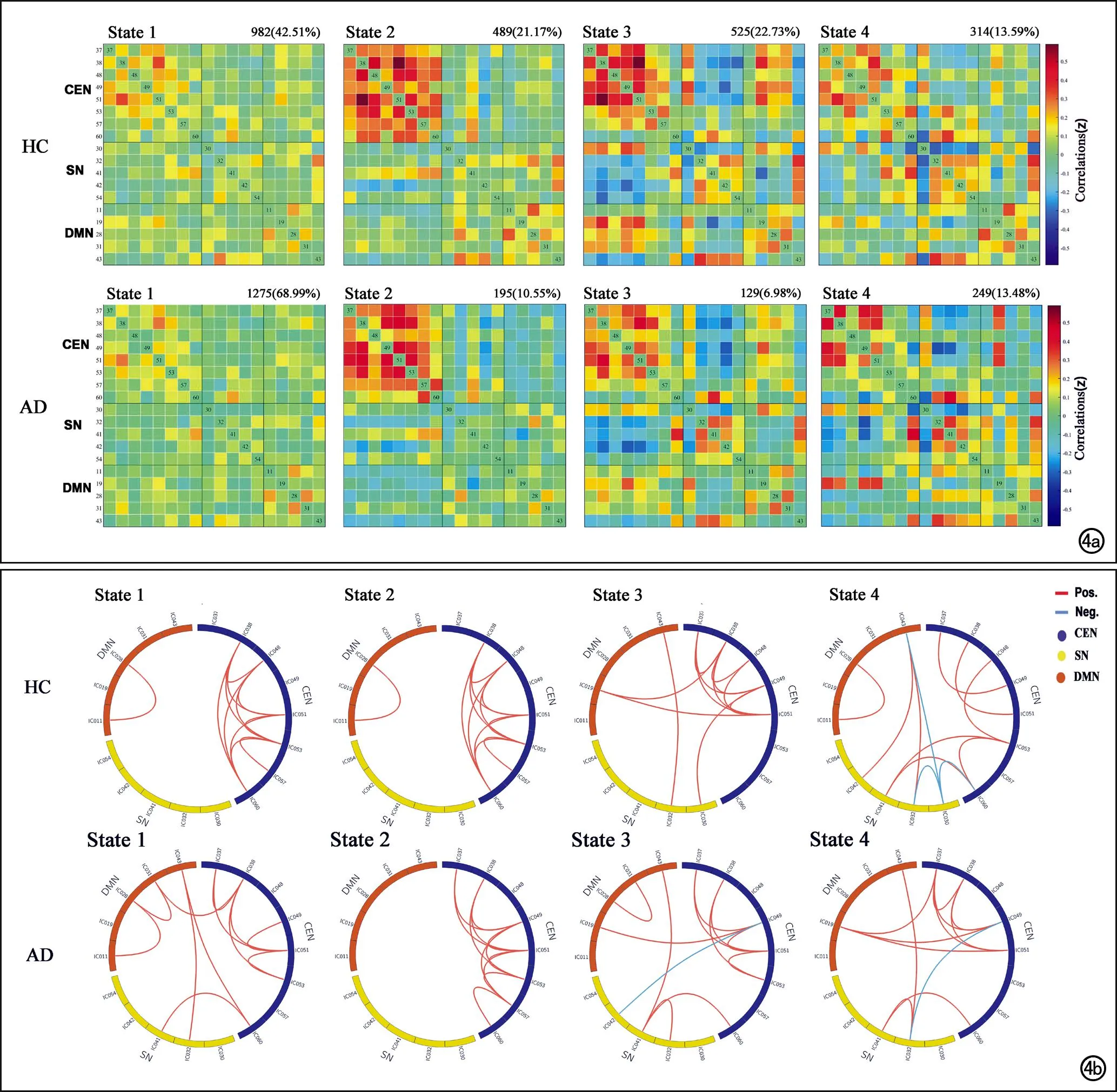
图4 两组的dFC模式。a)两组被试每个状态的聚类质心。特定组每个状态的聚类质心通过平均每组被试每个状态的FC矩阵获得; b)圈状图显示了每个状态连接强度前8%的功能连接(相关系数的绝对值)。红线表示正功能连接,蓝线表示负功能连接。CEN,中央控制网络;SN,突显网络;DMN,默认模式网络。
3.统计分析结果
虽然两组在每一个状态时表现出相似的聚类质心和连接模式,但在dFNC的时间属性方面存在一定的差异性(表3、图5):两组之间时间分数在状态1时的差异有统计学意义(P=0.02),平均停留时间在状态1和状态3时的差异均有统计学意义(P<0.05),与HC组相比,AD组在状态1时花费时间较长,在状态3时花费的时间较少;两组之间转换次数的差异无统计学意义(P=0.07)。
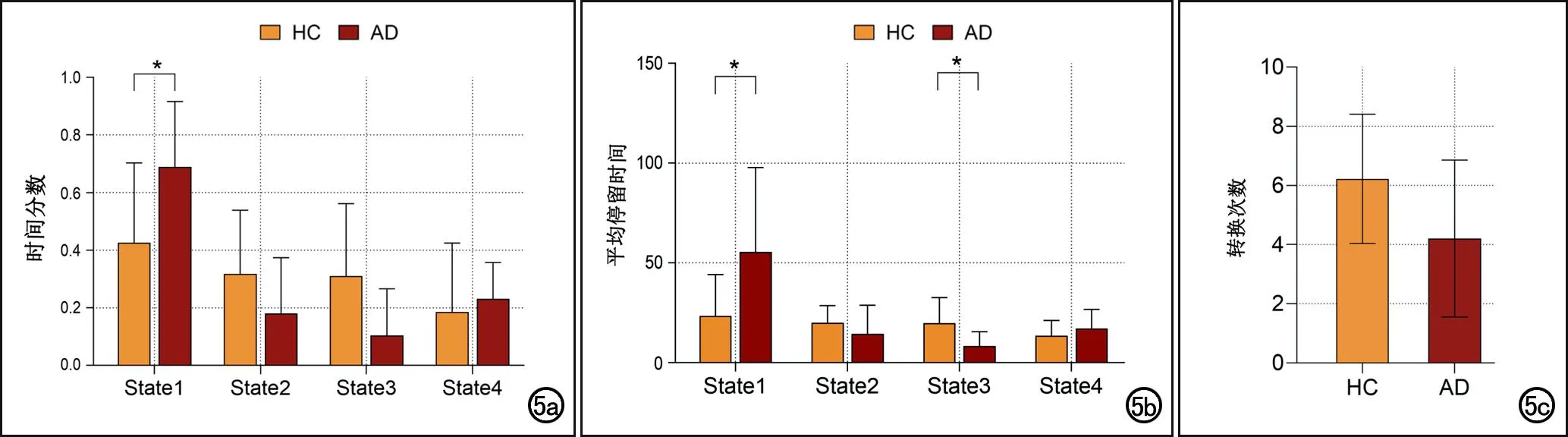
图5 两组大脑网络动态功能连接状态时间属性的分析结果。a)时间分数;b)平均停留时间;c)转换次数。* 表示组间差异有统计学意义(P<0.05)。

表3 两组之间dFNC时间属性的比较
随后我们将组间差异有统计学意义的时间属性参数(时间分数、平均停留时间)与ADS评分进行Spearman相关分析,结果显示这2项时间属性参数与ADS评分之间均无显著相关性(P>0.05)。
使用双样本t检验评估两组之间动态功能连接状态的差异,结果显示在状态4时两组之间CEN内部ICs功能连接的差异有统计学意义(P<0.001,FDR校正);与HC组相比,AD组CEN中IC38与IC49之间的功能连接显著增强(t=-5.30,P=0.0002,Plog=-3.73),如图6a所示。随后,使用BrainNet Viewer软件将存在显著差异的大脑功能连接进行可视化(图6b)。

图6 在状态4时AD组和HC组之间动态功能连接的显著性差异。a)蓝色矩形框表示功能连接强度:HC组 本研究基于ICA方法,将fMRI数据分解成不同的功能网络,通过动态功能连接分析方法研究AD患者三重网络下功能连接的变化和大脑功能连接模式。基于具有不同连接模式的四种重复出现的dFNC状态:最频繁的稀疏连接状态1,中等频繁的部分网络内强连接状态2和网络间强连接状态3,以及最不频繁的状态4,存在与AD相关的3个主要发现:①AD患者在状态1时时间分数和平均停留时间更长,该状态的特征是网络内以及网络间的连接稀疏;②患者在状态3时的平均停留时间较少,其主要特征是CEN内有局部正向连接,SN与CEN之间呈负耦合;③在状态4时AD组CEN内的功能连接增强(右侧角回与左侧背外侧额上回)。这些发现表明,dFNC状态动态特性的改变和主要表现为CEN内功能连接的变化可能在AD的病理生理学机制中至关重要。 本研究中发现,酒精依赖患者处于状态1的时间(时间分数和平均停留时间)更长,其特征是广泛稀疏的连接,虽然在CEN、DMN内存在正耦合,但连接强度较弱。作为一个任务正性网络,CEN主要包括背外侧前额叶皮层和后顶叶皮层等,该网络与决策、计划、注意力控制、工作记忆以及任务切换等高级认知功能密切相关[4,5]。既往有研究发现AD患者左侧前额叶皮质中胆碱/肌酸(Cho/Cr)明显降低,并且与患者每日饮酒量的增加显著相关,胆碱比例较低可能提示着更严重的酒精依赖[15]。另一项研究中也发现AD患者左侧中央控制网络的功能连接强度与控制失败和酒精依赖严重程度呈负相关[4]。此外,Fede等[16]提出AD患者rs-FC特征可以作为预测酒精依赖严重程度的生物标志物。因此,患者长时间处于网络内以及网络间连接强度较弱的稀疏连接状态,可能反映了患者认知功能的损伤以及更严重的酒精依赖程度。DMN锚定于后扣带皮层和腹内侧前额叶皮层,在内侧颞叶和角回有突出的节点,主要参与内部定向认知、情景记忆检索以及环境监测等,与CEN不同,该网络在静息状态时显著激活,而在执行认知任务或专注外部刺激时相对抑制[5,17,18]。之前Vergara等[19]发现患者大脑功能网络低连通性的模式,并且楔前叶、中央后回、岛叶和视觉皮层是rsFNC减少的主要区域,表明了患者内感意识降低。然而,楔前叶是DMN的重要节点,该区域异常激活被认为与渴望和视觉记忆的处理有关。因此,患者DMN较弱的连接强度,可能反映患者情景记忆提取功能的异常,从而导致患者戒断后复发[20]。 此外,与对照组相比,患者状态3的停留时间减少。状态3特点是CEN内的正连接以及主要在SN和CEN之间的负耦合。SN关键节点包括前扣带回皮层和前岛叶,参与检测、整合和过滤相关的内感、自主和情绪信息,在认知控制和情绪调节等过程中发挥重要的作用[5]。先前一项关于酒精依赖患者认知灵活性与前额叶白质纤维束之间关系的研究表明,当酒精等物质依赖损害自我功能时,患者前额叶激活增加以弥补白质完整性的降低和神经功能的损伤,这种代偿机制可能阻止问题饮酒过渡到酒精依赖[21]。患者结构的损伤,从而导致部分脑区功能异常,为了弥补脑区功能的缺陷,脑区表现出更高的激活或者脑区间具有更强的功能连接,这是一种补偿性神经能力。因此,CEN内较强的功能连通性以及SN-CEN间的高度耦合可能表明该状态与代偿机制有关联,处于强连接状态的持续时间较短可能反映了网络间功能代偿的减弱,无法抑制饮酒,可能导致AD患者强迫性饮酒。另一项研究也发现患者左侧中央控制网络与突显网络之间的网络耦合增强,进一步补偿由酒精作用导致的脑组织结构损坏而引起的功能受损,并且延迟折扣任务与网络耦合呈正相关,这表明AD患者中选择冲动可能是由于两者网络间FC的改变所致[22]。此外,冲动和强迫已被确定为成瘾性疾病的潜在内表型[23]。突显网络中关键节点的形态测量与冲动性和强迫性相关,这也提示了突显网络中心可能成为酒精成瘾者冲动控制障碍的潜在治疗目标[24]。总之,患者执行控制网络和突显网络及其相互联系在整合认知和动机过程中维持成瘾发挥着关键作用[25]。 中央控制网络异常的连通性被认为是维持酒精成瘾的一个因素。本研究结果显示酒精依赖患者在状态4时CEN内ICs的功能连接增强,这可能表示患者认知控制能力异常。为了满足对酒精相关线索更高的认知控制,从而表现出代偿机制。Jansen等[26]使用重复经颅磁刺激刺激CEN网络,结果发现酒精依赖患者左侧CEN内功能连接增强,同时左右侧CEN之间的连接性增强。Zhu等也发现了AD患者左侧CEN和DMN等网络内功能连接增强[22]。戴云蕊等[27]同样使用ICA方法,发现患者CEN内功能连接增强,其中背外侧额上回、额中回与三角部额下回和顶下缘角回等脑区功能连接较为明显。此外,有研究者使用基于种子点功能连接的分析方法发现了类似的结果。如Guo等[28]基于体素镜像同伦连接组间差异脑区为种子点(小脑后叶、额中回),研究发现患者额中回功能连接增强,即CEN连通性增强。然而,有些研究中却发现相反的结果。如Müller-Oehring等[29]将额上回当作种子点,发现AD患者CEN网络内部连通性较弱,并且较弱的网络内连通性和扩展的网络外连通性都与较差的表现和情绪相关,这可能是网络去分化的一种形式。同样为基于种子点方法的研究,却得到相反的结果,可能与种子点的选取有关,这对连接模式产生极大的影响[27]。大脑功能网络连通性增强,可能与神经可塑性有关,这也间接反映出患者大脑功能异常和认知损伤[26]。 除了上述的研究发现,本研究也存在一定的局限性:被试样本量较少;仅采用了22倍TR的滑动时间窗;未对脑功能网络之间的图论指标进行检验等。因此在未来需要招募更多的被试进行更进一步的研究来验证我们的发现,并选用不同窗口长度来更好地观察大脑网络之间的动态变化,并对所有被试的窗口矩阵进行图论分析,以进一步研究AD患者网络拓扑属性。讨 论
