促红细胞生成素对正畸牙复发大鼠牙周组织改建及Wnt/β-catenin信号通路的影响
2024-02-23贾慧,康凯,杨磊
贾 慧,康 凯,杨 磊
(邯郸市口腔医院,河北 邯郸 056001)
牙齿畸形可由多种因素引起,其发病原因除了先天的遗传因素影响之外,后天的环境因素同样发挥重要作用[1]。畸形牙齿不仅会影响患者正常的生活能力,也会对面部的形象造成影响[2]。正畸牙往往是通过机械手段改变畸形牙的位置,通过骨改建改善牙周组织进行治疗,但往往因为畸形早已形成的内在作用导致牙齿复位[3]。因此,在通过机械矫正牙齿畸形的同时,利用具有针对性的治疗药物避免牙齿位置移动并缓解正畸牙复发,成为当下研究的重中之重[4]。畸形牙的复发受多种影响因子的调控,其中,Wnt/β-连环蛋白(β-catenin)信号通路被证实在牙槽骨的形成和牙周组织的恢复过程中发挥重要作用[5]。Wnt蛋白家族可调节内源性骨量,同时促进β-catenin的释放,导致β-catenin在细胞内大量积累,Wnt和β-catenin的进一步结合,可以促进成骨分化,改善骨量[6-7]。促红细胞生成素作为一种激素样物质,可以显著促进红细胞生成,被认为是治疗贫血等症状的药物[8]。近年来有研究[9]证实,促红细胞生成素可以促进人类牙髓细胞的增殖,参与调节牙齿的骨质分化,促进牙槽骨的形成,但其作用机制尚未明确。促红细胞生成素还可参与调控Wnt/β-catenin信号通路,促进牙周膜干细胞的进一步分化,加速骨质形成[10];推测其可能在正畸牙复发过程中通过调控Wnt/β-catenin信号通路,对牙周组织改建产生影响,但需要进一步验证。故本研究通过构建大鼠正畸牙复发模型,探究相关机制,讨论促红细胞生成素作为药物参与治疗正畸牙复发的可能性。
1 材料与方法
1.1 实验材料
1.1.1 实验动物:从杭州启真实验动物科技公司购进10周龄的雄性SD大鼠(SPF级,体重343~362 g),生产许可证号SCXK(浙)2022-0005,饲养于温度24~28 ℃,湿度55%~62%,12 h光照昼夜交替的环境中,自由饮水进食。本研究经邯郸市口腔医院伦理委员会批准。
1.1.2 主要药物与试剂及仪器:促红细胞生成素(批号LK29422)购自上海高创化学科技公司;Wnt/β-catenin抑制剂(KYA1797K)(批号MJ1903)购自武汉科斯坦生物公司;苏木素-伊红(HE)染色试剂盒(批号LD49144)、通用免疫组化检测试剂盒(批号LD29922)、Trizol试剂(批号LD17952)、蛋白裂解液(批号LD52191)、BCA试剂盒(批号LD49192)、鼠源骨形态发生蛋白(BMP)2(批号XY28494)、BMP4(批号XY49957)一抗、羊抗鼠二抗(批号XY28550)均购自山东绿都生物技术公司;反转录试剂盒(批号LK48292)、PCR试剂盒(批号LK45892)、兔源Wnt(批号XY41164)、β-catenin(批号XY38118)一抗、羊抗兔二抗(批号XY42925)均购自南京龙葵生物科技公司;显微镜(型号IXplore Standard)、荧光定量PCR仪(型号Prism 7000)、蛋白成像仪(型号LF-G500)均购自北京龙方科技公司。
1.2 实验方法
1.2.1 大鼠正畸牙移动模型建立及分组给药:参照文献[11]构建大鼠正畸牙移动模型,麻醉大鼠,仰卧位固定,于大鼠上颌左侧第一磨牙加装加力装置,施加50 g近中拉力,弹簧拉力器校准作用力大小,持续加力20 d,期间各组大鼠饮食正常,观察并防止加力装置脱落,建立大鼠正畸牙移动模型。20 d后,将48只正畸牙模型大鼠随机分为模型组、促红细胞生成素低(250 IU/kg)、高(500 IU/kg)剂量组[12]、促红细胞生成素(500 IU/kg)+KYA1797K(25 mg/kg)组[13],每组12只,分组后拆除各组大鼠加力装置,进行麻醉,制备印模,测量第一磨牙和第二磨牙之间远中沟间的距离,记为A0。另取12只健康大鼠作为对照组(不进行任何处理)。促红细胞生成素低、高剂量组大鼠腹腔注射250、500 IU/kg的促红细胞生成素[12];促红细胞生成素+KYA1797K组大鼠腹腔注射500 IU/kg的促红细胞生成素和25 mg/kg的KYA1797K[13];对照组、模型组大鼠腹腔注射等体积0.9%氯化钠溶液。各组注射每天1次,连续30 d。
1.2.2 正畸牙复发情况检测:分别于取下加力装置第10、20、30 天麻醉大鼠,制备印模后石膏灌注,对石膏模型进行标记分组,利用3D扫描仪对模型进行扫描,测量第一磨牙和第二磨牙之间远中沟间的距离,分别记作A10、A20、A30。计算复发距离得出复发率,作为评定大鼠复发情况的判断依据,计算公式如下:复发率=(A0-An)/A0×100%;An分别为A10、A20、A30。
1.2.3 牙周组织病理学变化观察:末次腹腔注射给药24 h后,麻醉大鼠,仰卧位固定于操作台上,手术刀剖开牙齿周围表面皮肤,切取上颌左侧第一磨牙及其周围的牙周组织,取部分牙周组织液氮处理研磨至粉冻存备用;另一部分牙周组织置于4%多聚甲醛中固定24 h,加入EDTA脱钙剂进行脱钙处理,常规脱水包埋制成石蜡切片。选取部分切片,按照HE染色试剂盒说明书方法染色,上镜观察染色结果。
1.2.4 免疫组化检测牙周组织BMP2、BMP4表达水平:随机选出每只大鼠5张切片,滴加3% H2O2处理10 min,蒸馏水反复清洗3次,滴加0.1%膜蛋白酶37 ℃预热处理20 min,修复抗原,切片上滴加山羊血清,室温孵育30 min,滴加鼠源一抗(BMP2、BMP4,稀释比均为1∶680),4 ℃孵育过夜,PBS缓冲液反复清洗3次。滴加羊抗鼠二抗(稀释比为1∶1800),37 ℃孵育45 min。以通用免疫组化检测试剂盒进行免疫组织化学染色,置于显微镜下观察染色结果,每张切片选取5个视野,利用软件(Image Pro Plus 6.0)计算BMP2、BMP4表达(平均光密度值),平均光密度值越大代表表达越强。
1.2.5 牙周组织Wnt、β-catenin mRNA表达水平检测:取出部分冻存备用的牙周组织粉末,Trizol试剂提取其总RNA,反转录为cDNA。荧光定量PCR法检测牙周组织Wnt、β-catenin mRNA水平(以GAPDH为内参),引物由广州展晨生物科技公司设计、合成。反应体系共30 μl:cDNA 2 μl、缓冲液5 μl、dNTPs 4 μl、正反向引物各1 μl、DNA聚合酶1 μl、ddH2O 16 μl。扩增条件:94 ℃持续9 min,94 ℃持续17 s,62 ℃持续23 s,72 ℃持续31 s,共40个循环,被测mRNA水平使用相对基因定量方法(2-ΔΔCt法)计算。引物序列见表1。

表1 引物序列
1.2.6 牙周组织Wnt、β-catenin蛋白表达水平检测:取剩余冻存的牙周组织粉末,加入1 ml裂解液充分振荡,确保蛋白裂解充分,BCA蛋白检测试剂盒定量蛋白浓度,定量后加热变性,电泳分离后转膜,脱脂牛奶封闭2 h,加入兔源一抗Wnt(1∶1120)、β-catenin(1∶1270)、GAPDH(1∶1350),常温孵育12 h,洗涤,再将膜与稀释比为1∶2400的羊抗兔二抗室温下孵育2 h,洗涤后,ECL试剂显色,Image J软件分析蛋白条带灰度值,计算目标蛋白表达水平。
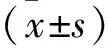
2 结 果
2.1 各组大鼠正畸牙复发率比较 与对照组相比,模型组大鼠各时间段正畸牙复发率显著升高(均P<0.05);与模型组相比,促红细胞生成素低、高剂量组大鼠各时间段正畸牙复发率依次降低(均P<0.05);与促红细胞生成素高剂量组相比,促红细胞生成素+KYA1797K组大鼠各时间段正畸牙复发率显著升高(均P<0.05)。见表2。

表2 各组大鼠正畸牙复发率比较(%)
2.2 各组大鼠牙周组织病理变化 对照组大鼠牙周组织中纤维排列紧密,细胞整齐分布;模型组牙周组织中纤维分散,细胞间排列间隙大,牙槽骨表面有少量成骨细胞排列,没有明显的细胞牙骨质;促红细胞生成素低、高剂量组大鼠牙周组织中纤维分布逐渐密集,成骨细胞和细胞牙骨质逐渐增多;促红细胞生成素+KYA1797K组较促红细胞生成素高剂量组大鼠牙周组织纤维分布分散,存在大量细胞间隙,成骨细胞和细胞牙骨质减少。见图1。

A:对照组;B:模型组;C:促红细胞生成素低剂量组;D:促红细胞生成素高剂量组;E:促红细胞生成素+KYA1797K组
2.3 各组大鼠牙周组织BMP2、BMP4表达水平比较 与对照组相比,模型组大鼠牙周组织BMP2、BMP4表达显著升高(均P<0.05);与模型组相比,促红细胞生成素低、高剂量组大鼠牙周组织BMP2、BMP4表达依次升高(均P<0.05);与促红细胞生成素高剂量组相比,促红细胞生成素+KYA1797K组大鼠牙周组织BMP2、BMP4表达显著降低(均P<0.05)。见表3。

表3 各组大鼠牙周组织BMP2、BMP4表达水平比较
2.4 各组大鼠牙周组织Wnt、β-catenin mRNA表达水平比较 与对照组相比,模型组大鼠牙周组织Wnt、β-catenin mRNA表达水平显著升高(均P<0.05);与模型组相比,促红细胞生成素低、高剂量组大鼠牙周组织Wnt、β-catenin mRNA水平依次升高(均P<0.05);与促红细胞生成素高剂量组相比,促红细胞生成素+KYA1797K组大鼠牙周组织Wnt、β-catenin mRNA水平显著降低(均P<0.05)。见表4。

表4 各组大鼠牙周组织Wnt、β-catenin mRNA表达水平比较
2.5 各组大鼠牙周组织Wnt、β-catenin蛋白表达水平比较 与对照组相比,模型组大鼠牙周组织Wnt、β-catenin蛋白水平显著升高(均P<0.05);与模型组相比,促红细胞生成素低、高剂量组大鼠牙周组织Wnt、β-catenin蛋白水平依次升高(均P<0.05);与促红细胞生成素高剂量组相比,促红细胞生成素+KYA1797K组大鼠牙周组织Wnt、β-catenin蛋白水平显著降低(均P<0.05)。见表5。

表5 各组大鼠牙周组织Wnt、β-catenin蛋白表达水平比较
3 讨 论
牙齿畸形发病概率较高,对多数患者造成严重困扰,往往通过机械治疗即可矫正畸形牙齿,但复发概率高,严重时造成病情反复,对患者形象产生巨大影响,因此通过药物治疗缓解病情复发成为研究的热点[14-15]。常规染色和检测正畸牙复发率是判断正畸牙复发程度的重要指标[16]。本研究通过构建正畸牙复发大鼠模型,发现模型组大鼠各时间段正畸牙复发率较高,牙周组织中纤维分散,有少量成骨细胞生成,没有明显的细胞牙骨质。表明大鼠正畸牙复发的程度明显,骨质生成缓慢,具有典型的正畸牙复发症状。
促红细胞生成素具有促进红细胞生长的作用,近年来已被证实参与调控牙齿生长,高剂量的促红细胞生成素作用可促进牙髓细胞的生长,促进牙齿固定[17]。促红细胞生成素也可加速牙槽骨的骨质分化,促进牙齿定型,防止牙齿错位[18]。因而推测促红细胞生成素可作用于正畸牙,快速固定牙齿,防止牙齿复位。本研究发现使用不同剂量促红细胞生成素作用于正畸牙复发大鼠后,结果显示大鼠各时间段正畸牙复发率显著降低,牙周组织中纤维分布逐渐密集,成骨细胞和细胞牙骨质逐渐增多,且促红细胞生成素剂量越高效果越好;表明促红细胞生成素可快速形成骨质成分,抑制正畸牙复发,但具体的作用机制有待探索。BMP蛋白家族可参与诱导骨髓细胞分化为成骨细胞,其中BMP2、BMP4蛋白是骨质形成中的关键蛋白[19-20]。BMP2、BMP4的高表达可促进骨质的快速形成,被认为是骨改建能力判定的重要标志[21-22]。本研究发现,模型组大鼠牙周组织BMP2、BMP4表达较对照组显著升高,不同剂量促红细胞生成素干预后,牙周组织BMP2、BMP4表达进一步升高,且促红细胞生成素剂量越高效果越明显;表明促红细胞生成素可促进BMP2、BMP4蛋白表达,进一步促进骨质生成和骨化,加速牙齿固定,缓解正畸牙复发。
有研究指出Wnt/β-catenin信号通路在牙槽骨形成过程中发挥重要作用,Wnt/β-catenin信号通路参与牙周膜干细胞的分化,促进成骨组织快速生成[23-24]。Wnt、β-catenin的高表达可参与影响牙本质的形成和再生,进一步促进牙根发育[25]。本研究发现,模型组大鼠牙周组织Wnt、β-catenin mRNA和蛋白水平较对照组显著升高;不同剂量促红细胞生成素干预后,大鼠牙周组织Wnt、β-catenin mRNA和蛋白水平进一步升高,且促红细胞生成素剂量越高Wnt、β-catenin mRNA和蛋白水平升高效果越好;表明促红细胞生成素可能通过调控Wnt/β-catenin信号通路发挥促进牙周组织改建,减缓大鼠正畸牙复发的作用。为进一步验证,本研究在高剂量促红细胞生成素的基础上使用Wnt/β-catenin抑制剂KYA1797K进行干预,发现KYA1797K能部分逆转高剂量促红细胞生成素对大鼠正畸牙复发的改善效果;进一步证实促红细胞生成素通过激活Wnt/β-catenin信号通路抑制大鼠正畸牙复发。
综上所述,促红细胞生成素可能通过激活Wnt/β-catenin信号通路,加速骨质生成,促进牙周组织改建,减缓大鼠正畸牙复发。但促红细胞生成素是否通过其他通路间接参与调控,还需要进一步的实验加以说明。
