基于核苷酸序列的罗非鱼罗湖病毒分子流行病学分析
2024-01-15刘助红张璜唐玲刘贤旭林洁文吴林
刘助红 张璜 唐玲 刘贤旭 林洁文 吴林






摘 要:通过对NCBI数据库里的罗湖病毒(tilapia lake virus,TiLV)核苷酸序列进行生物信息学分析,了解罗湖病毒在全球的流行情况和中国罗非鱼(tilapia)养殖中罗湖病毒的感染情况。该研究将第3个片段的序列比对结果中的罗湖病毒分成12个簇群,通过对片段进行motif序列富集,显示motif序列每个位点的碱基。对从广东各地区罗非鱼养殖场采集到的302份样本进行检测,结果显示,均未检测出罗湖病毒阳性,并且显示motif序列位点的碱基非常稳定。通过对罗湖病毒进行分子流行病学分析,中国虽未有罗湖病毒流行的趋势,但在进出口贸易中仍要严格防控罗湖病毒的输入,并应对这些非常保守的motif的相关功能进行深入研究。
关键词:罗非鱼(tilapia);罗湖病毒(tilapia lake virus,TiLV);分子流行病学
中图分类号:S965.125文献标志码:A
罗非鱼(tilapia)因价格实惠、富含蛋白质、抗病能力强和耐高密度养殖而成为世界上主要养殖鱼类[1-2]。中国是世界上最大的罗非鱼养殖国,已先后从国外引入多个罗非鱼品种,年产量超过160万t,罗非鱼的养殖一般是采用土塘等养殖模式,伴随着高密度和不可控的养殖条件,导致罗非鱼养殖过程中各种疾病不断出现[3-4]。近年来,罗湖病毒(tilapia lake virus,TiLV)的出现给罗非鱼的养殖造成了极大的威胁[5]。早在2009年,以色列就报道了养殖罗非鱼的大量死亡的现象,随后在厄瓜多尔、埃及、马来西亚、哥伦比亚、泰国、印度等国家以及中国台湾地区相继发现有TiLV感染的情况[6-12]。但直到2014年,罗湖病毒才被正式鉴定新的罗湖病毒科[13]。罗湖病毒目前基本形成了以菲律宾、印度、泰国及以色列等4个国家为中心的流行圈,调查显示中国的罗湖病毒显示来自厄瓜多尔。同时,不同地区的序列间碱基存在一定的突变,但从氨基酸水平来看,绝大部分的突变是无益突变。罗湖病毒为单链RNA病毒,其基因组含有10个片段,除了第1片段跟其他病毒有弱同源性外,其他9个均找不到同源序列[2]。据报道,它可以感染所有生长阶段的罗非鱼[14]。2017年5月,世界动物卫生组织(OIE)、亚太地区水产养殖中心网(NACA)、联合国粮农组织(FAO)等国际组织均针对TiLV发布公告或预警,要求所有成员国在罗非鱼的养殖和进出口过程中加强检疫和防范[15-16]。目前,关于罗湖病毒的来源和传播途径还没有一个确切的结论,Dominique等人分析了2017年导致孟加拉国罗湖鱼大量死亡的罗湖病毒疑似来源于与泰国罗非鱼孵化场频繁的进出口贸易[17]。文章通过对全球已有罗湖病毒的保守核苷酸序列进行系统发育树的分析和对广东省罗非鱼养殖相关养殖场的罗非病毒样本进行分子检测,从分子水平分析罗湖病毒在全球范围的流行和进化情况,为罗湖病毒在中国的防控提供一定的依据。
1 材料与方法
1.1 试验材料
根据前期序列分析,选取罗湖病毒的保守序列第3个片段序列(GenBank:KJ605629)进行生物学信息分析,从GenBank数据库中下载与第3个片段序列的相关序列共93条。具体序列的相关信息见表1。另外,从广东省各地区罗非鱼养殖场采集了302份相关的样本用于感染情况分析,具体的样本信息见表2。
1.2 试验方法
用生物信息学软件DNASTAR对上述序列及其编码的蛋白质进行同源性比较和分析,采用MEGA 4.0进行遗传进化树绘制、碱基和氨基酸残基突变位点统计,对序列进行选择压力和保守位点的分析。另外,采用“SC/T 7024-2021 罗非鱼湖病毒病监测技术规范”推荐的检测步骤对采集的样本进行处理和实时荧光RT-PCR检测,以便具体分析罗湖病毒在广东省的实际感染情况。
2 结果与分析
2.1 罗湖病毒的分布情况
根据数据库比对,发现第三个核酸片段在数据库中没有任何同源序列,该序列编码的蛋白功能目前还未了解清楚,序列统计结果如表1所示。由于罗湖病毒最早发生在以色列,对其研究也较多,故从该国分离鉴定上传的序列是最多的,达到了近30%,其次为印度和泰国。泰国自发现以来,每年都有罗湖病毒被从不同地区分离鉴定。随着罗湖病毒的流行,数据库显示全球总共有14个国家先后发现了罗湖病毒的存在,并且病毒的分布呈现区域化的趋势,尤其是在东南亚区域(图1)。中国虽然罗非鱼养殖面积大,但目前还没有发现该病大规模的流行,深圳海关和厦门海关在中国进出口的罗非鱼及相关产品中均未检出罗湖病毒。
2.2 系统进化分析
2.2.1 系统发育树分析
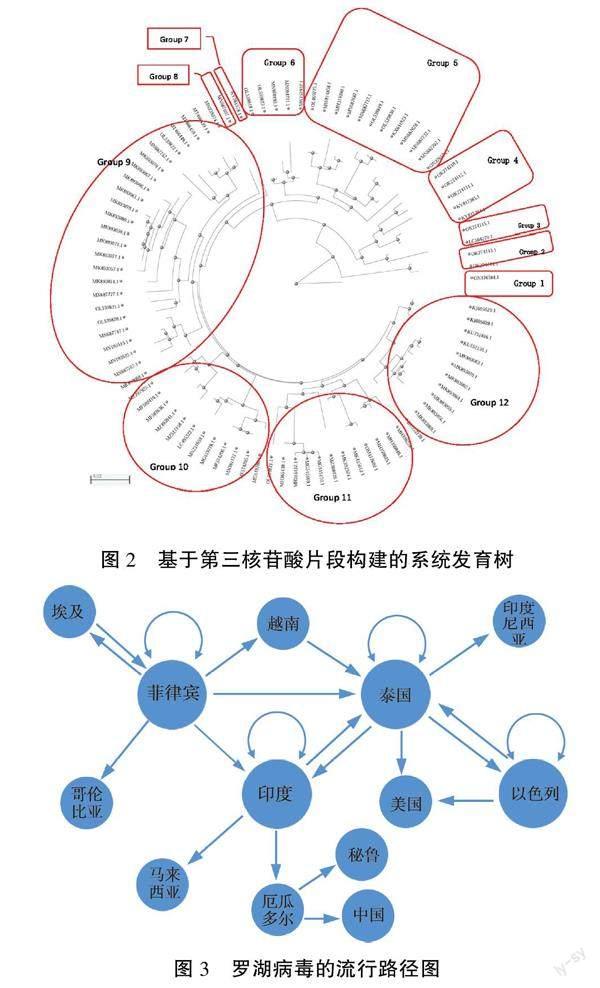
基于罗湖病毒的第3个核苷酸片段序列采用最小快速进化法构建系统发育树得到图2所示的结果,发现可以将已鉴定的毒株归类为12个簇群:(1)2018年从越南分离到的罗湖病毒株ON376584(2018)为单独进化的毒株(Group 1),该毒株与其他毒株亲缘关系较远。泰国鉴定的KY381578(2016)及MN687697(2014)虽然与其他毒株有共同的进化祖先,但在后期的演化中也分别单独进化成了一个簇群(Group 7和8)。(2)2019年从菲律宾发现的两个LC504279(2019)OK274115(2019)成为一个簇群(Group 2)。(3)2019年从菲律宾分离的另外两个毒株OK274114(2019)、OK274113(2019)自成一个簇群(Group 3)。(4)菲律宾剩下的3个毒株OK274111(2018)、OK274112(2019)、OK274110(2020)与埃及的2个KY817384(2015)、KY817385(2015)成为一个簇群(Group 4)。(5)泰国不同年份分离的11个毒株与越南2020年鉴定的毒株ON376574(2020)成为一个簇群(Group 5)。(6)哥伦比亚唯一毒株OL539823(2018)、印度的MK752932(2019)、MN094791(2019)、马来西亚MN970195(2019)和泰国的OL539818(2018)成为一个簇群(Group 6)。(7)以色列2018年鉴定的毒株与印度尼西亚、泰国、孟加拉国及美国鉴定的共25个毒株成为一个簇群(Group 9)。(8)印度鉴定的12个毒株成为一个簇群(Group 10)。(9)中国、厄瓜多尔、印度、以色列、马来西亚、秘鲁等组成一个簇群(Group 11)。(10)泰国鉴定的其他12个毒株成为一个簇群(Group 12)。从分布的國家来看,印度和泰国的毒株型是最多的,都达到3种。这两个国家也是罗湖病毒疾病大量流行的国家。以色列虽然也是大面积爆发罗湖病毒疾病的国家,但毒株比较单一,病毒变异较小。从每个簇群所分布的国家来看,第11个簇群的罗湖病毒类型分布最为广泛,在全球六个国家均有涉及,其次是第6个簇群,分别分布在全球四个国家。在进化程度上,中国的毒株与厄瓜多尔和秘鲁等国家的毒株有较近的亲缘关系,系统发育树显示中国的毒株是从厄瓜多尔的毒株进化而来,这与中国在水产行业上与这些国家有较多的贸易关系是分不开的。另外,要特别留意的是越南新出现的毒株,它与以往的毒株在进化上没有相互关系,极有可能是通过病毒重组或变异形成的新的毒株,目前,关于它的毒力和传染性等情况都没有太多的研究。
2.2.2 罗湖病毒在全球的流行分析
从系统发育树来看,罗湖病毒虽然最早在以色列被报道,但从分子进化水平上来看,它不是最早出现的。罗湖病毒最开始起源于菲律宾,因此,以发育树的结点作为地理位置的代表国家,可绘制如下罗湖病毒在全球的传播路径图(图3)。传播网络显示,罗湖病毒目前基本形成了以菲律宾、印度、泰国及以色列等4个国家为中心的流行圈,从这些国家向外围扩散,中国发现的罗湖病毒显示来自厄瓜多尔。
2.2.3 碱基突变分析
对该序列中所有的碱基突变进行统计,结果如
图4所示,A、C、G、T四种碱基的突变率为31%、40%、29%、32%。在所有的突变中,大部分为C与T之间的突变,其次为G与C之间的突变。碱基的突变往往带来的是蛋白质氨基酸的改变,从而改变蛋白质的结构,进而改变病毒的致病力或者传播能力。
2.3 氨基酸序列分析
罗湖病毒的第三个片段编码的蛋白质在病毒增殖的过程中发挥的作用目前尚不清楚,该片段共编码420个氨基酸,通过对从各地分离毒株的该片段编码的氨基酸序列进行比较,发现各国毒株的该氨基酸序列非常保守(图5),相似性最低也达96.9%,这可能与该蛋白自身的功能有非常重要的关系。因此,从氨基酸水平分析已有毒株的进化程度是分不开的。
2.4 基因序列的保守位点分析
应用在线软件https://meme-suite.org/meme/doc/meme.html對该基因片段的motif序列进行查找富集,获得如下结果(图6),在找到的5个motif序列中,每个位点的碱基基本上都是非常稳定的。然而,关于这些motif序列的功能在数据库中尚未发现。
2.5 罗湖病毒检测结果
通过对广东各地区采集的302份罗湖病毒样本进行检测,发现罗湖病毒的检测结果均为阴性,进一步说明罗湖病毒在中国尚未造成大面积的流行,与前期的分子流行病学分析结果是一致的,这与中国出入境管理部门在进出口中的对罗湖病毒的严格管理和检疫是分不开的。
3 讨论
根据全球已有的罗湖病毒的报道,目前罗湖病毒主要在印度、泰国、以色列等国家流行,病毒的流行往往具有区域性,同时会随着进出口贸易等在不同国家之间流行,罗湖病毒从2009年发现至今,已经过了十余年的进化和重组,每个地区的病毒株已经呈现出明显的分子水平差异,重组往往会产生新的毒株。罗湖病毒虽然不会对人类的健康造成威胁,但是所造成的罗非鱼的死亡严重影响了人类的食品安全和健康。对于水产动物类的大部分病毒,都没有合适的药物可以治疗,因此,如何预防成为控制罗湖病毒肆意传播的关键。
Chaput等人分析了罗湖病毒BD-2017毒株的10个片段的保守性,发现片段8、9、10是变异最小的,但是这三个片段的长度均在500bp以下,不利于系统进化树的构建和流行性分析[17]。在Chaput关于罗湖病毒的分析中,作者只分析了孟加拉国、泰国、秘鲁、厄瓜多尔及以色列7个毒株的亲缘关系,通过系统进化树分析得知孟加拉国的毒株可能来自泰国,南美洲的毒株和以色列的成为一个簇群,作者推测是由于孟加拉国在2012至2017年期间频繁从泰国的孵化场进口鱼苗导致的,这与文章分析的结果也是一致的。但是,文章采取全球广泛使用的罗湖病毒第3个片段进行分析,在数据库里关于罗湖病毒的信息也是最全面的,分别对全球14个国家或地区的93个罗湖病毒进行分析,这对于从全球水平分析罗湖病毒的流行情况更加准确和具有代表性。
对于功能性分析来说,氨基酸序列的比对比核苷酸的序列比对更加可靠,因为某个氨基酸的改变或替换对蛋白质的结构和功能有着重要的影响,但是,罗湖病毒的第三个片段的氨基酸序列比对却显示,氨基酸的序列非常保守,说明大部分的碱基突变是无义突变。无义突变增加表明生物选择压力增大,但是突变本身并不会改变翻译蛋白质的氨基酸序列。非同义突变则表明蛋白质氨基酸序列会发生改变,病毒可能获得新的抗原特征从而造成暴发流行。通过数据库比对,该氨基酸序列未发现与其他病毒的氨基酸序列有相似性,因此,关于该蛋白的功能需要进一步的研究。
目前,针对罗湖病毒的不同核苷酸片段已经建立了PCR、LAMP等很多方法,为罗湖病毒的鉴定奠定了技术基础,中国也针对罗湖病毒建立了分子生物学检测方法[18-20]。尽管通过某个单一的保守核苷酸片段对罗湖病毒开展分子流行病学分析,并以此推断其起源及地理流行传播情况不一定十分准确,但大范围的分子流行病学分析仍能为病毒的预防控制提供了很好的依据。
参考文献:
[1]包特力根白乙.中国罗非鱼养殖产业发展及市场前景[J].中国水产,2014(9):20-22.
[2]郭建红,蔡颖,吴松浩.罗湖病毒研究进展[J].中国动物检疫,2017,34(8):72-75.
[3]佚名.《2019中国渔业统计年鉴》[J].世界农业,2020(3):2.
[4]陈中元,王荣华,刘志昕,等.罗非鱼罗湖病毒ORF10蛋白的亚细胞定位及组织表达分析[J].中国水产科学,2021,28(7):896-902.
[5]Mushtaq Z, Qayoom U, Mir I N, et al. tilapia lake virus: An emerging viral disease of tilapia industry[J]. Journal of Entomology and Zoology Studies, 2018, 6(5):141-144.
[6]BACHARACH E,MISHRA N,BRIESE T,et al.Characterization of a novel orthomyxo-like virus causing mass die-offs of tilapia[J].MBio,2016,7(2):00431-16.
[7]NICHOLSON P,FATHI MA,FISCHER A,et al.Detection of tilapia lake virus in egyptian fish farms experiencing high mortalities in 2015.[J].J Fish Dis,2017,40(12):1925-1928.
[8]AMAL MNA,KOH CB,NURLIYANA M,et al.A case of natural co-infection of tilapia lake virus and aeromonas veronii in a malaysian red hybrid tilapia(Oreochromis Niloticus)[J].Aquaculture,2018,485:12-16.
[9]DONG HT,SIRIROOB S,MEEMETTA W,et al.Emergence of tilapia lake virus in thailand and an alternative semi-nested rt-pcr for detection[J].Aquaculture,2017,476:111-118.
[10]BEHERA BK,PRADHAN PK,SWAMINATHAN TR,et al.Emergence of tilapia lake virus associated with mortalities of farmed nile tilapia Oreochromis Niloticus(linnaeus 1758) in india[J].Aquaculture,2018,484:168-174.
[11]Contreras Héctor,Vallejo Adriana,Mattar Salim,et al.First report of tilapia lake virus emergence in fish farms in the department of córdoba, colombia.[J].Vet World,2021,14(4):865-872.
[12]雷燕,趙振峰,唐绍林,等.国内养殖罗非鱼首次检出罗湖病毒[J].海洋与渔业·水产前沿, 2017(7):72.
[13]Eyngor Marina,Zamostiano Rachel,Kembou Tsofack Japhette Esther,et al.Identification of a novel rna virus lethal to tilapia.[J].J Clin Microbiol,2014,52(12):4137-4146.
[14]DONG HT,ATAGUBA GA,KHUNRAE P,et al.Evidence of tilv infection in tilapia hatcheries from 2012 to 2017 reveals probable global spread of the disease[J].Aquaculture,2017,479:579-583.
[15]OIE. Technical disease cards: tilapia lake virus(TiLV)-A novel Orthomyxo-like virus. 2020.
[16]郑晓聪,黄倩君,朱崧琪,等.罗非鱼湖病毒病传入风险分析[J].中国动物检疫,2020,37(10):27-31.
[17]Dominique L. Chaput,David Bass,Md. Mehedi Alam,et al.The segment matters: probable reassortment of tilapia lake virus(tilv) complicates phylogenetic analysis and inference of geographical origin of new isolate from bangladesh[J].Viruses,2020,12(3):258.
[18]TATTIYAPONG P,SIRIKANCHANA K,SURACHETPONG W.Development and validation of a reverse transcription quantitative polymerase chain reaction for tilapia lake virus detection in clinical samples and experimentally challenged fish.[J].J Fish Dis,2018,41(2):255-261.
[19]KEMBOU T J E,ZAMOSTIANO R,WATTED S,et al.Detection of tilapia lake virus in clinical samples by culturing and nested reverse transcription-pcr.[J].J Clin Microbiol,2017,55(3):759-767.
[20]徐淑菲,林双庆,陈信忠,等.罗湖病毒RT-LAMP方法的建立与应用[J].中国动物检疫,2021,38(12):99-103+108.
Molecular epidemiological analysis of tilapia lake virus based on nucleotide sequence
LIU Zhuhong1, ZHANG Huang2, TANG Ling1, LIU Xianxu1, LIN Jiewen1, WU Lin1
(1.Guangdong Polytechnic of Science and Trade, Guangzhou 510430, Guangdong China; 2.Guangzhou Double Helix Gene Technology Co., Ltd., Guangzhou 510430, Guangdong China)
Abstract:In this paper, the nucleotide sequence of tilapia lake virus(TiLV) in NCBI database was analyzed by bioinformatics to understand the global epidemic of tilapia lake virus and the infection status in tilapia aquaculture in China. According to the sequence of the third segment alignment results, tilapia lake virus searched so far in NCBI database could be divided into 12 groups. The tilapia lake virus had basically formed an epidemic circle centered around four countries, including the Philippines, India, Thailand, and Israel, while the tilapia lake virus in China shows that it comes from Ecuador. There were some base mutations between sequences in different regions of the third segment, but from the amino acid level, most of the mutations were non-sense mutations. Through motif sequence enrichment on the sequence, it was found that the bases at each site of the motif sequence were also very stable. However, the related functions of these highly conserved motifs need to be studied. The 302 clinical samples collected from various regions in Guangdong were tested and none of them detected positive for tilapia lake virus. Through molecular epidemiology analysis of tilapia lake virus, although there is no epidemic trend of tilapia lake virus in China, we should strictly prevent and control the import of tilapia lake virus in our import and export trade.
Keywords:tilapia; tilapia lake virus(TiLV); molecular epidemiology
基金項目:广东省青年创新人才项目(2018GkQNCX069);清远市科技计划项目(220804107510735);广东省水产经济动物病原生物学及流行病学重点实验室开放基金(PBEA202009)
作者简介:刘助红(1985-),男,汉族,硕士研究生,副教授。研究方向:水生动物疫病研究,E-mail:290415174@qq.com。
