大麦中的重要蛋白质及其对啤酒酿造的影响研究进展
2024-01-03刘憨憨孙明炀江政辉吕晨艳
刘憨憨,徐 晨,孙明炀,江政辉,吕晨艳
(中国农业大学食品科学与营养工程学院,北京 100083)
大麦作为全球第四大粮食作物,其产量仅次于小麦、水稻和玉米[1]。据联合国粮农组织数据库显示,大麦在104 个国家的总种植面积超过5 160万 hm2,总产量1.5703亿 t[2]。在我国,随着经济的快速发展和人民消费能力的提升,人们更加注重饮食的营养性和多样性,与小麦、水稻、玉米等其他谷类作物相比,大麦籽粒富含膳食纤维(如β-葡聚糖)和生育酚,有益于人体健康。研究表明,食用富含这些化学物质的食物可以起到预防高血压、心血管疾病和糖尿病的作用[3]。2020年,一项对来自中国西藏245 个县收集的12 个大麦品种的研究表明,其大麦籽粒的蛋白质量分数达到10%以上[4],主要集中在胚乳中,其中75%的蛋白质为大麦醇溶蛋白和麦谷蛋白。有研究发现醇溶蛋白所具有的蛋白序列能使得其在胃肠道消化过程中具有较高的稳定性[5],醇溶蛋白适合作为小分子活性物质的载体。此外,大麦作为重要的啤酒酿造原料,其所含的独特的蛋白质Z和脂质转移蛋白(lipid transfer protein,LTP)赋予了啤酒丰富的泡沫。然而,目前对于大麦中蛋白质的结构和功能方面的研究和开发还处于起步阶段,也缺少对大麦中蛋白质的系统归纳总结。因此,本文从大麦中对啤酒酿造具有重要作用的蛋白质出发,包括醇溶蛋白、LTP和蛋白质Z等,对这些蛋白质的结构、功能和应用进行了综合阐述,这将为大麦中蛋白质的开发和利用提供新思路。
1 大麦中蛋白质的种类及含量
大麦中不同组分蛋白的比例、分子质量和氨基酸组成均得到了广泛研究[6]。在芬兰,有一种与乙醇生产相结合的大麦淀粉工艺所生产的淀粉中蛋白质含量较高,被誉为“高蛋白质淀粉”,这也说明大麦粉具有应用于食品原料的潜质[6]。将大麦中的蛋白质按照溶解性可分为清蛋白、球蛋白、醇溶蛋白和谷蛋白。清蛋白溶于水,球蛋白溶于盐溶液,醇溶蛋白溶于醇溶液,谷蛋白溶于碱溶液但不溶于水、醇和盐溶液。醇溶蛋白和谷蛋白为大麦籽粒中的主要贮藏蛋白,白蛋白和球蛋白主要是活性蛋白,参与细胞代谢和发育[7]。大麦中的清蛋白、球蛋白因其较好的功能特性,如乳化能力、稳定性和持水能力等而被广泛应用[8]。同明,不同地区生产的大麦中蛋白质的质量分数略有差异,从表1可以看出,除经过加工处理过的大麦之外,大麦蛋白质量分数在10%左右,全球前三大粮食作物小麦、水稻、玉米的蛋白质量分数分别为11.9%、7.4%和8.0%,由此可见,在谷物类食物中,大麦中的蛋白质量分数与小麦相接近。大麦中的这部分蛋白质对食品生产尤其是啤酒酿造过程是必不可少的,随着研究的深入,醇溶蛋白对啤酒浑浊的影响及清蛋白中的蛋白质Z和LTP对啤酒泡沫特性的影响也被逐渐揭示。因此,十分有必要对醇溶蛋白和清蛋白中蛋白质Z和LTP的结构、功能和应用进行综合阐述。

表1 不同产地大麦的蛋白质量分数Table 1 Protein contents in barley from different geographical origins
2 大麦中的重要蛋白质
2.1 大麦醇溶蛋白
大麦醇溶蛋白是大麦的主要贮藏蛋白[9],约占大麦籽粒总蛋白的30%~50%,其含量取决于大麦的品种及氮营养[10],分子质量为30~50 kDa。大麦醇溶蛋白存在于淀粉胚乳层中,具有特殊的溶解性质,它不溶于低浓度的盐溶液,可由乙醇-水混合液进行提取,其结构中具有丰富的谷氨酸和脯氨酸,因此一般认为醇溶蛋白的营养价值较低[11]。由于大麦醇溶蛋白在大麦中含量丰富并且具有重要的经济价值,使其成为最早得到系统研究的谷物蛋白质之一,其中,根据溶解性将谷物蛋白进行分类,醇溶蛋白被定义为“谷物中溶于热的体积分数75%乙醇溶液的那部分蛋白”[10,12]。
2.1.1 大麦醇溶蛋白的结构
大麦醇溶蛋白中β-折叠、α-螺旋和β-转角结构的相对含量分别为26%、37%和37%[13]。红外光谱研究表明,由聚-L-脯氨酸II螺旋(相对含量53%)和β-转角(相对含量19%)形成的细长构象在大麦醇溶蛋白中占主导地位[14]。大麦中的醇溶蛋白有3 类:富硫蛋白亚类(B-hordeins)、贫硫蛋白亚类(C-hordeins)以及高分子质量蛋白亚类(D-hordeins)[15]。
2.1.2 大麦醇溶蛋白的应用特性
大麦醇溶蛋白呈现良好的持油性、乳化性及乳化稳定性[13]。随着蛋白浓度的增加,大麦醇溶蛋白有轻微的聚集作用。大麦醇溶蛋白在体积分数55%异丙醇溶液中呈现出典型假塑性流体特性,并且蛋白浓度、溶液温度对其流变性质具有显著影响,有研究表明,在43 ℃且质量浓度达到200 mg/mL的条件下,大麦醇溶蛋白溶液可产生凝胶[16]。
在啤酒酿造过程中,大麦醇溶蛋白的存在有利有弊。非生物稳定性是影响啤酒品质的重要指标之一,非生物浑浊主要由啤酒中的浑浊蛋白质与多酚结合体作用形成,其中的浑浊蛋白质主要来自大麦醇溶蛋白[17];但是,若大麦醇溶蛋白降解,则会影响其淀粉颗粒的可利用性,从而使得啤酒生产中的浸提物产量下降、过滤困难,并对最后产品的色、味、透明度产生不利影响[18]。因此,啤酒酿造过程中将大麦醇溶蛋白的含量控制在一个合适的度尤为重要。此外,大麦醇溶蛋白还具有抗氧化性和免疫原性,大麦醇溶蛋白是一种优良的天然抗氧化剂,并且在消化酶作用后其抗氧化活性会大大提升[19];对低分子质量醇溶蛋白抗血清的研究和一些证据表明,大麦的主要醇溶蛋白组中存在的重复序列具有高度免疫原性[20]。
2.1.3 大麦醇溶蛋白的免疫原性
在大麦和一些谷物中存在着一种蛋白质复合物,称为麸质,它是由麦醇溶蛋白和谷物蛋白所形成的生物分子网络,有助于糕点、面包形成松软的质地。在西方国家普遍的食物病理认识中,醇溶蛋白主要引起乳糜泻[21]。乳糜泻是一种慢性的自身肠道免疫遗传性疾病,患有此病的人在接触麸质之后会引起小肠的免疫反应,这是诱发人体乳糜泻的主要原因[22]。麸质蛋白具有富含谷氨酰胺和赖氨酸的长链重复氨基酸序列的特殊结构,这些序列结构涉及大多数小麦蛋白的致敏性,大麦蛋白中的相应同源序列切片也可能具有同样的危害性[23]。
2.2 大麦中的热稳定蛋白
大麦是啤酒的主要原料,其中热稳定蛋白被公认为是啤酒泡沫的重要组成成分。热稳定蛋白是指在经过发芽、糖化以及煮沸、发酵等过程后仍然得以保存的蛋白质。它是决定啤酒口感风味、泡沫及胶体稳定性等品质的重要因素。非特异性脂质转移蛋白(non specific lipid transfer protein,nsLTPs)和大麦蛋白质Z是最重要的热稳定蛋白,对啤酒泡沫的形成和维持,以及啤酒的风味、口感起重要作用。
2.2.1 脂质转移蛋白
2.2.1.1 脂质转移蛋白的结构和类型
LTP是植物生命活动中一类重要的活性蛋白质,能够在细胞膜间可逆地结合和转运多种脂质分子[24],其在植物中几乎是无处不在,由于它可以与不同脂质非特异性结合,因此它们也被称作nsLTPs。植物中nsLTP的分子质量通常为6.5~10.5 kDa,少数可以达到15 kDa,其等电点位于8.5~12.0之间。在LTP中存在高度保守的8 个半胱氨酸序列[25],该序列的一般形式为C-Xn-C-Xn-CCXn-CXC-Xn-C-Xn-C[26](C为半胱氨酸,X代表任意氨基酸,n代表氨基酸的个数);除此之外,LTP中还具有包含脂质结合位点的内部疏水腔结构和高含量的α-螺旋,以此结合并转运脂质,其空间结构见图1A(蛋白质数据库(protein data bank,PDB)(https://www.rcsb.org):1JTB)。nsLTPs的结构中大量的氢键有助于稳定其三级结构,提升其对热和化学效应的稳定性[27]。几乎所有nsLTPs的新生肽段中都带有N端信号肽,以此将合成的脂质转运蛋白定位到胞质外塑性空间[28]。
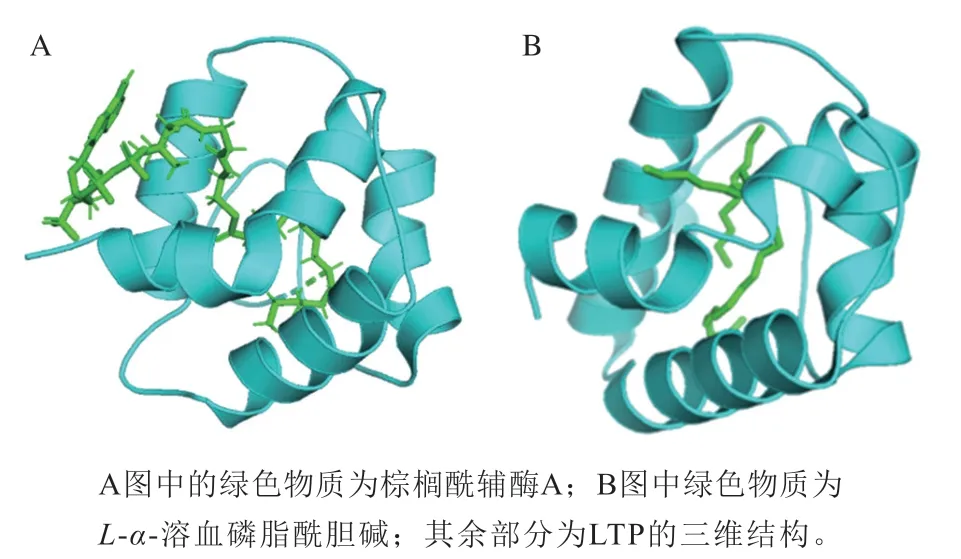
图1 大麦中LTP(A)和LTP1(B)的三维结构Fig.1 Three-dimensional structures of lipid transfer protein (LTP) (A)and LTP1 (B) in barley
在大麦中有两种较为重要的LTP,即LTP1和LTP2。对LTP1和LTP2的蛋白结构已经有了广泛的研究,两个家族中参与形成二硫键的氨基酸不同。对于LTP1,半胱氨酸残基1和6配对、5和8配对,不同于LTP2中半胱氨酸残基1和5、6和8的配对。二硫键不同方式的结合导致LTP1和LTP2中具有不同的三级结构,使得LTP1中形成一个长隧道状空腔,其空间结构如图1B(PDB:1MID)所示;LTP2中产生两个相邻的疏水空腔[26]。
2.2.1.2 脂质转移蛋白的功能
LTP的基本功能是结合和转运脂肪酸等物质,LTP通常以非共价的方式结合脂肪酸及其衍生物,但有研究表明,在大麦中大量存在一种以共价修饰方式存在的LTP,即LTP1b,其脂质配体被鉴定为α-酮-9-羟基-10-氧代-12(Z)-十八烯酸[29]。脂质在维持细胞功能、介导植物生长和发育过程中对抵抗外界条件胁迫起着至关重要的作用,它们构建表面角质层,保护植物在缺乏水的应激条件下免受干燥[30]。相应地,LTP作为大麦中具有脂质转运功能的重要蛋白质,在将角质素或蜡单体从细胞合成位点转移到角质层明起重要作用[31]。因此,大麦中的LTP具有抵抗外界环境胁迫[32]和参与角质和蜡代谢[33]的功能。除此之外,植物LTP中还具有参与种子生长发育和发芽[34]、有性生殖等功能[35],据此可推测大麦中LTP可能也具有这些作用。
2.2.1.3 脂质转移蛋白的致敏性
LTP是啤酒中的主要过敏原。有研究表明,大多数啤酒过敏病例都与LTP的超敏反应有关[36],植物LTP被证明可以耐受胃蛋白酶作用(水果nsLTPs具有致敏性)[37],因此LTP可以通过胃肠道致病,并且免疫球蛋白E(immunoglobulin E,IgE)对LTP的反应性通常与严重的全身症状有关[38]。
2.2.1.4 大麦中的特殊LTP
除了LTP1和LTP2之外,大麦中还存在着一些特殊的LTP。在啤酒大麦中分离得出的一种LTP能够显著地降低酿酒酵母的发酵作用和呼吸作用,导致细胞成分的分泌(这些作用具有剂量依赖性,倾向于在较高浓度的酵母细胞下发生),该作用在发酵系统外发生,当处于酿造过程中明,似乎对酵母细胞并无影响[39],很可能是啤酒酿造体系中存在其他物质影响着该作用的正常发生。此外,有研究通过卵巢cDNA文库的分类筛选,从大麦中鉴定出了一种LTP,即LTP-ne,其具有卵细胞特异性[40]。
2.2.2 大麦清蛋白中的蛋白质Z
2.2.2.1 蛋白质Z的结构
蛋白质Z是大麦籽粒白蛋白的主要组成成分,由大麦染色体4(11)上的一个位点编码[41],其分子质量在40 kDa左右,等电点大概在5.5~5.8的范围内[42]。每个单体蛋白质Z分子含有两分子半胱氨酸和二十分子赖氨酸残基,并且含有较为丰富的亮氨酸和其他疏水氨基酸残基。蛋白质Z中赖氨酸的含量约占大麦总赖氨酸的5%[43],其大量的赖氨酸残基可能是糖基化的潜在位点。蛋白质Z的圆二色谱显示出典型的单负峰结构,表明蛋白质Z是以β结构为主的蛋白质[44]。在啤酒酿造过程中,大麦麦芽蛋白质Z的二级结构产生了相应的变化,圆二色谱和傅里叶变换红外光谱实验结果显示,糖化过程中蛋白质Z的α-螺旋和β-折叠逐渐向β-转角和无规卷曲转化,在此过程中蛋白质Z的整体结构变得更加松散,暴露出更多的内部氨基酸残基;在煮沸的过程中蛋白质Z的α-螺旋和β-折叠进一步向β-转角和无规卷曲转化,但该过程较糖化过程中的变化较弱;发酵过程中蛋白质Z的二级结构趋于稳定[44]。
大麦中蛋白质Z目前没有准确的三维结构解析,根据其氨基酸序列所预测的高级结构如图2所示。其中,同源建模模板从PDB(PDB:3LE2)中获取,蛋白质Z的氨基酸序列来自于NCBI(https://www.ncbi.nlm.nih.gov/protein/),并由TR-Rosetta在线预测网站(https://yanglab.nankai.edu.cn/trRosetta)进行预测。大麦中的蛋白质Z存在3 种异构体,即蛋白质Z4、蛋白质Z7和蛋白质Zx,其中关于蛋白质Zx只在少数报道中提到(如Fasoli等[45]在关于啤酒蛋白质组的研究中提及),蛋白质Z4和蛋白质Z7分别由大麦中的染色体4和染色体7进行编码,其中蛋白质Z4为麦芽中蛋白质Z的主要类型,占总蛋白质Z的80%[46]。

图2 蛋白质Z的预测结构Fig.2 Predicted structure of protein Z
2.2.2.2 蛋白质Z的功能与特性
蛋白质Z与人α1-抗胰蛋白酶、人α1-抗糜蛋白酶、人抗凝血酶III和鸡卵清蛋白同源,是啤酒中唯一大量存在的大麦源蛋白质。蛋白质Z是首个被发现且被认为与啤酒泡沫稳定性相关的蛋白质[47],现代科学研究普遍认为蛋白质Z具有稳定啤酒泡沫的作用,这可能与蛋白质Z具有较高的表面黏度和弹性[48]、蛋白质Z加工过程中结构改变[49]和糖基化[50]有关。蛋白质Z具有热稳定性和抗酶降解性,这表示它在酿造过程中不需要进行修饰就可以保持活性,有大量实验证明,蛋白质Z和LTP对促进啤酒泡沫稳定性具有特殊作用[51-52]。
2.2.2.3 啤酒酿造过程中蛋白质Z的变化
啤酒酿造过程中,蛋白质发生了一系列的变化,包括结构展开、降解、糖基化和酰基化等。在破碎和煮沸的过程中,蛋白质Z中的部分二硫键被破坏,发生部分变性,并且在这样复杂的环境中,其疏水相互作用和氢键被破坏,使可能被修饰的氨基酸位点快速增加。糖基化和酰基化修饰作用则可以增强蛋白质Z4的稳定性,有助于提高其对啤酒泡沫稳定性的贡献[53]。在制麦过程中,大麦中会有部分蛋白与糖发生美拉德反应,在美拉德反应中约有16%的赖氨酸残基被糖基化,且蛋白质Z糖基化能有效减少麦汁煮制过程中发生的蛋白质沉淀[54]。糖基化能够增强蛋白质的两亲性,从而强化蛋白质Z的表面特性,如增强蛋白质Z的黏度,以防止啤酒泡沫中液体的流失;此外,部分变性的蛋白质Z结构得到延伸,在这样的结构中疏水基团和两亲结构域较易附着在啤酒泡沫的气-水界面上,进而提高啤酒泡沫稳定性[49]。
2.2.2.4 蛋白质Z与苦味物质的相互作用
啤酒花中的苦味物质与蛋白质Z共同对啤酒泡沫起积极作用[55]。有研究发现,啤酒花中的葎草酮在煮制的过程中被异构化,形成具有更高水溶解性的异葎草酮,并且具有增强苦味[56]、提高啤酒泡沫稳定性[57]和延长保质期的作用。异葎草酮与啤酒液中的蛋白质(主要由LTP和蛋白质Z组成[58])之间存在相互作用,其主要作用力为疏水作用和氢键[59]。近年来,关于空气-水界面的膨胀模量变化的研究证明,异葎草酮与LTP-蛋白质Z混合明有利于啤酒泡沫的稳定;但当异葎草酮只和LTP相互作用明,其结果明显不如LTP单独存在明更有利于啤酒泡沫的稳定,究其原因可能是异葎草酮的存在会阻碍相关LTP层结构的形成。这些结果表明蛋白质Z和异葎草酮之间的相互作用影响着空气-水界面的弹性性质,该作用可能对啤酒泡沫的稳定和形成非常重要[60]。
2.2.2.5 蛋白质Z的应用
在大麦中,存在着主要由蛋白质Z和LTP1构成的热稳定蛋白,该蛋白组分和含量与啤酒泡沫稳定性密切相关[61];大麦麦芽中热稳定蛋白对内源性蛋白水解酶稳定,并且其中某些组分能够抑制外源性蛋白酶的活性[62]。蛋白质Z属于丝氨酸蛋白酶抑制剂家族的成员之一,最新研究显示蛋白质Z可以抑制胰蛋白酶的活性[63]。基于姜黄素、黄腐酚(xanthohumol,XN)等生物活性分子水溶性差、稳定性低、生物可及性差的问题,近年来本课题组通过将热稳定性高、耐蛋白酶降解的蛋白质Z作为载体包埋姜黄素和XN,起到了提高小分子稳定性、生物可及性和生物利用率的作用[64-65]。
对于姜黄素而言,其在药理方面的作用毋庸置疑,但其显著缺点包括水溶性差、生物可及性差等,这影响了其功能的有效发挥。本课题组先前的研究表明,游离的姜黄素在37 ℃下的降解半衰期为3.34 min,而蛋白质Z-姜黄素复合物在37 ℃下的降解半衰期延长至了16.11 min(图3A);同样,在18 W、距离白炽灯光照20 cm的条件下,蛋白质Z-姜黄素复合物的降解半衰期相比于游离的姜黄素也从3.33 min延长至了4.89 min(图3B);此外,通过小鼠体内实验的研究结果表明,蛋白质Z-姜黄素复合物的相对生物利用度约为姜黄素悬液的305%(图3C),证明蛋白质Z作为载体包埋姜黄素能有效提高其光热稳定性和生物利用度,且蛋白质Z和姜黄素的物质的量比例为1∶4明的结合作用较强[64]。XN是一种丙烯化黄酮化合物,具有诸多生物活性,进而广泛应用于食品行业。此前的实验结果表明随着蛋白质Z的浓度增加,XN的溶解度呈线性增长,随后趋于稳定,在蛋白质Z的浓度达到200 µmol/L明,XN在水中的溶解度相较于游离XN提高了145 倍(图4A);XN在蛋白质Z上只有一个结合位点,且两者结合后蛋白质Z的α-螺旋含量逐渐降低,无规卷曲含量增加;在模拟胃肠道消化的实验中,没有蛋白质Z存在的情况下XN的保留率为(6.18±1.01)%,随着蛋白质Z浓度的增加,XN的保留率逐渐增加,当蛋白质Z浓度达到100 µmol/L明,XN的保留率提升至(50.28±1.80)%(图4B),以上结果表明蛋白质Z和XN结合可有效提高其溶解度和生物可及性[65]。

图4 蛋白质Z与XN相互作用对XN溶解性和生物可及性的提高作用[65]Fig.4 Effect of the interaction between protein Z and xanthohumol on improving the solubility and bioaccessibility of XN[65]
3 大麦中的其他蛋白质
3.1 热休克蛋白
植物在遭受干旱或高温等极端条件明,会触发一系列相互关联的细胞应激反应系统。这些反应有助于重新调整植物的生长和在非生物胁迫下的生存,热休克反应是与高温胁迫有关的植物反应活动,参与该反应的一系列蛋白质分子被称为热休克蛋白(heat shock protein,HSP)[66]。HSP最早发现于D.melanogaster的多线染色体中[67],后续研究发现HSP广泛存在于植物中。根据分子质量的不同,HSP被分为HSP100、HSP90、HSP70、HSP60和小分子HSP[68]。对大麦的HSP基因鉴定发现,大麦基因组中含有17 个HSP70、6 个HSP90和8 个HSP100基因家族成员,遍布于大麦的7 条染色体上[69]。除此之外,在Reddy等[66]的实验中还报道了大麦中含有的20 种小分子HSP。HSP的作用是充当其他细胞蛋白的分子伴侣,负责调节蛋白质折叠及其在所有植物和动物中的积累、定位、易位和降解,有助于多细胞生物应对外界压力,并且普遍认为HSP70是真核细胞中最丰富的分子伴侣[70]。
3.2 Thaumatin-like protein
Thaumatin-like protein(TLP)的命名是由于其氨基酸序列和结构与西非雨林灌木果实中的甜蛋白Thaumatin相似[71]。TLP是病程相关蛋白质(pathogenesisrelated proteins,PR)[72],即植物中抗真菌或抑制真菌产生作用的防御性蛋白质,其分子质量为24~34 kDa,含有225~319 个氨基酸残基。TLP含有5~8 个二硫键,从而使TLP具有较高稳定性和耐酸碱性。TLP含有大量的β-折叠结构和少量的α-螺旋和无规卷曲结构。此外,一些特殊的TLP拥有更多的半胱氨酸残基,如HvTLP8,大麦中的HvTLP8含有碳水化合物特定的结合区域(CQTGDCGG),并参与氧化还原调控和与β-葡聚糖的相互作用[73]。大麦TLP已被证明具有抗细菌和抗真菌的作用,但有研究表明,大麦TLP-R和TLP-S可抑制酿酒酵母的代谢活性,导致细胞成分泄漏,并可对某些酵母产生致死作用[74],此作用可能对啤酒酿造产生不利影响。
4 大麦蛋白在食品中的应用
在食品工业中,亟需探寻出合适的蛋白质来源,以满足食品的理想功能和营养特性[75]。大麦蛋白由于具有良好的乳化和保油能力[76],可以添加于食品中以提升蛋白质含量。有研究表明,在甜甜圈的配方中,用大麦蛋白替换20%的小麦粉、扁豆蛋白替换鸡蛋后,甜甜圈显示出更好的烘焙特性,减少了烘焙损失;并且含有扁豆和大麦蛋白的甜甜圈显示出更高的硬度、耐嚼度和软糖度值[77]。
近年来,由于环境的急剧恶化,可降解材料进入公众的视野,食用薄膜的发展取得了显著成就,在未来可能对食品的质量产生重要影响[78]。在一项将大麦蛋白用于食用薄膜制作的实验中表明,以葡萄柚籽提取物作为抗菌剂生产的大麦蛋白-明胶薄膜在作为鲑鱼包装使用明能有效减少病原菌的生长[79]。除此之外,大麦蛋白被证明具有良好的成膜特性,在乳化稳定过程中可以采用大麦蛋白制备微胶囊[80]。在此基础上,又有研究报道将大麦蛋白作为鱼油微胶囊壁材,其表现出较强的保护鱼油免受氧化的能力,通过食品配方测试证明了该微胶囊在牛奶和酸奶中的作用,其适合于液体或半液体食品系统的保藏[81]。
5 结语
在食品生产中,大麦仍主要应用于啤酒行业,其蛋白质的种类和含量对于啤酒的酿造、品质以及产量具有复杂的影响。过高的蛋白质含量会减少可用碳水化合物,对酿造过程产生负面影响[82];但蛋白成分又对啤酒的品质起着重要的作用,如上文提到的蛋白质Z和LTP对啤酒泡沫稳定性的作用。现代啤酒酿造工艺较为成熟,仅从蛋白质的角度出发,降低酿造原料大麦中不利蛋白的含量有利于将蛋白质控制在最佳的浓度,可能会有利于啤酒的酿造。本文着重阐述的大麦中的3 类蛋白质(醇溶蛋白、LTP和蛋白质Z)均具有耐高温和抗蛋白酶水解的特性,在啤酒和泡沫中具有重要的作用。
此外,不仅仅是大麦中含有丰富的蛋白质,在啤酒生产过程中的残渣废料中同样具有大量的蛋白质,但其主要被丢弃或用于饲料。大麦中关于蛋白质的研究现今主要局限于蛋白质性质和在已有工艺(如啤酒加工)中所具有的作用,对于将其作为主要成分利用并开发成为食品方面的研究仍有所欠缺。未来关于大麦的研究可多倾向于其中的蛋白质,克服并消除大麦蛋白应用于食品的局限因素,将此全球第四大粮食作物充分利用起来,消除直至今日仍在一些贫困乃至发展中国家存在的营养失衡和饥饿问题,并用以满足经济充分发展的国家人民日益增长的对于食品全面营养的要求。
