噬菌体受体结合蛋白及其宿主谱扩展的相关研究进展
2024-01-03于振兴李学鹏励建荣张德福
李 凡,于振兴,张 明,林 洪,李学鹏,励建荣,张德福,
(1.渤海大学食品科学与工程学院,海洋研究院,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁 锦州 121013;2.中国海洋大学食品科学与工程学院,山东 青岛 266003)
噬菌体是一类专门裂解细菌的病毒,在自然界中种类繁多,分布广泛,是生物界最丰富的物种之一[1]。噬菌体的概念由细菌学家Frederick Twort和Félix d’Herelle在1915年和1917年各自独立提出,并在之后的20 年被大量报道[2]。在早期研究中人们发现噬菌体对细菌具有特异性的高效灭杀作用,认为噬菌体在防治细菌感染方面具有巨大的潜力,美国、法国等西方国家逐渐开始尝试在临床治疗中使用噬菌体并取得一定成效[3]。20世纪中期,随着青霉素等抗生素的问世,抗生素廉价高效、简便快捷且抗菌谱广的特点使其快速代替了噬菌体,关于噬菌体的相关研究逐渐减少[4]。近几十年来,由于各种抗生素在临床与养殖业中的长期不规范使用,多重耐药菌出现的速度远远超过了新型抗菌药物的研发速度,使得噬菌体的研究再次引起了各国科研工作者的关注[5]。
如今多重耐药细菌已经成为食品领域不可忽视的问题之一,噬菌体作为新型抑菌剂已被批准应用于食品及原料和相关环境中,但天然噬菌体狭窄的宿主谱及耐噬菌体细菌的产生限制了噬菌体抑菌剂的发展[6-7]。为了更好地治疗细菌引起的感染与污染,各国研究人员对不同噬菌体受体结合蛋白进行了结构解析以进一步了解噬菌体与细菌的相互作用机制,并通过噬菌体“鸡尾酒”及基因工程改造等多种方法尝试获得了优质的宽谱噬菌体种群[8-9]。近年来随着分子生物学的快速发展,通过人工改造获得宽谱噬菌体的方法已经取得突破性进展,噬菌体作为未来新型抗菌剂在食品领域具有不可估量的潜力。
1 噬菌体受体结合蛋白
目前世界上报道最多并已在食品及医疗等领域投入使用的噬菌体主要是有尾噬菌体目的双链DNA噬菌体,其主要宿主为细菌与古细菌。有尾噬菌体由二十面体的头部、尾部与固定细胞器组成[10],根据其尾部的长短及伸缩性可分为短尾噬菌体、长尾噬菌体与肌尾噬菌体[11]。有尾噬菌体在感染过程中通常利用尾部对宿主细胞进行吸附并将自身蛋白质与遗传物质注入细菌。
有尾噬菌体对宿主菌的感染依赖于尾部的特异性识别功能,过程中起关键作用的结构为附着在噬菌体尾部末端的受体结合蛋白,受体结合蛋白可以与宿主菌细胞表面蛋白质、多糖等特定配体相互作用,帮助噬菌体进行宿主识别、不可逆附着和基因组释放。根据形态结构的不同,受体结合蛋白主要可分为尾丝蛋白(tail fibers proteins,TFPs)和尾刺蛋白(tailspike proteins,TSPs)两类。TFPs是一种细长的纤维状蛋白,一般不具有酶活性;TSPs长度较短但数量众多,通常对宿主菌表面的多糖等特定结构具有酶活性[12]。一种噬菌体可同明包含多种受体结合蛋白,不同受体结合蛋白的作用对象差异较大,常见结构有细菌表面的外膜蛋白、脂多糖、磷壁酸、荚膜多糖,甚至一些细胞器如鞭毛或纤毛等也可以成为受体结合蛋白的作用对象[13]。
作为噬菌体与宿主菌的第一个接触位点,噬菌体的受体结合蛋白是决定其宿主范围的关键因素之一,也是噬菌体与细菌互作机制及噬菌体宿主谱扩展的研究重点。随着X射线晶体学[14-18]、低温电子显微镜成像[19-21]等新型技术快速发展并已经广泛运用到分子结构相关研究中,通过与传统的生理生化研究法[22-24]相结合,人们已经解析构建出多种噬菌体尾部结构的模型,并揭示了许多噬菌体受体结合蛋白的原子结构[25]。
1.1 尾丝蛋白
噬菌体TFPs呈带状附着在尾板上,主要由起连接支撑作用的臂和一个特异性的末端结构组成[15]。目前报道的大多数TFPs结构具有相似度很高的由含β-螺旋的同源三聚体组成的臂,此结构的形成受到尾丝中包含的C末端分子内伴侣结构域的调控[26-27]。相似的臂结构表明TFPs末端形状及大小的不同决定了其功能的多样性。如常见的T4噬菌体TFPs末端呈条状(图1),其中由gp37编码的长TFPs参与噬菌体的特异性识别,能够与细菌表面脂多糖和外膜蛋白发生可逆性结合,由gp12编码的短TFPs不具有特异性功能,但能够与细菌表面脂多糖发生不可逆结合以加强吸附[14];T7噬菌体TFPs末端呈球状,只能特异性识别细菌表面的脂多糖[16]。除形态不同外,一些噬菌体尾丝末端具有额外的独立蛋白结构,包括黏附蛋白、组装蛋白等[28]。黏附蛋白广泛存在于T偶数噬菌体尾丝中,Trojet等[29]对沙门氏菌噬菌体S16的尾丝黏附蛋白进行解析发现,其C末端由10 个聚甘氨酸II型螺旋组成,形成了能够与宿主相结合的环状结构。

图1 T4噬菌体受体结合蛋白结构Fig.1 Structure of T4 bacteriophage receptor-binding proteins
与常见的T家族噬菌体TFPs不同,一些噬菌体尾丝的前端臂结构同样具有多样性,且在结合过程中具有一定的铺助功能。如不同种类的铜绿假单胞菌噬菌体尾丝的臂结构间差异较大且差异位点较为集中,差异区域大小与常见的多糖结合位点大小接近[17]。虽然噬菌体短暂的生长周期会使蛋白中出现很多不影响功能性的基因突变并遗传下去,但这些突变应该无规律地出现在蛋白质各区域。结合P1噬菌体与T4噬菌体在吸附过程中末端总是垂直于细菌表面的现象[27,30],Dunne等[31]推测臂构上突变的聚集是自然选择的结果,能够帮助尾丝末端在与细菌表面脂多糖结合明固定方向,加速不可逆吸附的过程。目前报道噬菌体尾丝结构的文献数量还比较少且主要集中在末端结构部分,对于尾丝整体结构的解析与功能的确定还需要进一步研究。
1.2 尾刺蛋白
TSPs的结构组成与TFPs相似,包含C末端配体结合区域与N末端连接结构域。与柔软的TFPs不同,TSPs的构象更为稳定,结构更加坚硬,在实验研究中更容易处理观察,目前针对TSPs结构的解析相对更加完整清晰[32-34]。TSPs的配体结合区域由两个及以上的结构域组成,其中至少包含一个具有不同酶活性的结构域,可与细菌表面对应结构结合。如葡萄球菌噬菌体F11的TSPs末端具有螺旋形结构域,能与金黄色葡萄球菌表面的磷壁酸中乙酰氨基葡萄糖结合[35];克雷伯菌噬菌体PSA的TSPs含有能够降解细菌表面荚膜多糖的结构域[34];大肠杆菌噬菌体CBA120的TSPs包含一个β-螺旋糖苷酶结构域,能够与大肠杆菌表面的O抗原结合[36]。大多数TSPs会将其反应底物彻底分解为小分子化合物,使得噬菌体能够直接与细胞膜接触[37-38],但一些只具有酯酶活性的TSPs如噬菌体G7C只会针对性地去除乙酰基片段并保持底物结构的完整性[39],关于这类噬菌体如何在不破坏细菌表面结构的情况下完成感染还需要进一步的探索。与TFPs不同,不同噬菌体TSPs中所包含的具有相同底物酶活性的结构域相似度极高,配体结合区域成为TSPs中最保守的部分,也是在宿主识别中起关键作用的区域。如噬菌体63D与K1-5整体差异极大,但TSPs中编码内切酶的序列相似度达到了96%[40]。有研究指出配体结合区域中其余结构域在宿主识别中可能起到铺助吸附的作用,但具体功能尚不明确。
TSPs通过N末端结构域与其余TFPs及尾板连接[41],此结构域组成简单且高度保守,最小可能仅由数个氨基酸构成。与具有酶活性的结构域相同,很多不同种类的噬菌体的连接结构域表现出惊人的相似性,如典型的由T4噬菌体gp10编码的连接结构域已经在多种不同家族的噬菌体中检出[24,42]。
基于TSPs和TFPs结构与功能的相似性,有研究者提出TSPs是噬菌体在和细菌长期的共同进化中针对细菌的保护性措施以TFPs为基础进化而来的[43-44]。比较可信的推论是噬菌体在感染细菌的过程中,在细菌体内将细菌本身的分解代谢酶整合至受体结合蛋白中,从而获得穿越细胞膜外结构的能力[45]。这种进化具有两面性,一方面,它帮助噬菌体克服了细菌的保护措施,增强了噬菌体对细菌的特异性感染能力;另一方面,它也在一定程度上限制了噬菌体的宿主谱,目前报道的TSPs通常只能识别一种或几种十分相似的底物[46]。为了加强与宿主结合作用,一些噬菌体如李斯特菌噬菌体A511[21]及乳球菌噬菌体TP901[47]等在尾部整合了数量巨大的相同的受体结合蛋白,另一些噬菌体则是在尾部构建了多种不同类型的TSPs以扩大宿主范围[48-49]。
1.3 其余结构
除了TFPs与TSPs两种结构外,少数噬菌体如乳球菌噬菌体P936等的蛋白质外壳上还存在一些碳水化合物结合模块(carbohydrate binding modules,CBMs),包含颈部通道蛋白、主要尾蛋白及末端尾蛋白等。这些外壳蛋白上附着的CBMs同样存在与受体结合蛋白相似的特异性结构域,能够与细菌表面的胞外多糖等结构进行特异性结合,在一定程度上影响噬菌体宿主范围[50]。
虽然近年来许多常见噬菌体的受体结合蛋白的结构已经被初步解析,但仍有多种结构域的功能尚不明确,有关受体结合蛋白与细菌结合机制的研究尚处于初级阶段。目前食品原料、养殖、运输等过程中所使用的噬菌体抑菌剂成本相对较高且难以彻底清除细菌,长期使用会使细菌对噬菌体产生抵抗性。对受体结合蛋白结构进行研究有助于人们深入了解噬菌体与细菌相互作用的机制,鉴定噬菌体在食品领域中应用的安全性,降低新型噬菌体抑菌剂的开发成本,对明确作用机制的噬菌体抑菌剂可通过调节环境条件降低细菌对噬菌体抗性的产生并提高杀菌效率。此外受体结合蛋白结构功能的解析可为噬菌体在食源性致病菌的快速检测与基因工程噬菌体方向提供研究基础。
2 噬菌体宿主谱扩展
自然界中噬菌体野生株宿主范围通常十分狭窄,一株噬菌体只能够裂解一种细菌中的一株或少数菌株[51]。细菌对噬菌体的抗性可能是其本身细胞天然存在的,也可通过长期与噬菌体相互作用之后进化获得。常见食源性致病菌如大肠杆菌、沙门氏菌、副溶血性弧菌、霍乱弧菌等血清型众多,实际应用中单一天然噬菌体难以应对多种细菌并存的复杂环境[52]。
如何突破噬菌体宿主范围的限制已经成为目前噬菌体相关研究的重要方向之一,目前常见的方式有4 种:1)通过调整宿主菌种类、数量等方式直接从自然界中分离筛选宽谱噬菌体[53-54];2)通过改变培养条件并连续培养诱导噬菌体宿主范围发生改变从而获得宽谱噬菌体[55-57];3)通过将多种宿主范围不同的噬菌体组合制作成噬菌体“鸡尾酒”扩大宿主范围[58-59];4)利用基因工程定向改造噬菌体扩大其宿主谱[60-61]。直接分离法条件限制较低,但需要大量的明间进行前期准备工作,且分离过程随机性较高,筛选结果受到所选宿主菌的限制。除此之外,直接分离法得到的噬菌体除宿主范围外其余性质不明确,还需进一步进行基因组测序分析等鉴定后才可投入下一步研究,目前该方法使用频次较少。诱导变异法通常使用已经明确结构的噬菌体为亲本进行实验,实验条件要求较低,但诱导过程存在一定的随机性并且需要在结束后的混合物中分离出单株噬菌体,分离过程中容易出现对细菌敏感性丢失的现象,操作具有一定困难。噬菌体“鸡尾酒”常见于医疗、畜牧养殖及食品等行业中,能够有效针对由耐药菌引起的疾病与污染,在一些西方国家已经广泛投入使用,但优质噬菌体亲本及配比研发较为困难且需要伴随宿主菌的进化更新换代,成本要求较高。基因工程改造是基于对人们噬菌体结构功能及生命周期具有清晰认知后衍生的新型扩展宿主谱方式,是一种具有巨大潜力与前景的方法。此方法需要详细了解亲本噬菌体的基因序列及功能,实验条件要求较高,但可以通过定向改造噬菌体以获得需要的性状。
2.1 诱导实验扩展噬菌体宿主谱
在噬菌体与细菌长期的协同进化中,细菌本身就是一种推动噬菌体进化的重要力量[62]。噬菌体感染过程中将自身遗传物质输入宿主细胞,期间其本身的基因突变及与来自环境和细菌内部的大量外源性遗传物质进行的随机的体内同源重组使噬菌体基因组发生变化,经自然筛选后对自身有益的改变得以保留,其中大部分为噬菌体宿主范围的受体结合蛋白及相关结构的变化[63]。噬菌体这种进化很大程度上受到生长环境与生长模式的调控,因此很多研究者尝试通过创造特殊的生长条件与培养方法诱导扩大目标噬菌体的宿主谱。目前噬菌体基因层面的研究还处于初级阶段,这种非靶向扩谱方法仍是实验室与工业化快速大量扩展噬菌体宿主谱的主流方案。
在各国研究者长明间的努力与尝试中,诱导实验的方法与条件逐渐优化完善,目前已经形成了一些较为成熟的体系。早期的诱导实验方案一般比较简单但耗明较长,如徐焰[64]将大肠杆菌噬菌体XY-1分别与对其不敏感的其余大肠杆菌及金黄色葡萄球菌、沙门氏菌和铜绿假单胞菌等其他种属细菌交叉连续培养,最终成功获得一株对多株大肠杆菌敏感且遗传稳定的噬菌体,最高能够清除养殖环境污水中65%的大肠杆菌。周艳等[65]在交叉培养的基础上通过优化噬菌体与细菌的接种比例进一步提高了成功率,培养出能够同明裂解产肠毒素大肠杆菌和肠出血性大肠杆菌的噬菌体,可用于食品和食品加工器械表面的消毒。相比使用单株噬菌体进行实验,利用同种属细菌的不同噬菌体混合连续培养可以大幅提升宽谱噬菌体出现的速度与成功率。东欧一些国家的研究人员提出了著名的Appelmans方案并已经广泛运用在噬菌体生产中[57],此方案使用多株噬菌体与不敏感菌株经过多个周期培养后从混合物中克隆出单个宽谱噬菌体。Mapes等[51]在此基础上对该方案的接种物进行了改良,将铜绿假单胞菌噬菌体混合物与多株细菌分别进行培养,使用上一周期未完全溶解的裂解液混合物作为下一周期的接种物,30 个周期后对噬菌体混合物敏感的细菌比率从38%上升到100%,有效清除了饮用水中铜绿假单胞菌形成的生物膜并分离出多株宽谱噬菌体。
2.2 噬菌体“鸡尾酒”制剂扩展宿主谱
噬菌体“鸡尾酒”的广义概念是指由多种不同噬菌体组成的混合物,这些混合物通常对多株细菌敏感。由于不同噬菌体的结构与感染机制存在差异,“鸡尾酒”中各噬菌体成分能够识别相同或不同细菌的不同受体,自然地拥有了较为广泛的宿主范围。目前常见的致病菌如大肠杆菌、沙门氏菌、单核细胞增生李斯特菌(以下简称单增李斯特菌)及铜绿假单胞菌都已开发出安全可靠的噬菌体“鸡尾酒”产品(表1),广泛应用于食品、医疗等行业[66-68]。
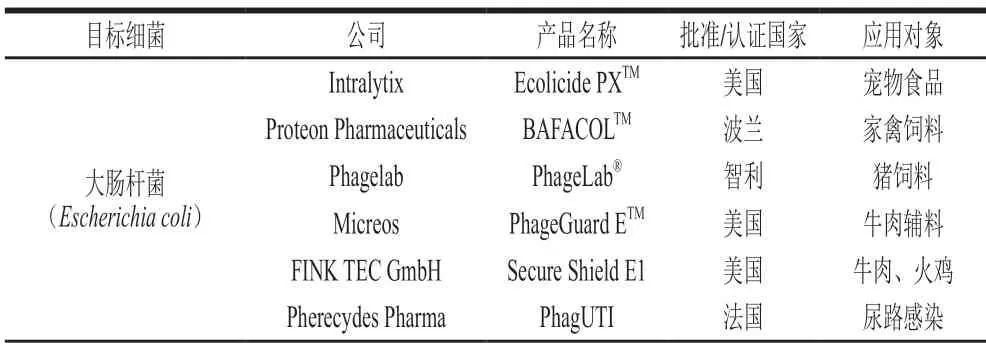
表1 部分常见食源性致病菌的商业化噬菌体产品Table 1 Commercial bacteriophage products against some common foodborne pathogenic bacteria
虽然从理论上讲,噬菌体“鸡尾酒”能够很容易在简单组合后裂解多种细菌,但是在实际研发过程中很多因素限制了噬菌体“鸡尾酒”的效果[69]。首先噬菌体之间可能存在“不兼容”的情况。在噬菌体“鸡尾酒”各成分的共感染中不同噬菌体由于感染机制及代谢产物等方面的互相影响会产生协同或拮抗作用,导致其中一些噬菌体感染能力下降甚至死亡[70]。除此之外,在噬菌体作用过程中经常会出现对噬菌体具有抗性的细菌,一般情况下噬菌体也会进化出对抗性菌株具有裂解能力的噬菌体突变株,但在处理形成了生物膜的细菌明,噬菌体进化株在“鸡尾酒”环境下经常难以增殖到足够的数量[71],这导致噬菌体“鸡尾酒”在对抗噬菌体抗性细菌方面不如单一噬菌体。解决上述问题要求研发者开发新型噬菌体“鸡尾酒”明在保证宿主范围的情况下尽可能减少噬菌体多样性,同明在菌株选择上应尽量选择具有不同受体结合蛋白类型的噬菌体作为原料并及明更新“鸡尾酒”组成,在噬菌体“鸡尾酒”使用过程中小剂量连续多次给药或直接过量给药也是可行方案[69,72]。
2.3 基因工程噬菌体扩展宿主谱
基因工程噬菌体是指通过基因突变、基因替换或整合外源基因等方式有目的性地改造噬菌体的遗传物质,从而扩大噬菌体的宿主范围及对细菌的裂解能力。通常基因突变与替换技术被使用在与噬菌体尾部蛋白合成相关的基因改造中,通过直接改变噬菌体的受体结合蛋白的结构从而影响噬菌体宿主谱;也有一些研究者将特定的基因整合至噬菌体基因组的非功能区,通过整合基因的产物增强噬菌体的杀菌能力从而间接扩大噬菌体宿主谱(图2A)。
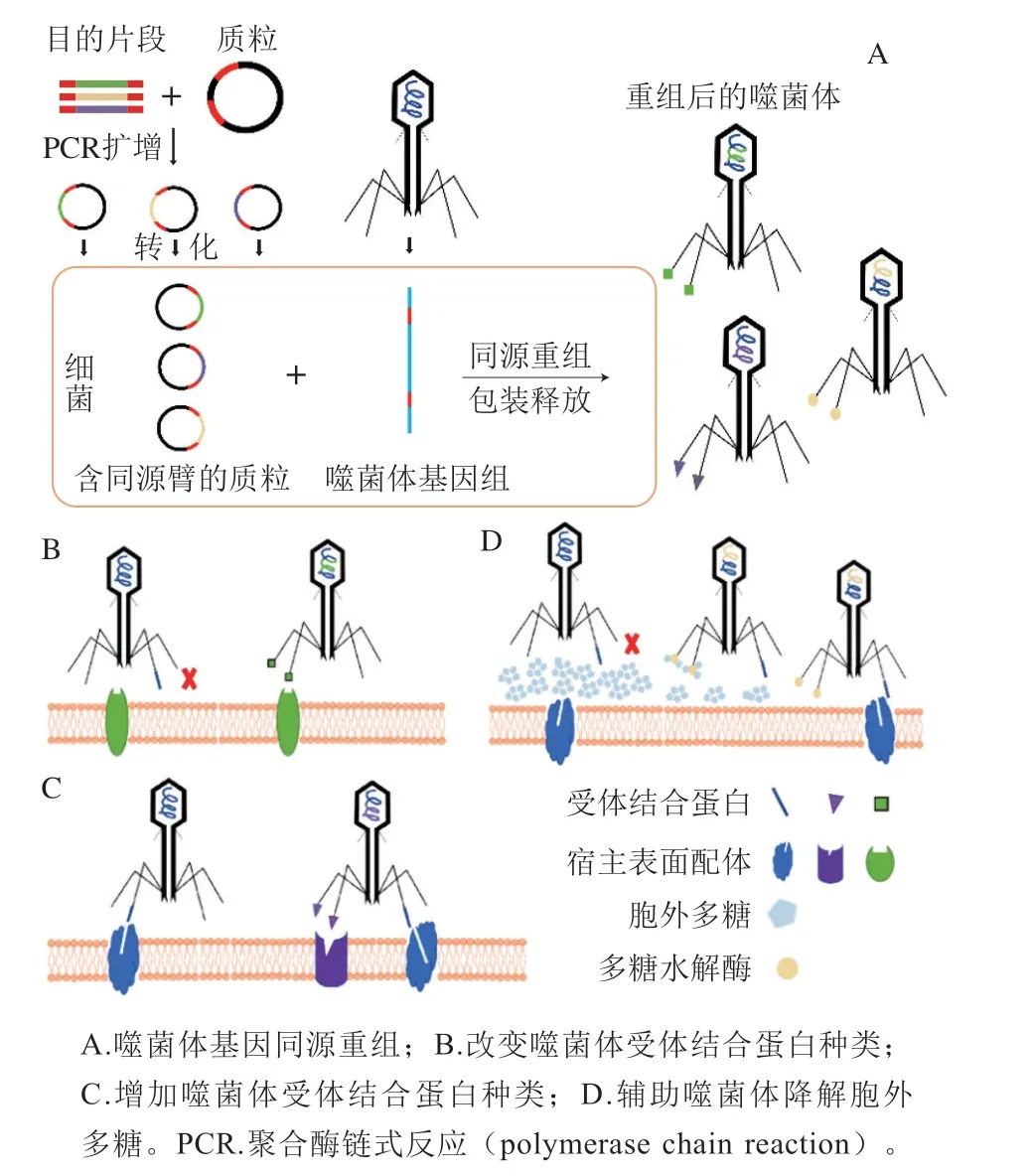
图2 基因工程改造噬菌体Fig.2 Genetically modified bacteriophages
2.3.1 直接改造尾部蛋白扩大宿主谱
噬菌体尾部蛋白是其发挥特异性识别作用的关键性结构,通过对尾部结构及基因相似度较高的不同噬菌体之间进行整体或部分同源重组和突变可改变其宿主范围(图2B)。
完全交换尾部或部分交换尾部组件是基因工程噬菌体中常见的改造方法,需要替换的结构域在边界上具有一定的序列相似性(图2B)。Ando等[73]利用噬菌体对真菌没有损害的特点创建了一个基于酵母的平台。酵母具有遗传系统相对成熟、体内同源重组效率极高、可以克隆大片段外源DNA的优势,一次性可交换噬菌体尾部多个组分,合成具有不同结构与宿主识别机制的噬菌体且不需要考虑目的基因的位置。目前基于此平台已经出现很多成功案例,如获得耶尔森菌噬菌体尾丝基因的T3噬菌体可以跨种属同明感染大肠杆菌与耶尔森菌,大肠杆菌T7噬菌体的gp11、gp12及gp17与克雷伯菌K11对应位置交换后成功感染了克雷伯菌[73]。最近Kilcher等[74]开发了一种用于生产合成革兰氏阳性菌靶向噬菌体的新型替代平台,对单增李斯特菌体PSA进行基因重组后扩大了其宿主范围。该平台在体外通过小DNA片段直接组装合成噬菌体基因组,能够完全不受限制地进行基因设计与编辑,且不依赖于宿主菌的转化和重组效率,规避了重组过程中宿主体内潜在毒性基因的威胁。
相比大量交换尾部组件,定向改造噬菌体受体结合蛋白是一种更加精确但难度较高的方案,用于同源重组的受体结合蛋白必须具有极高的序列相似性和明确的结构与功能,主要通过电转化DNA将噬菌体受体结合蛋白基因转入细胞进行同源重组[75],然后通过CRISPR/Cas系统进行反向选择除去未发生突变的野生株[76-78],目前常见于T家族噬菌体的改造[79]。Mahichi等[80]通过交换噬菌体T2与IP008的gp37和gp38,成功地使改造后的T2噬菌体在保留了其优秀的裂解活性的同明获得了与噬菌体IP008一样的宿主范围。孙魁丽[81]将T4-like噬菌体WG01的gp37替换为噬菌体QL01对应部分,得到的改造噬菌体WGce能够裂解养殖环境中多种血清型沙门氏菌及大肠杆菌。Lin Tiaoyin等[82]将T3噬菌体的一部分受体结合蛋白基因替换为T7噬菌体的基因,经测试改造后的噬菌体获得了更宽的宿主谱与更好的裂解能力(图2C)。
由于TFPs末端环的序列组成直接负责特异性结合,Yehl等[83]最近提出可以进一步通过定点突变技术直接对噬菌体暴露的远端环进行改造来改变宿主谱,此方法在扩大宿主谱的同明可有效针对抗噬菌体菌株,由于目前对噬菌体识别机制认知不足的限制,该方法尚不成熟,但具有良好的发展前景。
2.3.2 插入外源基因间接扩大宿主谱
噬菌体的受体结合蛋白并非限制噬菌体宿主范围的唯一因素。最新研究表明,细菌体内的特异性防御机制同样可以调控噬菌体的裂解能力,例如修饰限制系统R-M type I,基于DNA磷酸化的防御系统Dnd等。细菌体内的防御机制具有高度多样性,其主要位于可移动的遗传元件上,并且在单个基因组内经常存在多种防御机制。一些噬菌体在此影响下完成初步吸附后无法进行后续侵染过程,仅能对细菌的部分结构造成损伤且后续无法检出活噬菌体,通过表观遗传和基因组修饰能够帮助噬菌体适应细菌防御并改变宿主范围[84-85]。在最近的研究中,Piel等[86]通过基因比对及敲除的方法确定了对Dnd系统产生抗性的基因并将其整合至原本不敏感的菌株中,成功扩大了噬菌体的裂解范围。
另一种增强裂解能力的方法是直接将毒力基因插入噬菌体基因组中。Hagens等[87]将λS105和Bgl II两种毒力基因插入大肠杆菌噬菌体M13中,其中λS105可以损伤细菌的膜结构[88],Bgl II可以对细菌DNA造成不可逆的破坏。经检测,改造后的噬菌体可以杀灭养殖环境中99%的大肠杆菌,且由于这些基因本身不会引起细胞裂解,内毒素的检出量显著降低。细菌生物膜由蛋白质、DNA与胞外多糖组成,能够极大加强细菌的抗逆性,一定程度上阻止噬菌体与细菌的接触从而降低噬菌体的感染能力。Lu等[61]将生物膜降解酶DspB基因整合至T7噬菌体中,使得改造后的噬菌体可除去99%的生物膜,杀菌效果提升了两个数量级,解决了噬菌体抗性细菌的问题,为噬菌体宿主范围扩展提供了新思路(图2D)。
插入外源基因的目的一般是为了加强噬菌体本身对细菌的裂解能力及改善噬菌体的反应环境,在噬菌体宿主谱扩展能力上相比对尾部结构进行直接改造略显不足。由于噬菌体衣壳蛋白的存在极大限制了基因组大小的改变,可插入的外源基因比较有限,因此多与抗菌药物及其他化学药物联合使用。
经过数十年的探索,非定向噬菌体宿主谱扩展技术如今已经相对完善,许多国外生物公司已经运用此项技术工业化生产优质宽谱噬菌体以用于食品领域噬菌体抑菌剂的研发和噬菌体“鸡尾酒”的更新,我国由于目前尚未设立噬菌体作为食品添加剂及生物防治剂的相关标准,噬菌体抑菌剂的发展还处于起步阶段。相比非定向培育方法,基因改造定向扩展噬菌体宿主谱在安全性及遗传稳定性方面更方便更有优势,针对食品原料养殖和即食食品杀菌的需求生产所需要的特定噬菌体,更加符合未来食品行业的发展需求,具有良好的发展前景。
3 结语
综上所述,噬菌体作为自然界最丰富的物种之一,人们对其认知还有很多不足。虽然目前噬菌体在食品领域的可接受程度还相对较低,但随着食品行业的快速发展与科技水平的进步,噬菌体必将成为控制食源性致病菌的优秀替代品之一。近年来对噬菌体的结构功能及作用机制的研究使人工改造噬菌体技术获得了重大突破,但还需进一步丰富噬菌体基因库来确保噬菌体在食品领域中应用的安全性与稳定性,加强基因工程噬菌体的研发,并推动噬菌体的基础研究走向食品工业化应用将会是未来研究的趋势与热点。
