健胃消食口服液的免疫调节作用及网络药理学机制研究△
2024-01-03张艳赵海誉侯红平王琳娜姜珊周严严司南王宏洁王坤王丽芳倪理琪魏晓露
张艳,赵海誉,侯红平,王琳娜,姜珊,周严严,司南,王宏洁,王坤,王丽芳,倪理琪*,魏晓露*
1.中国中医科学院 中药研究所,北京 100700;2.济川药业集团有限公司,江苏 泰兴 225441
健胃消食口服液由太子参、陈皮、山药、炒麦芽及山楂5 味中药组成,主要用于脾胃虚弱所致的食积,临床见多种原因引起的消化不良、小儿厌食症、胃炎等,是国内目前治疗消化不良的常用药物[1]。目前对健胃消食口服液的研究主要集中在质量标准[2-3],以及单独或联合用药治疗小儿脾胃气虚证引发的厌食、儿童或老年人功能性消化不良、慢性胃炎的临床效果观察研究方面[4-9]。本方中太子参、山药、山楂、陈皮和炒麦芽均具有健脾益气的功效。脾虚证的主要特点是脾胃机能不足、升降出入功能失衡,临床表现有消化系统、免疫系统等功能的减退。已有研究报道,与健胃消食口服液相同成分的健胃消食片具有抗应激、提高免疫功能和助消化作用,可增强胃动力、改善胃分泌功能、提高胃蛋白酶活性、提高免疫力等[10-11]。但是健胃消食口服液相关的治疗机制鲜有报道。本研究制备免疫抑制小鼠模型,探讨健胃消食口服液对免疫功能的调节作用,同时结合网络药理学方法探讨健胃消食口服液健胃消食的作用机制,以期为健胃消食口服液的临床应用和后续研究提供参考。
1 材料
1.1 动物
无特定病原体(SPF)级雄性BALB/c 小鼠,体质量(20±2)g,购自北京维通利华实验动物技术有限公司,动物生产许可证号:SCXK(京)2021-0006,饲养于中国中医科学院中药研究所实验动物中心,室温保持21~25 ℃,相对湿度45%~55%,自然昼夜节律光照,自由饮水进食。本实验操作过程严格遵守实验动物伦理标准,SPF 级动物实验伦理审查表编号:2022B073。
1.2 试药
健胃消食口服液(济川药业集团有限公司,批号:2112225);注射用胸腺五肽(北京双鹭药业股份有限公司,批号:20211205);注射用环磷酰胺(山西普德药业有限公司,批号:04210703)。
刀豆蛋白A(ConA,美国Sigma 公司,批号:SLCF6611);CCK-8试剂 [北仁化学科技(北京)有限公司,批号:TR688];含双抗的RPMI 1640 细胞培养液(批号:20220410)、红细胞裂解液(批号:20211227)均购自Solarbio 生物科技有限公司;胎牛血清(ExCell Bio 公司,批号:12J040);5%绵羊红细胞(SRBC,北京源叶生物科技有限公司,批号:J10HH1184419);豚鼠血清(北京博奥拓达科技有限公司,批号:2022/06);多甲藻黄素-叶绿素-蛋白复合物(PerCP)荧光-花菁染料(Cy)5.5 偶联抗小鼠抗原CD3e抗体、藻蓝蛋白(APC)偶联抗小鼠CD4 抗体、荧光素5-异硫氰酸酯(FITC)偶联抗小鼠CD8a 抗体(BD Biosciences Pharmingen 公司,批号分别为1141679、1113645、1327295);烟酰胺腺嘌呤二核苷酸(NAD,纯度≥98%,批号:CCHM701184)、柠檬酸(纯度≥99%,批号:BW1746)、还原型烟酰胺腺嘌呤二核苷酸(NADH,纯度≥98%,批号:SH-N201487)、腺嘌呤核苷三磷酸(ATP,纯度≥98%,批号:GC35420-100)、顺乌头酸(纯度≥98%,批号:CCFD200673)、琥珀酸(纯度≥98%,批号:BW1754)、α-酮戊二酸(纯度≥98%,批号:BW2515)、乳酸(纯度≥90%,批号:BW1772a)、无水葡萄糖(纯度≥98%,批号:CCHM700477)、二磷酸腺苷(ADP,纯度≥98%,批号:CCAD301420)、单磷酸腺苷(AMP,纯度≥98%,批号:CCFD200371)均购于北京万佳标准物质研发中心。
1.3 仪器
MCO-5AC 型CO2细胞培养箱(日本Sanyo 公司);VT-840K 型超净工作台(江苏苏净集团有限公司);16-K 型高速台式低温离心机(美国Sigma公司);SB-1100 型恒温水浴锅(上海爱朗仪器有限公司);H1 型全自动酶标检测仪(美国博伯腾仪器有限公司);CytoFLEX 型流式细胞仪(美国Beckman Coulter 公司);Triple Quad™ 6500+LC-MS/MS 系统(美国AB Sciex 公司),包括Exion LC-20AC 型高效液相色谱仪、Ion Drive™ TurboV 型离子源、Sciex 6500 型三重四极杆检测器、Analyst 1.7 数据采集系统和MutiQuant 3.0.3 数据处理系统;JA503-DuaIRange 型十万分之一电子天平(上海舜字恒平科学仪器有限公司);Heraeus MuLtifuge X1R 型高速离心机(美国Thermo Fisher公司);MS3 digital 型涡旋仪(德国IKA 公司);Scientz-48L 型高通量组织研磨器(宁波新芝生物科技股份有限公司)。
2 方法
2.1 动物实验
2.1.1 动物分组、模型制备与给药 将60 只SPF级BALB/c 雄性小鼠于环境适应性饲养4 d 后,按照体质量随机分为对照组,模型组,阳性药物(胸腺五肽,1.5 mg·kg-1)组,健胃消食口服液低、中、高剂量(0.620、1.240、2.480 g·kg-1)组,每组10只。对照组小鼠连续3 d 腹腔注射0.9%氯化钠溶液,其他6组小鼠连续3 d腹腔注射环磷酰胺(10 mg·kg-1),制备免疫抑制模型。于第4 天开始给药,给药剂量按照动物与人体每千克体质量剂量折算系数计算所得,对照组和模型组小鼠灌胃给予等体积0.9%氯化钠溶液,每天1 次。连续给药15 d,期间每隔2 d 记录体质量,于第15 天称质量,给药后1 h 对小鼠进行托颈处死,于无菌条件下取出小鼠胸腺、脾脏称定质量,计算脾体比(脾脏质量/体质量)和胸腺体比(胸腺质量/体质量)。
2.1.2 药物对脾淋巴细胞增殖作用的研究 将无菌条件下取出的小鼠脾脏制备成脾细胞悬液。取部分用含10%胎牛血清的RPMI 1640 完全培养基混悬调整细胞浓度为5×106个/mL,分2 孔加入96 孔培养板,每孔90 μL,其中1 孔加入ConA 液(使终质量浓度为5 μg·mL-1)10 μL,另一孔加入RPMI 1640培养基10 μL 作为对照,使每孔总体积为100 μL。每个样品设置3 个复孔。每个培养板设置1 个只加RPMI 1640完全培养液的空白对照孔。置于5% CO2、37 ℃培养箱中培养48 h。培养结束前4 h,每孔加入CCK-8 10 μL。用酶标仪测定450 nm 波长下的吸光度(A),按照公式(1)计算增殖刺激指数(SI)。
2.1.3 药物对T 淋巴细胞亚群的作用研究 取适量小鼠脾细胞悬液加入磷酸盐缓冲液(PBS)10 mL混悬洗涤2 次。调整细胞浓度为1×106个/mL,取1 mL加入离心管中,避光依次加入CD3e、CD4 和CD8a抗体,于4 ℃避光冰浴30 min 封闭。1500 r·min-1离心5 min(离心半径为9.8 cm)弃上清液后加入PBS 5 mL 洗涤1 次,离心弃上清液,加入PBS 1 mL混悬后用流式细胞仪进行检测。
2.1.4 药物对B 细胞抗体生成作用的研究 在免疫抑制模型小鼠连续给药的第7 天末次给药后,尾静脉注射5% SRBC 悬液0.2 mL 进行致敏,连续给药7 d后停药,于停药次日,脱颈处死小鼠,解剖小鼠取脾,制备脾细胞悬液,用冷PBS 调节脾细胞浓度为1×107个/mL 的细胞悬液。取脾细胞悬液1 mL、0.2% SRBC 1 mL、1∶10 稀释补体1 mL 充分混匀,同时加设不加补体的空白对照管,每组设置3 个复孔,置 于37 ℃水 浴60 min 后,3000 r·min-1离 心5 min(离心半径为9.8 cm),取上清液,用酶标仪测定每个孔A,即为各组药物的B细胞抗体生成量。
2.1.5 统计学方法 所有结果以()表示,采用SPSS 13.0 软件进行单因素方差分析(One-way ANOVA),比较各实验组与对照组的差异。对非正态或方差不齐的数据进行适当的变量转换,满足正态性或方差齐性要求后,用转换后的数据进行统计。若变量转换后仍未达到正态或方差齐的目的,改用秩和检验进行统计。
2.2 网络药理学研究
2.2.1 化合物作用靶点获取 利用中医药整合药理学研究平台(TCMIP,http://www.tcmip.cn/)[12]中药材数据库、中药方剂数据库,搜集收载的太子参、陈皮、山药、山楂、麦芽中相关化学成分靶点,成分以“ADMET Absorption Level”水平在中等及以上,或“Druglikeness Grading”在moderate 及以上进行筛选。同时结合文献,对报道有生物活性和药理作用的,虽然不符合筛选标准的成分依然纳入研究。靶点以Tanimoto Score≥0.8进行筛选。
2.2.2 疾病靶点获取 在疾病数据库中以健胃消食口服液相应的临床症状“Gastritis”“Anorexia”为关键词进行疾病靶点的搜索。考虑TCMIP 平台疾病靶点主要来自HPO、DisGeNET 及OMIM 数据库。为防止靶点的遗漏,以相同关键词在GeneCards 数据库(http://www.genecards.org/)筛选疾病对应的靶点信息,合并删除重复项作为健胃消食的作用靶点。
2.2.3 交集基因的获取 利用微生信平台(http://www.bioinformatics.com.cn/)将健胃消食口服液与疾病相关的作用靶点取交集,获取不同成分的交集基因,并根据各个药物作用靶点的差异性进行分析。
2.2.4 蛋白质-蛋白质相互作用(PPI)分析 将交集靶基因输入String 数据库(https://string-db.org/)构建PPI 网络,限定物种为“Homo sanpiens”,隐藏游离节点,medium confidence(0.07)处理后,得到PPI网络图,下载.tsv格式文件导入Cytoscape 3.8.2中,利用CytoNCA 插件筛选核心靶点,并进行差异性分析。
2.2.5 靶点作用通路京都基因与基因组百科全书(KEGG)和基因本体(GO)分析 利用欧易生物云平台(https://www.majorbio.com/)核心靶点进行GO及KEGG富集分析,选择“homo sapiens”,设置P为0.01,其中GO 功能分析包括生物过程(BP)、分子功能(MF)和细胞组成(CC)。
2.3 基于三羧酸(TCA)循环通路的机制探讨
取各对照品适量进行精密称定,加入50%甲醇超声溶解并定容至刻度线,待用。
精确称量各组小鼠脾脏组织,加入等量0.9%氯化钠溶液,适量钢珠,使用高通量组织研磨器研磨1 min 后加入等量乙腈(0.2%甲酸)匀浆2 min,4000 r·min-1离心5 min(离心半径为9.8 cm),取上清液100 µL,加入乙腈200 µL,涡旋混匀3 min,12 000 r·min-1离心15 min(离心半径为9.8 cm),取上清液,待检。色谱、质谱分析条件参见文献[13]。
3 结果
3.1 动物实验结果
3.1.1 药物对小鼠表观指标及体质量的影响 连续给小鼠注射环磷酰胺3 d后,对照组小鼠精神状态良好,皮毛顺滑、活动敏捷、动作协调、饮食饮水及活动表现均正常,对外界刺激反应敏捷。模型组小鼠出现进食、饮水减少,体质量减轻,活动减少,反应迟钝,蜷缩弓背,毛松等免疫低下体征,表明小鼠免疫抑制模型制备成功。小鼠体质量变化见图1,模型组小鼠体质量持续下降,而给药组小鼠从给药后第4 天开始体质量相继出现不同程度的恢复,其中健胃消食口服液中、高剂量组小鼠体质量与对照组水平接近,给药组小鼠的饮食减少、反应迟钝、蜷缩弓背情况也均有不同程度的改善。

图1 健胃消食口服液对小鼠体质量的影响(,n=10)
3.1.2 药物对小鼠脾指数和胸腺指数的影响 健胃消食口服液对免疫低下小鼠脾体比和胸腺体比的影响见表1。模型组小鼠脾体比和胸腺体比较对照组显著降低,证明免疫抑制模型制备成功。与模型组比较,胸腺五肽组小鼠脾体比和胸腺体比显著升高,健胃消食口服液各给药组小鼠脾脏体比和胸腺脏体比均有不同程度升高,提示健胃消食口服液可提高动物免疫器官功能水平。
表1 健胃消食口服液对小鼠脾体比和胸腺体比的影响(,n=10)

表1 健胃消食口服液对小鼠脾体比和胸腺体比的影响(,n=10)
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05,##P<0.01;表2同。
3.1.3 药物对小鼠免疫功能的影响 健胃消食口服液对免疫低下小鼠的脾淋巴细胞转化能力和B细胞抗体生成能力的影响见表2。与对照组比较,模型组小鼠脾淋巴细胞的转化能力和B 细胞抗体生成能力均显著降低,证明免疫抑制模型制备成功。与模型组比较,胸腺五肽组和健胃消食口服液低、中、高剂量组小鼠脾淋巴细胞的转化能力和B 细胞抗体生成能力均不同程度地升高,证明健胃消食口服液可提高小鼠细胞免疫和体液免疫能力。
表2 健胃消食口服液对小鼠免疫功能调节的影响(,n=10)
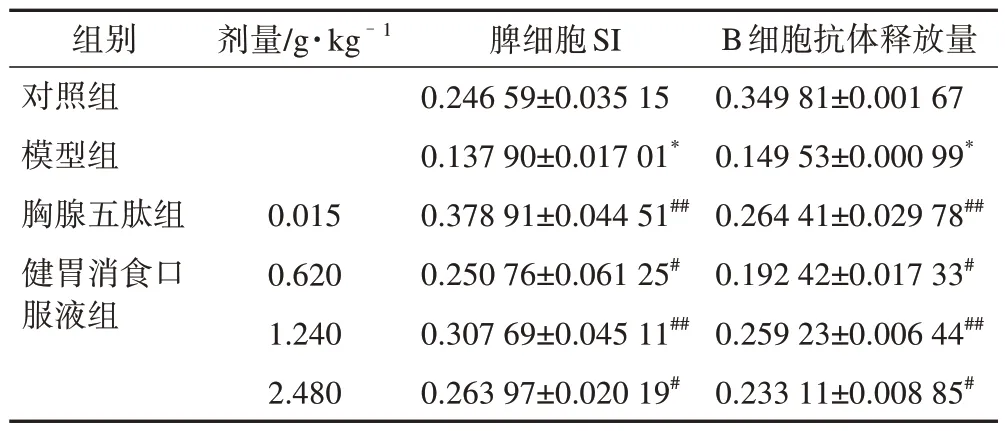
表2 健胃消食口服液对小鼠免疫功能调节的影响(,n=10)
3.1.4 药物对T 淋巴细胞亚群的影响 健胃消食口服液对免疫低下小鼠脾淋巴细胞中CD4+、CD8+、CD4+/CD8+的影响结果见表3。设CD3+作为门类检测基数,通过荧光比值获得CD4+和CD8+的相对数值,结果发现模型组的CD4+、CD8+和CD4+/CD8+的值均低于对照组(P<0.01)。与模型组比较,胸腺五肽阳性药和健胃消食口服液低、中、高剂量组均有不用程度的提高(P<0.05,P<0.01),其中健胃消食口服液低、中剂量组的CD4+值显著提高(P<0.01),中剂量组CD8+值显著提高(P<0.01),高低剂量组CD4+/CD8+值显著提高(P<0.01)。
表3 健胃消食口服液对T淋巴细胞亚群的作用(,n=10)
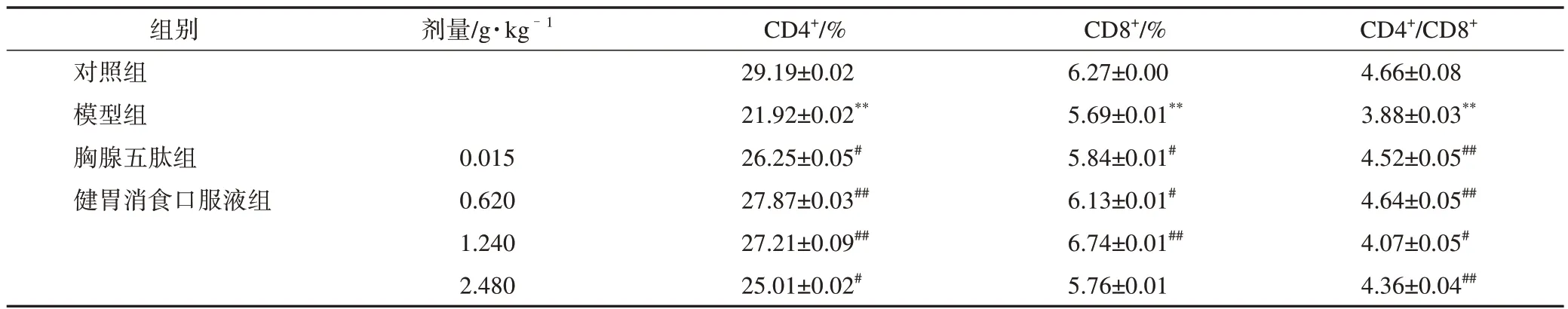
表3 健胃消食口服液对T淋巴细胞亚群的作用(,n=10)
注:与对照组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
3.2 网络药理学实验结果
3.2.1 成分靶点信息整合 通过数据库搜索与文献补充[14],收集太子参化学成分9 个、陈皮化学成分50 个、山药化学成分34 个、麦芽化学成分9 个、山楂化学成分27 个,经筛选共收集成分靶点2552 个,最终删除重复值得到靶点650 个,提示各成分之间共性靶点较多,各成分之间可能存在潜在的叠加作用。化合物见表4。

表4 健胃消食口服液中各中药成分
3.2.2 疾病相关靶点的获取 饮食积滞临床常见厌食、胃炎等病症。以“Gastritis”与“Anorexia”为关键词,在GeneCards 数据库分别获得靶点3739、2470 个,根据Relevance score 参数进行筛选,最终得到1490个靶点,结合TCMIP疾病数据库结果,去除重复值,最终得到1512个疾病靶点。
3.2.3 健胃消食口服液、疾病作用靶点差异分析 将成分靶点信息与疾病靶点基因在微生信平台取交集,绘制韦恩图,见图2。通过取交集靶点,共获得了健胃消食口服液与疾病相关作用靶点149个,与消食相关作用靶点94个,与胃炎作用靶点78个,三者共同靶点23 个。将交集基因导入String 11.0 平台,隐藏游离节点,以.tsv 格式导入Cytoscape 3.8.2软件,构建PPI网络图,见图3。

图2 健胃消食口服液-疾病作用靶点韦恩图
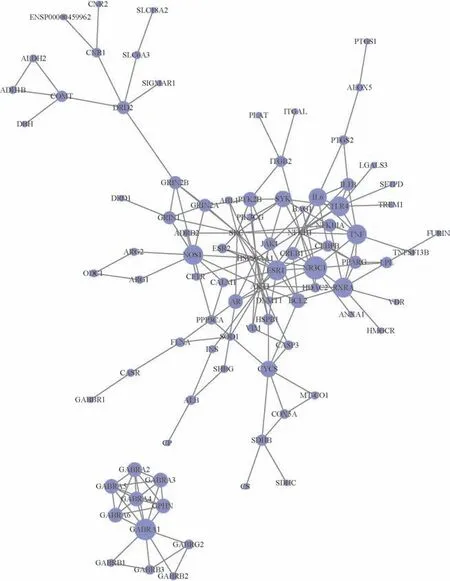
图3 健胃消食口服液-疾病作用靶点PPI网络
3.2.4 核心靶点的功能与通路的分析 为确定健胃消食口服液的核心作用靶点,结合CytoNCA 插件以度(degree)值进行排序筛选了56 个核心靶点。对核心靶点进行KEGG 及GO 功能分析(P<0.01),结果见图4、图5。
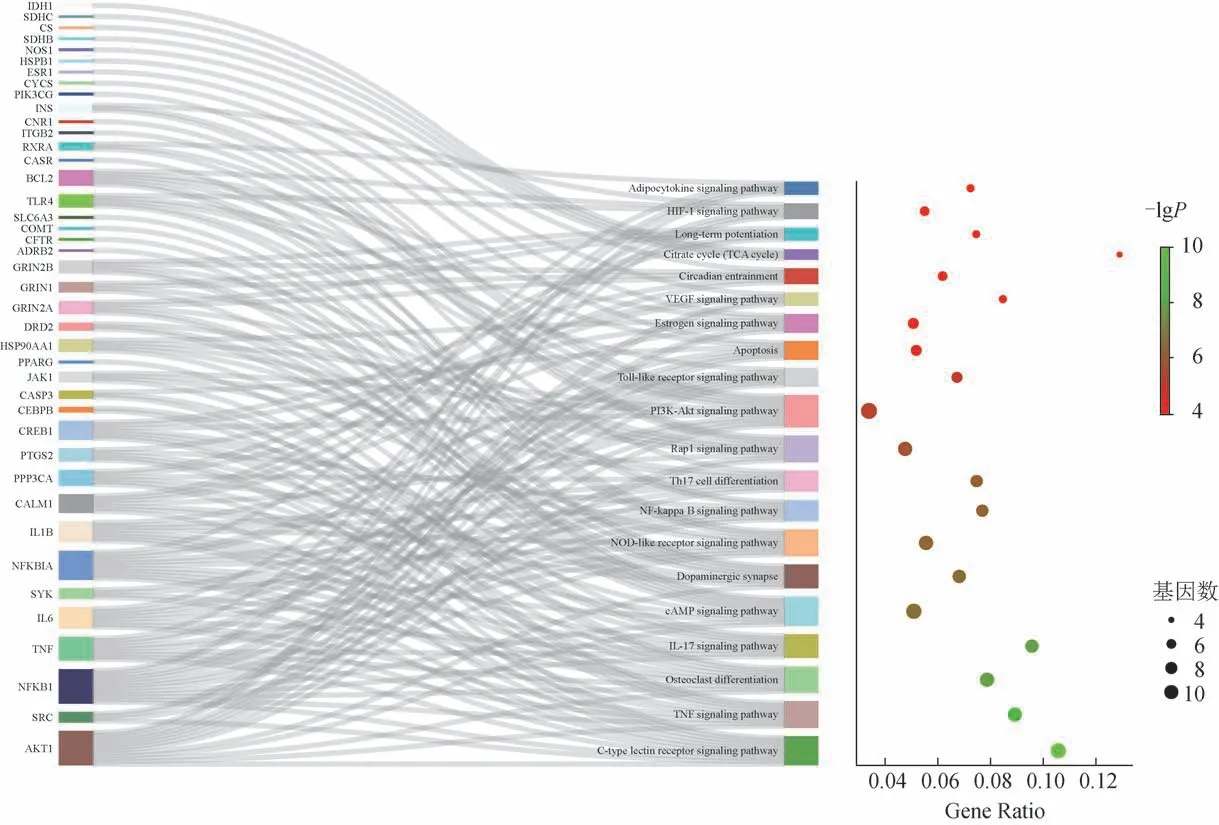
图4 健胃消食口服液-疾病KEGG富集分析

图5 健胃消食口服液-疾病靶点GO功能富集
根据KEGG 分析结果显示,健胃消食口服液主要作用于生物体系统分类下的免疫系统 [C 型凝集素受体信号通路、白细胞介素-17(IL-17)信号通路、辅助性T 细胞17(Th17)细胞分化、Toll 样受体信号转导]、环境信息处理分类下的信号传导(肿瘤坏死因子信号通路、环腺苷3',5'-单磷酸信号通路、核转录因子-κB 信号通路、磷脂酰肌醇3-激酶/蛋白激酶B 信号通路、血管内皮生长因子信号通路)及新陈代谢分类下的糖代谢(TCA 循环)。同时,TCA 循环也是前20的KEGG 条目中唯一显著富集在metabolism 的代谢通路,这为后续的机制研究带来新的提示。
BP 富集分析提示,健胃消食口服液主要通过干预发热的正调控、细胞因子介导的信号通路、一氧化氮生物合成过程的正调控及凋亡过程的负调控等过程发挥相应作用。CC 及MF 富集分析表明,健胃消食口服液靶点的产物主要在线粒体、膜筏及突触等部位通过影响淀粉样蛋白β结合、N-甲基-D-天冬氨酸受体NMDA 谷氨酸受体活性、非跨膜蛋白酪氨酸激酶活性等发挥作用,见图5。
3.3 药物对TCA循环的影响
健胃消食口服液对免疫低下小鼠TCA 循环影响见表5。在造模的过程中琥珀酸、ADP、乌头酸、柠檬酸、丙酮酸的含量均呈现了上升趋势,而在灌胃给予健胃消食口服液后,琥珀酸、乌头酸、柠檬酸、丙酮酸含量降低,其中ADP 只在低剂量给药后呈现下降趋势。
表5 健胃消食口服液对TCA循环代谢的影响(,n=4)
注:与对照组比较,*P<0.05;与模型组比较,##P<0.01,###P<0.001。
4 讨论
健胃消食口服液具有益气健脾、消食导滞的功效。研究表明,太子参能促进淋巴细胞增殖、提高免疫功能,明显改善大黄所致脾虚型小鼠小肠功能紊乱的症状[15]。陈皮所含挥发油有利于分泌消化液,促进肠道积气消散,增强食欲;橙皮苷能抑制溃疡,可利胆和调节肠胃[16]。山药作为我国传统药食同源食物之一,主要含有多糖、氨基酸、脂肪酸、山药素类化合物、微量元素、淀粉、蛋白质等化学成分。研究表明,山药多糖可有效抑制小鼠体内肿瘤生长,具有显著免疫调节效用[17],对环磷酰胺所致小鼠肝脾损伤有良好保护作用[18]。山药蛋白肽还可以通过激活和保护免疫系统中的免疫器官、细胞和活性物质发挥免疫调节作用,进而增强机体的免疫防御能力[19]。麦芽主要含有多糖类、生物碱类等化学成分。对麦芽的研究热点集中在其助消化、回乳、抗结肠炎及抗氧化的活性[20]。山楂是原卫生部批准的药食两用药材之一,主要含有总黄酮、有机酸、三萜酸和原花青素等化学成分。研究表明山楂黄酮对小鼠脾淋巴细胞具有显著的免疫调节作用[21]。山楂提取物对小鼠胃平滑肌具有双向调节作用,可调节肠道功能紊乱,起到健胃消食的作用[22]。因此结合上述5味中药,可起到补而不滞、通而不峻、不热不燥的功效[23]。
脾脏和胸腺的发育状况与机体免疫功能密切相关,脾脏指数和胸腺指数能客观反映免疫器官的功能状况,是机体非特异性免疫的一个方面[24]。本研究结果显示,健胃消食口服液与模型组相比可增加免疫低下小鼠的脾体比和胸腺体比,其中中剂量组的作用效果最明显,说明健胃消食口服液可提高动物免疫器官的功能水平。结合网络药理学研究,对成分-疾病核心靶点进行KEGG 富集分析,发现前10位的条目中有4 条属于免疫系统,进一步提示健胃消食口服液可能是通过影响免疫系统来发挥相应作用。
研究表明,机体在参与免疫应答过程中会释放出多种TCA 循环代谢中间产物[25]。根据文献报道,每个阶段的T 细胞,甚至是不同的T 细胞相似阶段的亚群均可表现出独特的代谢特征,如幼稚 T 细胞以静止状态避免非特异性或过度免疫反应[26]。因此,细胞内代谢在很大程度上依赖于TCA 循环,见图6。激活后,T细胞迅速增殖,进一步分化成辅助T淋巴细胞即CD4+T 细胞和细胞毒性T 淋巴细胞即CD8+T细胞,两者比值(CD4+/CD8+)反映T淋巴细胞的生物活性,比值上升,说明免疫功能增强,相反则说明免疫功能低下。本研究通过流式细胞仪检测健胃消食口服液对T 淋巴细胞亚群增殖的影响,结果显示,与模型组相比,健胃消食口服液可提高免疫抑制小鼠的CD4+、CD8+T 淋巴细胞数量及两者比值(CD4+/CD8+),但不存在剂量依赖关系,且低于对照组小鼠,说明健胃消食口服液发挥免疫活性的方式并不完全是直接激活T 淋巴细胞。B 细胞在抗原刺激及Th 细胞辅助下被激活,经过细胞增殖、抗原选择、免疫球蛋白类型转换和细胞表面某些标志的改变、细胞体突变,最终分化为能产生抗体的浆细胞。因此B 细胞抗体形成细胞数量的多少反映机体体液免疫的状态。与模型组相比,给予健胃消食口服液后抗体释放量均有不同程度升高,中剂量组的效果较为明显,说明健胃消食口服液可一定程度提高小鼠体液免疫能力。
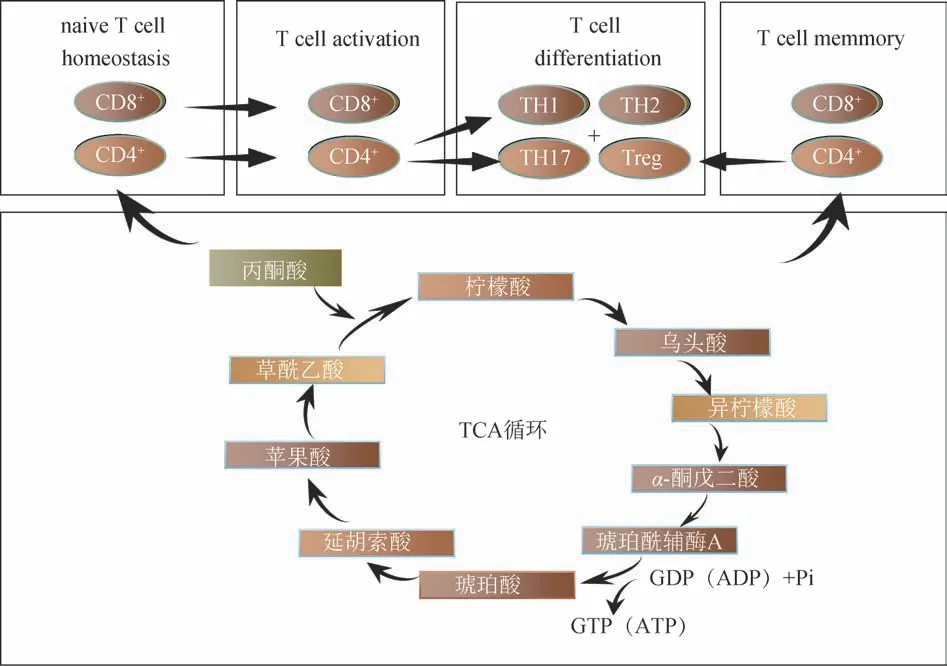
图6 三羧酸循环代谢与细胞免疫关联网络
网络药理学富集结果也发现,琥珀酸脱氢酶复合体B 亚基(SDHB)、柠檬酸合酶(CS)、琥珀酸脱氢酶复合体C 亚基(SDHC)、异柠檬酸脱氢酶1(IDH1)等靶点在TCA 循环通路显著富集。TCA 循环是前20的KEGG条目中唯一显著富集在metabolism的代谢通路,提示TCA 通路的改变与健胃消食口服液的免疫作用机制息息相关。在造模的过程中琥珀酸、ADP、乌头酸、柠檬酸、丙酮酸的含量均呈现了上升趋势。琥珀酸被认为是一种先天免疫信号代谢物,可作为代谢紊乱的生物标志物。造模过程中过量的琥珀酸会增加线粒体膜电位,促进IL-1β的生成,造成机体炎症反应。顺乌头酸可促进柠檬酸转化成异柠檬酸,柠檬酸作为TCA 循环的中间代谢产物之一,含量累积,代谢加快。因此,推测健胃消食口服液可能通过降低代谢产物的积累,缓解异常能量代谢从而影响细胞免疫代谢功能。
综上所述,本研究通过注射环磷酰胺制备免疫抑制小鼠模型,结合网络药理学及体外实验,评估健胃消食口服液对T 淋巴细胞亚群的变化提示其免疫调节作用的多元性,并结合代谢组学的方法,研究TCA 循环相关代谢产物与免疫功能的相关性,为后续健胃消食口服液的作用机制研究提供借鉴。
