桃PpILR1基因调控分枝角度的功能解析
2024-01-01张杰沈芮先裴弯谢贺芳王小贝郑先波连晓东张海朋谭彬冯建灿
张杰, 沈芮先, 裴弯, 谢贺芳, 王小贝, 郑先波, 连晓东,张海朋, 谭彬, 冯建灿
(1.河南农业大学园艺学院,河南 郑州 450046; 2.河南省桃种质资源创新及利用工程技术研究中心,河南 郑州 450046)
桃(PrunuspersicaL.)原产于中国,种质资源丰富,是世界上重要的栽培果树之一。由分枝角度、节间长度、分枝数量等的差异形成了不同的树型,桃树型主要分为普通型、柱型、垂枝型、直立型、矮化型、半矮化型和曲枝型等[1-2]。目前,桃生产中的主栽品种为普通型,其分枝角度大、分枝数量多等特点不仅增加了劳动力成本的投入,还严重影响果实产量和品质。因此,优化树体结构,培育适宜于省力化栽培的优良桃品种是解决桃产业发展瓶颈问题的关键。柱型桃是一类特异的桃种质,与普通型桃相比,其具有分枝角度小、二级分枝数量少等特点[3];分枝角度是影响果树树型的重要因素之一。植物分枝角度的形成受遗传因素、环境因素和植物激素等的共同调控[4-5]。生长素是调控植物顶端优势的重要激素[6-7]。外源喷施生长素能显著影响分枝的形成[8]。生长素含量的极性分布对植物分枝角度的形成具有重要调控作用[9]。植物中生长素的局部浓度主要受合成、代谢和运输的影响,其中结合态生长素和游离态生长素的动态平衡对植物局部生长素含量至关重要[10]。生长素酰胺水解酶(IAA-leucine resistant1-like hydrolase,ILR1-like hydrolase,ILL)基因所编码的酶能催化氨基酸结合态生长素转化为游离态生长素[11]。生长素酰胺水解酶基因最早在拟南芥中分离得到[12],拟南芥中共有7个ILL基因,IAA-Leu 和 IAA-Phe为AtILR1基因的主要作用底物,IAA-Ala为基因AtIAR3和AtILL2的主要作用底物[13]。桃中共鉴定到9个ILL基因,且PpILR1可能参与调控桃果实成熟[14],但桃ILL基因对树型形成相关因素的影响至今鲜有报道。
生长素在植物整个生长发育过程中发挥重要的调控作用,包括植物器官形成、顶端优势保持、分枝角度形成等过程[15-16]。生长素响应因子(auxin response factor, ARF)是生长素下游的发挥重要调控作用的转录因子,在生长素信号转导过程中具有核心调控作用[17]。ARF转录因子可与生长素响应元件TGTCNN特异性结合,进而调控生长素下游基因的表达[18]。水稻OsARF19转录因子结合在OsGH3-5基因启动子上并促进其表达,以减少游离态生长素含量,最终使水稻叶角显著增加[19]。水稻OsARF12、OsARF17和OsARF25基因通过调节生长素的再分布进而调控水稻分蘖角度的形成[20]。目前,随着基因组序列的释放,ARF基因已经在多种植物中分离鉴定。其中拟南芥中共鉴定到22个ARF基因[21],番茄中共鉴定到22个ARF基因[22],水稻中鉴定到25个ARF基因[23],甜橙中鉴定到19个ARF基因[24],香蕉中鉴定到47个ARF基因[25],在桃中共分离鉴定17个ARF基因,并且这些ARF基因广泛参与桃果实的生长发育[26]。然而,ARF基因是否参与调控桃树型的形成目前仍不清楚。
本研究以分枝角度小的柱型桃‘洒红龙柱’为试验材料,克隆桃基因生长素酰胺水解酶基因PpILR1的CDS区域,构建过表达载体稳定转化micro-Tom番茄验证PpILR1基因功能;同时通过转录组分析筛选到响应NAA处理的基因PpARF4和PpARF8A,并通过酵母单杂交和双荧光素酶试验验证转录因子PpARF4和PpARF8A对PpILR1基因启动子的调控关系,研究结果可为桃树型遗传改良工作提供理论依据。
1 材料与方法
1.1 试验材料
本试验所用材料柱型桃‘洒红龙柱’定植于河南农业大学毛庄科教园区。
用于双荧光素酶试验的本氏烟草(Nicotianabenthamiana)和基因功能验证的micro-Tom番茄均为河南农业大学桃生物学与种质创新团队保存。
1.2 试验方法
1.2.1 桃PpILR1、PpARF4和PpARF8A基因克隆 使用植物总RNA提取试剂盒(B518631-0100,上海生工)提取‘洒红龙柱’桃叶片RNA,并用 PrimeScriptTMRT reagent Kit with gDNA Eraser(RR047B9(A×4),Takara)试剂盒将桃总RNA反转录为cDNA。以桃PpILR1基因(Prupe.7G100000)的编码序列为模板,用Primer premier 5.0软件设计PpILR1基因特异性引物(表1)扩增其CDS序列。PCR反应体系为:cDNA1 μL(200 mg·L-1),高保真酶10 μL,上游引物1 μL,下游引物1 μL,ddH2O补足至20 μL,PCR反应程序为:预变性98 ℃,30 s;变性98 ℃,10 s;退火55 ℃,5 s,延伸72 ℃,15 s;终延伸72 ℃,60 s,35个循环。PCR扩增产物琼脂糖电泳之后用FastPure Gel DNA Extraction Mini Kit(DC301-01,南京诺唯赞)试剂盒进行切胶回收,纯化产物连接平末端载体 pEASY®-BluntVector(CB101-01,北京全式金)并转化DH5α大肠杆菌感受态,置于37 ℃培养箱中培养,PCR验证阳性的单克隆送至北京擎科生物技术有限公司测序。基因PpARF4(Prupe.6G097700)和PpARF8A(Prupe.3G182900)的编码序列扩增方法如PpILR1,引物序列参照表1。

表1 PpILR1基因克隆、调控、表达和功能分析所用引物
1.2.2 桃PpILR1基因过表达载体的构建 以构建成功的PpILR1平末端载体为模板,利用PpILR1-SAK同源臂引物(表1)扩增CDS序列,PCR扩增体系和程序如1.2.1。提取过表达空载体pSAK-277,并用限制性内切酶KPNⅠ和XhoⅠ进行双酶切。酶切反应体系为:载体5 μL(200 mg·L-1),内切酶KPNⅠ 1 μL,内切酶XhoⅠ 1 μL,buffer 5 μL,ddH2O 补足至50 μL。酶切产物及PCR产物琼脂糖电泳后用FastPure Gel DNA Extraction Mini Kit (DC301-01,南京诺唯赞)试剂盒切胶回收,纯化后的产物用于同源重组构建PpILR1基因的过表达载体。同源重组体系:pSAK-277载体PCR纯化产物 2 μL,同源臂引物扩增的目的基因 1 μL,重组酶2 μL, buffer 4 μL,ddH2O 补足至 20 μL,在温度37 ℃条件下重组0.5 h。转化大肠杆菌和阳性检测如1.2.1。将测序正确的过表达载体PpILR1-SAK于-20 ℃条件下保存备用。
1.2.3 桃PpILR1稳定转化番茄及表型分析 番茄稳定转化方法参照SUN等[27]的方法。将构建成功的PpILR1-SAK过表达载体转化为农杆菌GV3101,鉴定阳性后接种至培养基中过夜培养,随后用MS培养基重悬菌液并调整菌液浓度为OD600=0.3~0.5以备后续番茄叶片侵染。选取完全展开的micro-Tom番茄组培苗幼叶,用解剖刀将叶片切割成2~3段,暗培养2 d后用于侵染。将暗培养之后的番茄叶片悬浮在上述农杆菌菌液中,侵染3~4 min。将侵染后的番茄叶片用灭菌水清洗3~5遍,共培养2 d后转移到筛选培养基中进行培养,并提取愈伤上长出的番茄植株DNA进行阳性鉴定。抗性培养基上筛选的番茄移栽21 d后,取番茄叶片并用基因组提取试剂盒(DNE36-02,北京诺贝莱)提取植物DNA,并以其为模板进行PCR扩增验证阳性,PCR扩增体系及程序如1.2.1。番茄叶片RNA提取及反转录参照1.2.1。以获得的cDNA为模板用试剂盒SYBR Select Master Mix(Applied Biosystems,Mardrid,CA,USA)对转基因番茄PpILR1进行表达量分析。使用的仪器为ABI PRISM 7500 FAST Sequence Detection System(Applied Biosystems,Mardrid,CA,USA)。定量PCR体系:SYBR 10 μL,上游引物1 μL,下游引物1 μL,cDNA模板1 μL,ddH2O 7 μL。定量PCR反应程序:50 ℃ 2 min;95 ℃ 2 min;95 ℃ 5 s,60 ℃ 35 s,40个循环。番茄内参基因为Solyc04g011500,采用2-ΔΔCt计算PpILR1基因相对表达量。引物序列详见表1。
T2代转基因番茄及野生型番茄WT移栽温室42 d后,分别选取长势良好且一致的番茄用SC-K1 原位活体植物分枝角自动测量仪系统(杭州万深)统计一级分枝基角角度。设置3个生物学重复,每个重复至少包含3棵番茄苗。
1.2.4 转录组测序及热图分析 2020年4月,选取生长状态一致的多年生‘洒红龙柱’枝条用40 mg·L-1外源NAA整株喷施处理,设置3个重复,每个重复至少含3个枝条,以喷施清水为对照。采集处理组和对照组处理后0、2 h的分枝连接处韧皮部液氮冷冻后送至上海华大基因科技有限公司用于转录组测序。利用测序获得NAA处理组和对照组的 RNA-Seq数据采用 TBtools[28]软件绘制热图。
1.2.5 酵母单杂交试验 依据PAbAi载体多克隆位点,设计包含载体序列的同源臂引物(表1)扩增基因PpILR1的启动子序列(-1.5 kb)。PCR扩增体系和扩增程序如1.2.1。用限制性内切酶Hind Ⅲ和Xho Ⅰ进行双酶切,酶切体系如1.2.2。酶切后产物和PCR扩增产物用试剂盒进行切胶回收,回收后产物用于同源重组,同源重组体系如1.2.2。PpARF4-AD和PpARF8A-AD重组载体构建PAbAi-PpILR1,AD载体的酶切位点为NdeⅠ和XhoⅠ。酵母单杂交试验操作步骤参照A MatchmakerTMGold Yeast One-Hybrid Library Screening System Kit (630491, Clontech, San Francisco, CA, USA)试剂盒说明书。
1.2.6 双荧光素酶试验 双荧光素酶试验方法参照HELLENS等[29]的方法。依据载体pGreen0800-Ⅱ的多克隆位点和PpILR1基因的启动子序列(-1.5 kb),设计同源臂引物(表1)扩增基因PpILR1的启动子序列。pGreen0800-Ⅱ用限制性内切酶KpnⅠ和XhoⅠ进行双酶切,酶切体系如1.2.2。酶切后的PCR产物和PpILR1扩增产物用试剂盒切胶回收之后用于同源重组,同源重组体系如1.2.2。PpARF4-SAK和PpARF8A-SAK重组载体构建过程同pGreen0800-PpILR1,SAK载体酶切位点为KpnⅠ和XhoⅠ。将构建成功的重组质粒pGreen0800-PpILR1、PpARF4-SAK和PpARF8A-SAK分别转化农杆菌GV3101,用农杆菌介导的遗传转化法瞬时转化本氏烟草叶片。将pGreen0800-PpILR1和PpARF4-SAK(或PpARF8A-SAK)调至菌液浓度为OD600=0.6~0.7,室温静止2~3 h后用于侵染烟草叶片,pGreen0800-PpILR1和空载SAK组合为对照组。烟草叶片侵染3 d后用于LUC和REN测定,具体测定方法参照Dual-luciferase assay kit (E1980, Promega, Madison, USA)试剂盒说明书。
1.2.7 数据统计与分析 差异显著性分析软件为SPSS 17.0,用Excel 2010统计数据并作图。
2 结果与分析
2.1 PpILR1转基因番茄的PCR和qPCR检测
用测序正确的平末端重组PpILR1-pEASY载体为模板构建PpILR1基因过表达载体并送北京擎科生物技术有限公司测序,提取测序成功的过表达载体PpILR1-pSAK277并转化农杆菌GV3101,借助农杆菌介导遗传转化方法侵染野生型Micro-Tom番茄,用含50 mg·L-1卡那霉素的MS培养基进行抗性植株的筛选,移栽28 d后提取叶片DNA,用PpILR1基因的特异性引物进行PCR扩增,结果显示,获得的14株番茄植株均能扩增出条带,而阴性对照野生型番茄不能扩增出条带(图1-A),表明PpILR1已经成功整合到番茄基因组中。提取转基因阳性苗叶片总RNA用于荧光定量PCR分析(图1-B)。结果表明,14株转基因株系PpILR1相对表达量均显著高于野生型番茄,且株系PpILR1-9和PpILR1-14相对表达量最高,故后续试验选取PpILR1-9和PpILR1-14株系的T2代做进一步分析。

注:M为marker;WT为野生番茄;1~14为转基因番茄株系。“**” 表示在p<0.01条件下差异显著。
2.2 PpILR1转基因番茄株系的分枝角度分析
选择PpILR1基因相对表达量最高的2个株系PpILR1-9和PpILR1-14的T2代转基因植株进行表型分析。与野生型番茄相比,转基因株系PpILR1-9和PpILR1-14分枝角度变小(图2-A),且转基因株系的株冠显著小于野生型番茄(图2-B)。野生型番茄分枝角度的平均值为79.1°,而转基因番茄株系PpILR1-9和PpILR1-14分枝角度的平均值分别为50.3°和54.3°(图2-C)。

注:图A、图B为WT和转基因株系PpILR1-9、PpILR1-14正面图和俯视图。C为PpILR1-9、PpILR1-14分枝角度显著小于WT。“**”表示在p<0.01条件下差异显著。
2.3 外源NAA处理对PpARFs基因转录的影响
通过序列比对分析,从桃基因组中鉴定到17个ARF转录因子,其命名参照DIAO等的方法[26]。为明确17个PpARF基因是否响应NAA处理,用40 mg·L-1NAA处理多年生‘洒红龙柱’桃,并取处理0和2 h分枝连接处韧皮部用于转录组测序。热图分析结果表明,17个PpARF基因中,基因PpARF4、PpARF8A、PpARF8B和PpARF12响应NAA处理,且基因PpARF4和PpARF8A表达量显著上调(图3)。
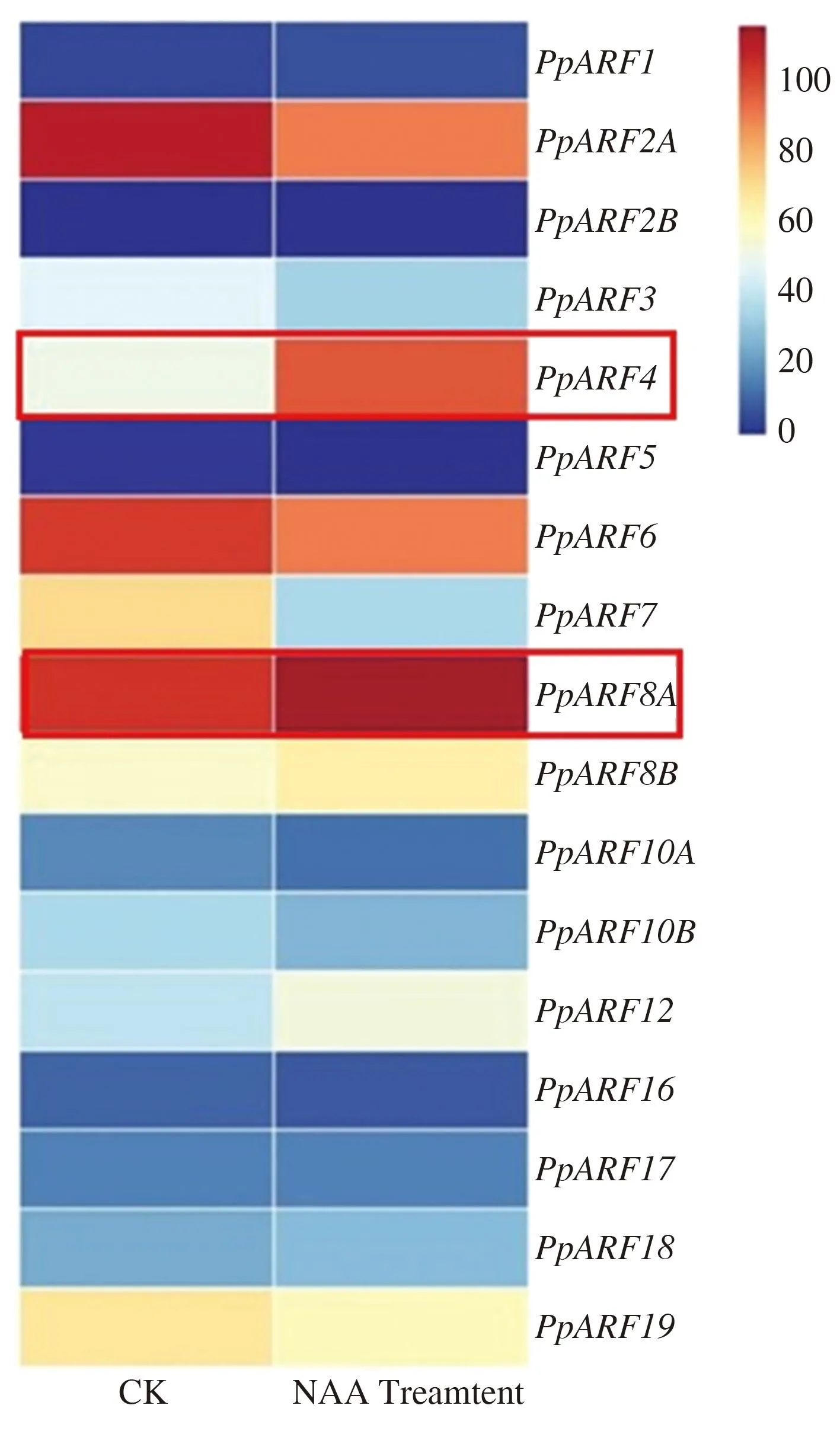
注:CK表示NAA处理0 h的‘洒红龙柱’桃分枝连接处;NAA treatment表示NAA处理2 h的‘洒红龙柱’桃分枝连接处。
2.4 PpARF4和PpARF8A与PpILR1启动子互作关系分析
PpILR1启动子元件分析结果表明,PpILR1启动子区域含有ARF结合元件TGTGNN,且基因PpARF4和PpARF8A响应NAA处理。表明转录因子PpARF4和PpARF8A可能结合PpILR1启动子。酵母单杂交试验进一步验证该推测,当培养基中不含金担子素(AbA)时,对照组(空载AD载体和PpILR1-PAbAi)和试验组(PpILR1-PAbAi和PpARF4-AD、PpARF8A-AD)均能正常生长,而当培养基中加入150 ng·mL-1AbA时,仅试验组能够正常生长(图4)。结果表明转录因子PpARF4和PpARF8A能结合PpILR1启动子。

Positive control:阳性对照;AD+PpILR1:AD空载质粒和PpILR1-PAbAi;PpARF4+PpILR1:PpARF4-AD和PpILR1-PAbAi;PpARF8A+PpILR1:PpARF8A-AD和PpILR1-PAbAi;AbA:金担子素A;
2.5 烟草瞬时分析PpARF4和PpARF8A对PpILR1启动子活性的影响
为明确转录因子PpARF4和PpARF8A对PpILR1启动子活性的影响,克隆PpILR1启动子序列,并构建PpILR1-pGreen0800载体,克隆基因PpARF4和PpARF8A编码区序列构建过表达载体用于烟草瞬时试验。双荧光素酶试验结果显示,PpARF4和PpARF8A为转录抑制子,与对照组相比,能显著抑制PpILR1启动子活性。对照组(空载pSAK277和PpILR1-pGreen0800)LUC/REN比值为0.062,试验组(35S-PpARF4与PpILR1-pGreen0800、35S-PpARF8A与PpILR1-pGreen0800)的LUC/REN比值分别为0.013和0.025(图5)。

Control表示SAK空载;“**”表示在p<0.01水平差异显著。
3 结论与讨论
植物树(株)型直接影响其栽培密度、果实产量、果实品质等,分枝角度是影响植物树(株)型建成的重要因素之一。普通型桃分枝角度大,树型开张,随着结果年限的推移,树体枝繁叶茂,直接影响通风透光、果实品质,还加重病虫害发生概率[30]。柱型桃因其分枝角度小、树冠小、侧枝数量少等特点受到育种工作者的青睐。发掘控制桃分枝角度相关基因,通过分子育种手段对现有主栽桃品种树型进行改良具有重要意义。
本研究从柱型桃‘洒红龙柱’克隆PpILR1基因的编码区并稳定转化micro-Tom番茄,与野生型番茄相比,转基因番茄分枝角度显著减小。目前鉴定的与分枝角度形成相关的基因主要有LAZY1和TAC1[31-32]。LAZY1基因表达上调则植物分枝角度小,反之则分枝角度变大。LAZY1可通过调控蛋白PIN3的膜定位进而影响植物体内的生长素极性运输过程,最终参与调节植物分枝角度形成过程[33-34]。并且有研究表明,TAC1基因可能也是通过影响生长素在植物体内的分布进而影响分枝角度[35]。生长素在植物体内有2种存在形式,即游离态生长素和结合态生长素,仅游离态生长素具有正常活性。生长素酰胺水解酶家族蛋白能水解氨基酸结合态生长素的酰胺键并释放具有生物活性的游离态生长素,进而调节植物组织中的游离态生长素含量[13]。有研究表明,桃PpILR1基因能水解结合态生长素IAA-Leu和IAA-Ala,并释放游离态生长素IAA[36],推测PpILR1基因可能通过增加植物组织局部具有正常生物活性游离体态生长素的含量,进而影响植物分枝角度的形成。
ARF为生长素重要响应因子,可通过生长素响应元件TGTCNN结合并调控生长素下游基因的表达。ARF蛋白家族含有3个保守结构域,即DNA结合结构域(DBD),中部的中间结构域(MR)和具二聚化作用的二聚结构域(RD)。ARF基因编码的蛋白能识别并结合在生长素响应基因的启动子上,并调控这些基因的表达。ARF基因在植物的整个生长发育过程中发挥重要调控作用。在拟南芥中,基因AtARF7和AtARF19调控根部生长点的形成[37];AtARF5基因调控拟南芥叶原基的形成[38];基因AtARF6和AtARF8调控拟南芥花器官的形成[39];AtARF10基因影响拟南芥分枝的再生能力[40]。同时,ARF转录因子对植物分枝角度的形成也具有重要调节作用,在水稻中,转录因子OsARF19结合并促进生长素酰胺合成酶OsGH3-5基因表达,而OsGH3-5可使具生物活性的游离态生长素转化为氨基酸结合态生长素,进而减少植物组织生长素含量并调节分枝角度[19]。本研究发现,在桃中,与对照组相比,外源NAA处理能显著增加基因PpARF4和PpARF8A的表达水平,且转录因子PpARF4和PpARF8A能结合并调控基因PpILR1的表达,表明转录因子PpARF4和PpARF8A可能通过调控PpILR1基因的表达进而参与调控植物分枝角度形成过程,可为桃树型的遗传改良工作提供理论支持。
