内镜黏膜下剥离术治疗早期结直肠癌及癌前病变的非整块切除影响因素分析
2023-12-29张渝昕丁士刚
张渝昕 刘 珣 顾 芳 丁士刚
(北京大学第三医院消化科,北京 100191)
结直肠癌是常见的恶性肿瘤,发生率仅次于肺癌及胃癌,已成为癌症相关死亡第二大原因[1]。内镜是结直肠癌的重要筛查及治疗工具。内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)最初应用于治疗早期胃癌,近年来也广泛应用于早期结直肠癌及癌前病变切除,与内镜黏膜切除术(endoscopic mucosal resection,EMR)相比,ESD具有较高的整块切除率、完全切除率及较低的复发率[2,3]。然而,由于ESD操作难度较高,具有较高的穿孔、出血等并发症发生率及较长的手术时间,有相当部分ESD未能实现整块切除,Imai等[4]报道ESD非整块切除率为1%~16%。非整块切除影响病理评估结果的准确性,直接影响后续治疗方式选择及内镜随访策略。如何提高ESD整块切除率,是仍待解决的问题。本研究分析我科2011年1月~2022年12月ESD治疗早期结直肠癌及癌前病变的临床病理资料,探讨影响ESD整块切除的因素。
1 对象与方法
1.1 研究对象
纳入标准:2011年1月~2022年12月在我科行结直肠ESD(ESD病例选择标准依据中国早期结直肠癌筛查及内镜诊治指南[5]),术后病理证实为结直肠癌前病变[包括腺瘤,锯齿状病变(增生性息肉、传统锯齿状腺瘤和无蒂锯齿状病变)]或早期结直肠癌(局限于黏膜层及黏膜下层的结直肠癌)[6]。
排除标准:内镜资料或病理资料不全。
本研究通过北京大学第三医院医学科学研究伦理委员会审核批准(M2022769),免除受试者知情同意签字。
1.2 ESD方法
全麻,主要步骤:①明确病灶部位,确定病灶范围;②黏膜下注射,于标记点外侧予0.005%肾上腺素亚甲蓝盐水多点黏膜下注射使病灶抬起;③Dual刀或IT刀沿病灶边缘标记点切开黏膜;④Dual刀或IT刀切开黏膜下层显露病灶,在病灶边缘及基底进行逐渐剥离至病变完整切除(标准ESD)[7],或剥离大部分后用圈套器套取通过高频电流切除病灶(混合ESD)[8],或从病变肛侧缘中央处分离黏膜下层建立黏膜下隧道,由隧道内向口侧剥离至病变口侧切缘,并向两侧剥离至侧切缘完全剥离(隧道ESD)[9];⑤创面处理:氩离子凝固或热活检钳电凝止血,必要时钛夹夹闭创面;⑥组织学病理检查:将切除组织固定于平板上,用中性甲醛溶液固定后送检,每间隔2 mm进行病理切片。
疗效评价标准(临床医生根据内镜情况和病理报告综合判断,不确定者开展阅片讨论):①整块切除[10]:病灶一次性完整剥离或完全圈套切除。②完全切除(R0切除)[10]:水平切缘和垂直切缘均阴性的整块切除。③治愈性切除[11]:整块切除的基础上,组织学标准满足以下5点:垂直切缘阴性;黏膜下层浸润深度<1000 μm;无脉管浸润;乳头状管状腺癌或管状腺癌;低级别肿瘤出芽。
1.3 资料收集和观察指标界定
由2名录入员通过我院内镜管理系统检索2011年1月~2022年12月我科结直肠ESD,通过消化病理系统确定病变病理类型,纳入病理证实为腺瘤、锯齿状病变、早期结直肠癌的病例。采用Excel进行数据录入及核对,并建立数据库,由一名消化科医师复核。
临床特征:依据住院号、姓名及操作日期在住院电子病历系统中检索,记录年龄、性别、体重指数、既往史。
内镜特征及病理特征:依据住院号、姓名及操作日期在内镜管理系统中检索,依据ESD术前内镜图文报告、ESD操作内镜报告,记录病变位置(分为盲肠、升结肠、横结肠、降结肠、乙状结肠、直肠),病变长径(内镜报告,精确到1 mm),病变内镜分型(分为隆起型、平坦型及侧向发育型[10]),抬举征,是否位于瘢痕部位,ESD切除方式(分为标准ESD、混合ESD、隧道ESD),是否整块切除,有无术前活检,ESD手术时间,是否术中出血(操作过程中应用氩气等离子或止血钳或止血夹进行止血[12]),是否术中穿孔(操作过程中可见肌层断裂,浆膜下脂肪显露[4])。病理特征依据病理报告采集,包括病理类型、浸润深度、有无脉管浸润等。
操作者经验:依据是否独立成功完成50例及以上结直肠ESD分为2组[13]。
1.4 统计学分析
采用R4.2.1软件进行统计分析。计数资料以例数和百分数表示,组间比较采用χ2检验。使用Shapiro-Wilk检验判断计量资料是否符合正态分布,符合正态分布的计量资料以均数±标准差表示,组间比较采用独立样本t检验;不符合正态分布的计量资料以中位数(四分位数)表示,组间比较采用Mann WhitneyU检验。单因素及向后回归法多因素logistic分析非整块切除的影响因素。P值为双侧,显著性水平α=0.05。
2 结果
2.1 基线特征及ESD治疗结果
本研究共收集符合纳入和排除标准的1251例患者1312个病变。男665例(53.2%),女586例(46.8%)。年龄21~88岁,(63.3±11.0)岁。1312个病变长径(25.8±16.3)mm,其中长径≥40 mm病变211个(16.1%)。病变位于直肠335个(25.5%),乙状结肠201个(15.3%),降结肠96个(7.3%),横结肠220个(16.8%),升结肠279个(21.3%),盲肠181个(13.8%)。瘢痕部位病变35个(2.7%)。隆起型332个(25.3%),平坦型126个(9.6%),侧向发育型854个(65.1%)。腺瘤728个(55.5%)[其中管状腺瘤596个(45.4%),管状绒毛状腺瘤123个(9.4%),绒毛状腺瘤9个(0.7%)],锯齿状病变193个(14.7%)[其中增生性息肉42个(3.2%),无蒂锯齿状病变138个(10.5%),传统锯齿状腺瘤13个(1.0%)],腺癌391个(29.8%)[其中黏膜内癌267个(20.4%),黏膜下浅层浸润癌72个(5.5%),黏膜下深层浸润癌52个(4.0%)]。1306个病变(1245例患者)完成ESD治疗,因穿孔或操作困难中止切除6例,中位手术时间28(14,58)min。病变整块切除率89.5%(1174/1312),完全切除率73.8%(968/1312),治愈性切除率70.6%(926/1312)。
2.2 整块切除与非整块切除临床病理特征比较
整块切除组1115例1174个病变,非整块切除组136例138个病变,2组临床病理特征、手术相关结果见表1。2组性别、年龄、体重指数、合并症、病变位置、操作者经验异无统计学意义。与整块切除组相比,非整块切除组的病变长径较大[(36.3±20.7) mm vs. (24.6±15.2) mm,P<0.001],腺癌占比较高[44.2%(61/138) vs. 28.1%(330/1174),P<0.001],黏膜下层浸润率较高[15.9%(22/138) vs. 8.7%(102/1174),P=0.009],手术时间较长[60(29,128) min vs. 25(13,52) min,P<0.001]。2组在病变内镜分型、瘢痕部位病变、抬举征、术前活检、ESD方式、术中穿孔、术中出血方面差异均具有统计学意义(P<0.05)。
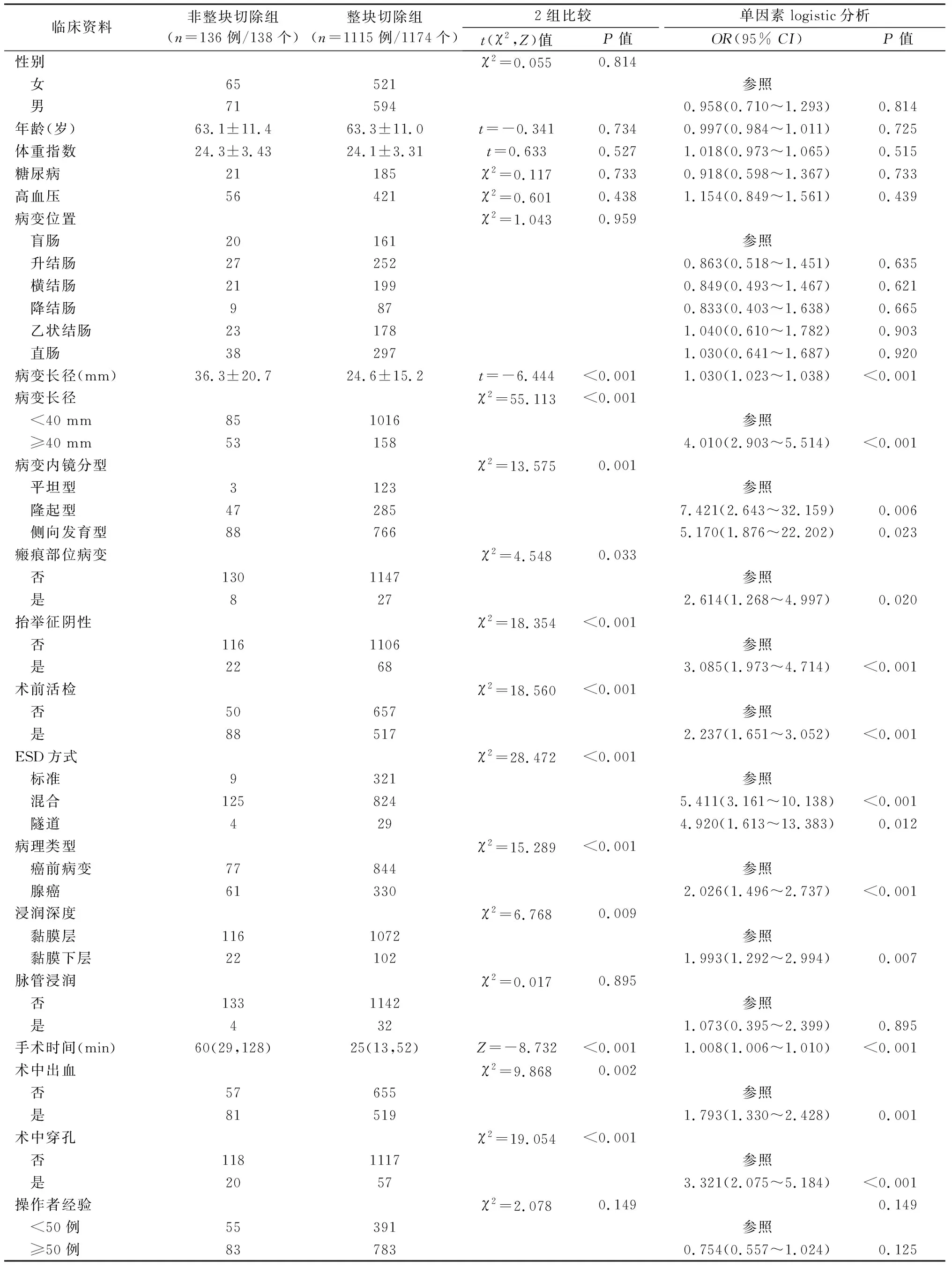
表1 整块切除组与非整块切除组临床内镜病理特征及单因素logistic分析
2.3 影响早期结直肠癌及癌前病变整块切除的单因素及多因素分析
单因素分析结果见表1,病变长径、内镜分型、瘢痕部位病变、抬举征阴性、术前活检、ESD方式、病理类型、浸润深度、手术时间、术中出血、术中穿孔与非整块切除有关(P<0.05)。将单因素分析中可能有意义的因素(P<0.1)纳入logistic多因素回归分析,结果见表2,病变长径≥40 mm(OR=6.329,95%CI:4.278~9.384,P<0.001)、抬举征阴性(OR=2.384,95%CI:1.424~3.903,P=0.005)、瘢痕部位病变(OR=2.997,95%CI:1.310~6.484,P=0.023)、隆起型(OR=8.458,95%CI:2.678~40.453,P=0.008)、侧向发育型(OR=5.898,95%CI:1.917~27.796,P=0.025)、混合ESD切除(OR=10.162,95%CI:5.705~19.692,P<0.001)是ESD治疗早期结直肠癌及癌前病变非整块切除的独立影响因素。
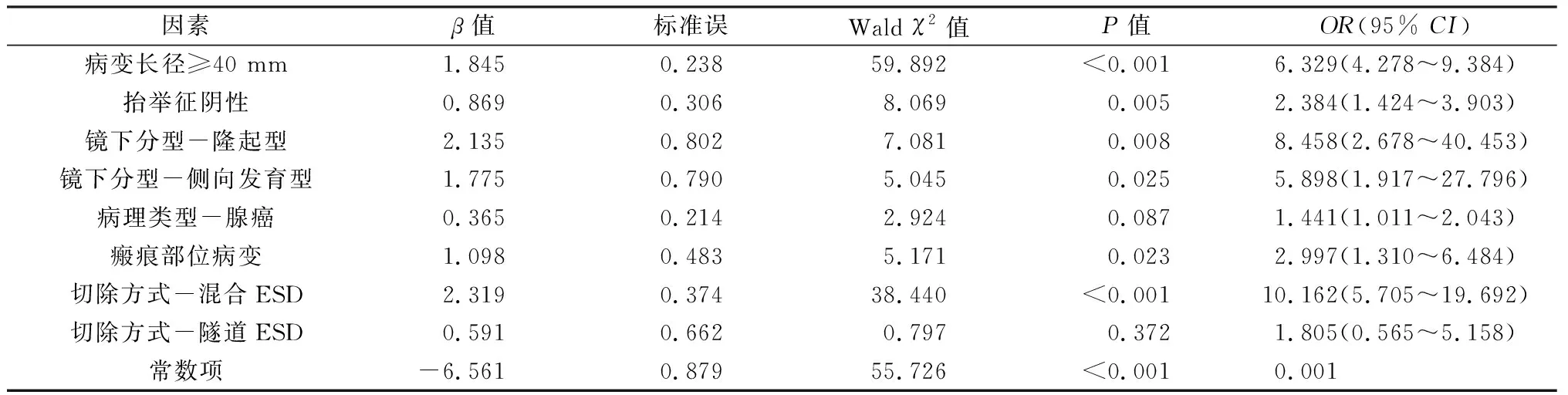
表2 影响内镜黏膜下剥离术治疗早期结直肠癌及癌前病变整块切除的多因素logistic回归分析
3 讨论
早期结直肠癌及癌前病变的治疗包括外科手术和内镜治疗,内镜治疗普遍使用EMR和ESD。与外科手术相比,ESD创伤小,术后恢复快,生活质量高[14];与EMR相比,ESD可实现较大病变的整块切除,并提高病理分期的准确性[15]。但由于结肠弯曲、冗长,肠壁菲薄且有较多皱襞,结直肠ESD技术难度大。欧洲一项研究显示ESD切除早期结直肠肿瘤(直径1~12.5 cm,中位数4 cm)的整块切除率为80.1%(241/301)[16],而日本同期一项大规模多中心研究显示整块切除率为92.6%(1166/1259)[肿瘤直径(33±17)mm][17]。本研究回顾性分析1251例结直肠ESD共1312个病变的临床病理资料,病变长径平均25.8 mm,整块切除率为89.5%(1174/1312)。Oka等[18]的研究显示,非整块切除ESD复发率为13.9%(5/36),与分块EMR相近(14.6%,55/378),而其他文献报道整块切除ESD的复发率仅为0.5%(8/1503)[15]~4.2%(15/361)[19,20]。因此,明确影响ESD治疗结直肠肿瘤非整块切除的术前可识别因素尤为重要。
本研究结果显示,病变长径≥40 mm、抬举征阴性、隆起型病变、侧向发育型病变、瘢痕部位病变、混合ESD切除是非整块切除的独立影响因素。
苏惠等[21]比较ESD治疗不同直径结直肠病变的差异,结果显示直径≥40 mm的肿瘤整块切除率、完整切除率、治愈性切除率均明显低于直径<40 mm的肿瘤。直径≥40 mm的结直肠肿瘤ESD手术难度较高。
Takeuchi等[22]分析ESD切除结直肠肿瘤816个,其中整块切除767个(94%),多因素logistic回归分析显示非整块切除的独立影响因素为使用圈套器(OR=25.32,95%CI:10.37~63.94,P<0.001)以及抬举征阴性(OR=10.74,95%CI:4.49~25.18,P<0.001)。这与本研究结果一致。病变呈现抬举征阴性可能与肿瘤黏膜下深层浸润或黏膜下纤维化有关[23]。对于抬举征阴性的病变,可考虑行内镜下全层切除术(endoscopic full thickness resection,EFTR)[24]。
混合ESD作为ESD的简化形式,以应用部分黏膜下层剥离联合圈套器的方式代替逐步完全剥离,可极大缩短手术时间,且不增加并发症发生率,但整块切除率明显低于标准ESD(OR=0.31,95%CI:0.17~0.57,P<0.001)[25]。Byeon等[26]研究表明混合ESD整块切除率低于ESD组(64% vs. 87%,P<0.01),但在<20 mm病变中2组无明显差异(89% vs. 96%,P=0.62)。混合ESD整块切除率低可能与圈套器直径有限有关,对于直径偏大的病变应避免使用混合ESD切除。
本研究结果显示瘢痕部位病变亦为影响ESD非整块切除的重要因素。瘢痕的形成往往与术前活检所致的机械热损伤有关[27]。因此,对于结直肠病变,通过术前窄带成像、放大内镜、色素内镜等评估病变性质,预测浸润深度,确定边界,对于直径≥40 mm的隆起型及侧向发育型病变,选择标准ESD,避免术前活检,可提高ESD治疗早期结直肠癌及癌前病变的整块切除率。
综上所述,ESD治疗早期结直肠癌及癌前病变可实现较高的整块切除率。病变长径≥40 mm、抬举征阴性、隆起型病变、侧向发育型病变、混合ESD切除是影响ESD非整块切除的独立因素,术前应识别高危因素,选择合理的操作方式,以提高ESD的疗效。
