基于非靶向代谢组学研究呋喃西林胁迫下克氏原螯虾体内氨基脲的代谢
2023-12-14陈霞霞项德胜陈雪昌张小军
陈霞霞,张 祎,项德胜,胡 诗,陈雪昌,张小军,*
(1.浙江省海洋水产研究所,浙江省海洋渔业资源可持续利用技术研究重点实验室,浙江 舟山 316021;2.浙江海洋大学食品与药学学院,浙江 舟山 316022;3.浙江大洋兴和食品有限公司,浙江 舟山 316014)
呋喃西林是一种价格低廉的抗生素,由于其具有潜在的致畸性、诱变性、致癌性[1-3],目前已被列为三类致癌物,禁止在水产领域使用[4]。而氨基脲是呋喃西林的代谢残留标志物,在进入代谢后极易与蛋白质结合形成稳定的产物残留在体内[5-6]。目前欧盟、美国和我国均以氨基脲作为标志残留物,对呋喃西林进行残留检测和监控[3,7-8]。2003年,欧盟通过了2003/181/EC委员会决议,建立了水产品中呋喃西林代谢物氨基脲的各种检测方法,并规定检测限为1 μg/kg[9]。然而据报道,大量未使用抗生素的贸易产品中也检测到氨基脲[10-12],这使各研究对氨基脲的来源重新进行探索,目前大多数学者认为部分水产品中有内源性氨基脲的存在,尤其是甲壳类水产品[13-14]。2001年,Christof等[15]得出罗氏沼虾中确实存在内源性氨基脲,后续又对不同种类甲壳类动物进行实验研究,证实了甲壳类水产品中内源性氨基脲的存在。
基于氨基脲对甲壳类水产品的毒理作用,必须从不同角度去探讨氨基脲的产生来源。而代谢组学在近年来显示出巨大的潜力,其为生物标志物的鉴定、毒理学机制和疾病的治疗提供了新的技术手段[19]。Gu Chenhui等[20]通过非靶向代谢组学技术对大鼠进行研究,揭示药物二丸妙方对高尿酸血症的作用机制。Amoah等[21]通过非靶向代谢组学技术鉴定了蓖麻粕诱导幼年杂交石斑鱼体内肠炎的潜在生物标志物。Muhammad等[22]通过非靶向代谢组学技术研究了氟化物对人体的潜在危害,通过分析氟化物在人血清中的代谢,发现氟化物代谢的相关途径及代谢物质。可见,代谢组学已在食品药品领域被广泛应用,借助该技术有助于探究氨基脲在甲壳类水产品中的产生及代谢途径。
目前关于甲壳类水产品中氨基脲的产生机制及转化途径方面的研究仍较少,虽然多数研究均将氨基脲指向精氨酸,但仍缺乏直接相关的体内转化途径,并且氨基脲在甲壳类水产品中的代谢机制也尚未被阐明。因此,本研究以呋喃西林作为目标胁迫污染物,克氏原螯虾为胁迫主体,开展外源污染物呋喃西林及其代谢产物氨基脲的蓄积实验及代谢组学研究,以期为氨基脲后续研究提供可能的参考。
1 材料与方法
1.1 材料与试剂
鲜活克氏原螯虾于2022年7月一批次购买于浙江舟山丰茂菜场。从中挑选出附肢完整,大小一致的克氏原螯虾150 只,分别暂养于室内循环流水养殖箱中。实验前对养殖水体及饲料进行呋喃西林原药及氨基脲检测,确保实验过程无呋喃西林及氨基脲干扰。在20~25 ℃室温养殖1 周,养殖期间持续充氧。整个实验过程采用淡水养殖,每日于8:00、17:00统一进行喂食,实验开展前禁食2 d,并去除死虾。
呋喃西林(纯度>98.5%)南昌白云药业有限公司;同位素标记的氨基脲(SEM·HCl-13C-15N2)标准品、盐酸氨基脲标准品、2-硝基苯甲醛 德国Dr.Ehrenstorfer公司;醋酸铵(优级纯)、无水磷酸氢二钾、偏磷酸、盐酸、甲酸、牛磺酸、次牛磺酸、天冬氨酸、丙氨酸、精氨酸、谷氨酸和谷氨酰胺 国药集团化学试剂有限公司;甲醇(色谱级)、乙酸乙酯 德国Merck公司。
1.2 仪器与设备
N-EVAP-11634氮气吹干仪 美国Organomation公司;Heraeus Fresco17离心机、UltiMate 3000超高液相色谱仪、Q-Exactive高分辨质谱仪 美国Thermo Fisher Scientific公司;BSA124S-CW电子天平 德国Sartorius公司;ACQUITY UPLC BEH C18色谱柱、HLB固相萃取柱 美国Waters公司。
1.3 方法
1.3.1 胁迫实验
因甲壳类动物的特殊性,通过口服、注射等方式难以达到预期的给药效果,实验采取浸泡法测定短时间内原药及其代谢物在克氏原螯虾体内的变化情况。实验前将已禁食的克氏原螯虾随机均分为6 组,每组20 只,随机设定为对照组和实验组。对照组不添加呋喃西林,实验组采用10 mg/L的呋喃西林溶液浸泡克氏原螯虾。实验组分别于药物浸泡4、8、16、24、48 h采集样品,每次随机采集12 只,用水冲洗干净体表,取非表皮的腹部肌肉。样品分成2 份,一份迅速放入液氮中保存,用于代谢组学分析。另一份放入-60 ℃冷冻保存,用于测定呋喃西林和其代谢物氨基脲浓度变化。
1.3.2 呋喃西林原药检测
参照DB37/T 1779—2011《水产苗种中硝基呋喃类原药残留量的测定 液相色谱-串联质谱法》。色谱条件:色谱柱ACQUITYTM UPLC BEH C18柱(2.1 mm×100 mm,1.7 μm);柱温35 ℃;进样体积10 μL;流速0.2 mL/min;流动相A为含体积分数0.1%甲酸的2 mmol/L乙酸铵溶液,B为甲醇。质谱条件:电喷雾电离源(electrospray ionization,ESI),负离子模式,电离电压2 500 kV,雾化温度350 ℃,雾化气流速700 L/h;碰撞能量10 eV,扫描模式:多反应监测;m/z197.1>80.1,m/z197.1>124.112 4。
1.3.3 代谢物氨基脲检测
参照农业部783号公告—1—2006《水产品中硝基呋喃类代谢物残留量的测定 液相色谱-串联质谱法》。样品水解及衍生化:分别称取2 g虾肉于50 mL离心管中,加入0.05 mL SEM·HCl-13C-15N2内标工作溶液,涡旋混合50 s,再加入5 mL 0.2 mol/L HCl溶液和0.15 mL 0.05 mol/L 2-硝基苯甲醛溶液,涡旋振荡50 s后,在恒温水浴振荡器中37 ℃避光振荡16 h。样品的提取:加入1 mol/L磷酸氢二钾将混合物pH值调整至7~7.5,加入4 mL乙酸乙酯,均匀混合。6 000 r/min离心10 min,吸取上清液,为充分提取再次重复上述操作,合并上清液在40 ℃氮吹,加入2 mmol/L乙酸铵溶液(含体积分数0.1%甲酸)复溶,过0.45 μm滤膜待测。
色谱条件:色谱柱采用ACQUITYTM UPLC BEH C18柱(2.1 mm×100 mm,1.7 μm);进样体积5 μL;样品室温度10 ℃;柱温35 ℃;流速0.2 mL/min;流动相A为含体积分数0.1%甲酸的2 mmoL/L乙酸铵溶液,B为甲醇。质谱条件:电离模式为ESI+,喷雾电压4 100 V,辅助气流量3 L/min,离子传输毛细管温度350 ℃;扫描模式:选择反应监测,同位素标记的氨基脲衍生物为m/z212.1>192.1(碰撞能量10 eV);氨基脲衍生物为m/z209.1>192.1(碰撞能量12 eV);m/z209.1>166.1(碰撞能量12 eV)。
1.3.4 代谢组学检测
1.3.4.1 样品前处理
将胁迫0、4、24 h的肌肉样品置于冰上解冻,取20 mg样品加入120 μL 50%甲醇溶液,涡旋1 min后,在室温孵育10 min;然后将提取混合物在-20 ℃保存过夜。4 000 r/min离心20 min,将上清液转移到96 孔板中,-80 ℃保存待测。
1.3.4.2 超高效液相色谱-四极杆/静电场轨道阱高分辨质谱(ultra-high performance liquid chromatographyquadrupole/electrostatic field orbitrap high resolution mass spectrometry,UPLC-Q-Exactive-MS)检测条件
色谱条件:ACQUITY UPLC BEH C18柱(100 mm×2.1 mm,1.8 μm);柱温35 ℃;流速0.4 mL/min,流动相A为体积分数0.1%甲酸溶液,B为含体积分数0.1%甲酸的乙腈。梯度洗脱条件:0~0.5 min,95% A、5% B;0.5~7 min,95%~0% A、5%~100% B;7~8 min,0% A、100% B;8~8.1 min,0%~95% A、100%~5% B;8.1~10 min,95% A、5% B。每个样品的注射量为4 μL。
质谱条件:ESI+,采用数据依赖性采集模式扫描,扫描范围m/z70~1 050,以分辨率70 000收集前体光谱,最大注入时间100 ms;以分辨率17 500收集碎片光谱,最大进样时间80 ms。
1.3.5 模拟氨基酸代谢途径下氨基脲检测
采用H2O2、VC、FeCl3组成的模拟氧化体系[23],结合尿素模拟虾体内氨基酸代谢。分别配制0.1 mmol/L FeCl3、0.1 mmol/L VC和100 mmol/L H2O2的溶液于容量瓶中备用。分别称取0.4 g牛磺酸、次牛磺酸、天冬氨酸、精氨酸、谷氨酸和谷氨酰胺于50 mL离心管中,分别加入0.4 g尿素,用10 mL水充分溶解,然后分别加入200 μL 0.1 mmol/L FeCl3和0.1 mmol/L VC溶液,100 μL 100 mmol/L H2O2溶液氧化3 h。氧化结束后,分别加入0.05 mL SEM·HCl-13C-15N2内标工作溶液,涡旋混合50 s,再加入5 mL 0.2 mol/L HCl溶液和0.15 mL 0.05 mol/L 2-硝基苯甲醛溶液,涡旋振荡50 s后,置于恒温水浴振荡器中37 ℃避光振荡16 h。后续操作同1.3.3节。
1.4 数据处理与分析
利用人类代谢数据库(human metabolome database,HMDB)、京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)数据库进行代谢物注释,解释代谢物的物理化学性质、生物功能。利用metaX软件对代谢物进行定量和差异代谢物筛选。采用正交偏最小二乘判别分析(orthogonal partial least squares-discriminant analysis,OPLS-DA)代谢物的变化。基于t检验检测2 个表型之间代谢物水平的差异显著性。通过metaX进行监督PLS-DA,以区分组间的不同变量。差异代谢物的筛选设定阈值为变量投影重要性(variable importance in projection,VIP)值大于1.0、P<0.05,随后将差异代谢物数据导入MetaboAnalyst 5.0进行代谢通路富集分析。
2 结果与分析
2.1 呋喃西林及氨基脲在克氏原螯虾肌肉组织中的质量浓度变化
如图1所示,由于呋喃西林在进入虾体内后代谢十分迅速,随着呋喃西林胁迫时间的延长,氨基脲在克氏原螯虾肌肉中的残留量逐渐增加,氨基脲质量浓度从(6.91±1.25)ng/mL上升到(214.98±4.59)ng/mL。但呋喃西林的含量则呈现先增加后减少再增加的趋势。4 h后,呋喃西林质量浓度为(159.35±28.96)ng/mL,这一变化可能是由于4 h时呋喃西林进入虾体内,随后呋喃西林开始转化成氨基脲,导致8 h时呋喃西林含量降低而氨基脲含量升高,至16 h时氨基脲和呋喃西林之间的转化趋于稳定,24 h时同步积累。徐英江等[24]对栉孔扇贝体内氨基脲的生物富集进行研究,发现随海水中氨基脲浓度的增加,扇贝体内氨基脲的积蓄量也逐渐增加,且各组织中氨基脲含量与曝污浓度呈正相关。任宪云[25]研究多环芳烃苯并芘对凡纳滨对虾体内积蓄毒性效应发现,凡纳滨对虾各组织中苯并芘的积累量随海水中苯并芘浓度以及曝露时间的变化而变化,胁迫1 d的鳃和肝胰腺中苯并芘的检出量增多,在3 d时呈现下降趋势,后续又呈现增长趋势。这一趋势与本研究中克氏原螯虾经呋喃西林胁迫后的积蓄趋势一致,均呈现先增后减再升高的趋势。对此,猜测是由于呋喃西林在甲壳类水产品中的代谢十分迅速,进入虾肌肉组织4 h后就开始转化生成氨基脲,随后氨基脲的检测量呈现上升趋势。因此,4 h可能是呋喃西林在虾体内代谢旺盛的一个重要时间点,基于此,后续的代谢组学分析选取0、4 h及24 h的肌肉组织样品进行研究。
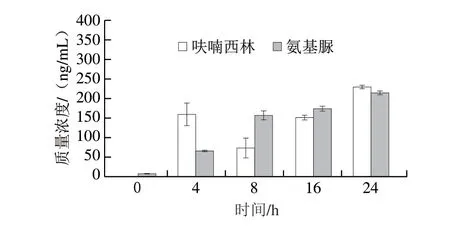
图1 呋喃西林原药及代谢物氨基脲不同时间在克氏原螯虾肌肉组织中的积蓄情况Fig.1 Accumulation of nitrofurazone and semicarbazide in muscle tissue of Procambarus clarkii at different time points
2.2 PLS-DA
PLS-DA是通过偏最小二乘回归建立的代谢物表达量与样本类别之间的关系模型,在有监督模式下进行样本分析,实现样本间更有效地分离[26]。在构建的PLS-DA模型中,=0.781、=0.93、Q2=0.487和R2=0.878,表现出良好的拟合和预测能力(图2)。所有组间在进行200 次交叉验证下表现出Q2<0,说明模型不存在过拟合的情况,差异代谢物分析比较准确。
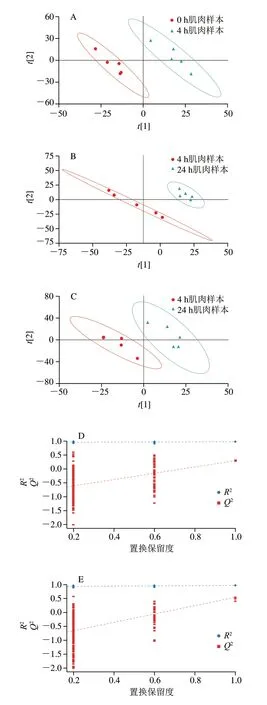
图2 正离子模式下PLS-DA得分图(A~C)及置换检验图(D~F)Fig.2 PLS-DA score plot (A-C) and permutation test (D-F) in the positive ion mode
2.3 代谢差异物质鉴定
为研究呋喃西林组与对照组的差异,通PLS-DA并结合t检验筛选差异表达的代谢物。找到同时满足P<0.05,差异倍数(fold change,FC)大于2或小于0.5,且VIP>1的特征代谢物,即是呋喃西林诱导代谢紊乱和毒性机制的相关标志物。4 h组与对照(0 h)组相比,在肌肉组织中共发现166 种代谢物发生显著变化(P<0.05),FC为0.18~24.61,其中99 种代谢物上调。4 h组与24 h组相比,肌肉组织中共存在249 种差异代谢物(P<0.05),FC为0.03~53.08,其中109 种代谢物上调。24 h组与0 h组相比,差异代谢物数量明显较少,共55 种(P<0.05),其中22 种代谢物上调。蒋原等[27]研究硝基呋喃类药物在克氏原螯虾组织中的消除规律发现,10 μg/mL呋喃西林给药1 h后即可检测到400 μg/kg以上的代谢物氨基脲,说明克氏原螯虾在胁迫状态下1 h内就发生了代谢转化。此外,尤宏争等[28]对珍珠龙胆石斑鱼进行短途运输胁迫实验,发现胁迫对其生理机能不会产生持久性影响,在受到胁迫后168 h血清部分生理指标即趋于胁迫前水平,说明水产品在受到外界胁迫后会首先发生应激反应,此后在一定时间内会恢复到正常。因此,0 h vs.4 h和4 vs.24 h差异代谢物数量较多的原因可能是呋喃西林在进入虾体内后迅速代谢,短时间内体内积蓄的代谢物增多,但至24 h,呋喃西林与其代谢物之间的转化趋于动态平衡,虾中部分循环机制已适应当前生存环境开始趋于稳定,但与未受呋喃西林胁迫的0 h样品相比体内代谢物质已发生转化,因此仍存在一定差异物质。通过HMDB数据库在0 h vs.4 h和4 h vs.24 h这两组中共注释到52 种差异代谢物质。0 h vs.4 h中鉴定到23 种代谢物,其中14 种物质上调,9 种下调;4 h vs.24 h中有39 种代谢物,其中22 种物质上调,17 种下调。这些代谢物分别属于脂质和类脂质分子、有机酸及其衍生物、核苷、核苷酸和类似物、有机杂环化合物、有机氧化合物、苯类、均相非金属化合物及苯丙烷和聚酮化合物。图3直观地表达了不同时间样品中代谢物的差异,图中每个点代表一种代谢物。可以发现4~24 h的差异代谢物最多,其中表达上调的差异代谢物有22 种,包括精氨琥珀酸、L-谷氨酸、甘氨酰亮氨酸等,表达下调的有17 种,包括1-酮糖、还原型烟酰胺腺嘌呤二核苷酸、牛磺酸、次牛磺酸等。

图3 不同时间克氏原螯虾肌肉组织中呋喃西林差异代谢物火山图Fig.3 Volcanic map of differential metabolites from nitrofurazone in muscle tissue of P.clarkii at different time points
2.4 代谢通路分析
为进一步确定呋喃西林胁迫下虾体内相关代谢通路的变化,结合差异物质分析及生物体实验得出的数据,使用MetaboAnalyst 5.0对4 h vs.24 h差异代谢物进行代谢通路分析。根据VIP>1、P<0.05进行筛选,与KEGG数据库进行搜索比对,发现这些代谢差异物质主要富集在23 条代谢通路中(图4)。
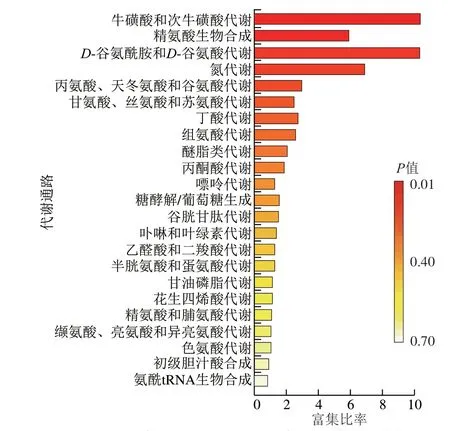
图4 4 h vs.24 h克氏原螯虾肌肉组织中呋喃西林代谢通路富集分析Fig.4 Metabolite pathway enrichment analysis of nitrofurazone in muscle tissue of P.clarkii at 4 vs.24 hours
如图5和表1所示,依据KEGG数据库,以-lgP>0.5且影响因子大于0.05为筛选标准,发现主要有4 条代谢通路受影响,分别为牛磺酸和次牛磺酸代谢(影响因子0.714 3),精氨酸生物合成(影响因子0.233 5),丙氨酸、天冬氨酸和谷氨酸代谢(影响因子0.218 8)及D-谷氨酰胺和D-谷氨酸代谢(影响因子0.5)。
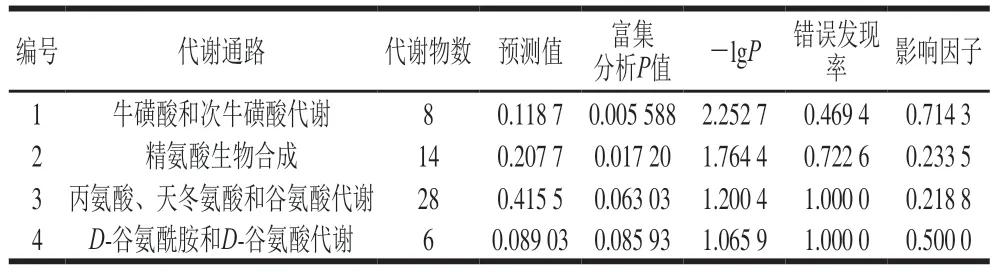
表1 代谢通路分析结果Table 1 Results of metabolic pathway analysis

图5 呋喃西林在克氏原螯虾体内的代谢通路拓扑分析气泡图Fig.5 Topological analysis of metabolic pathways significantly enriched with differential metabolites of nitrofurazone
如表2所示,呋喃西林胁迫下克氏原螯虾肌肉组织中牛磺酸及次牛磺酸的含量显著下降。牛磺酸是一种具有多种细胞保护活性的β-氨基酸,属于巯基氨基酸和半胱氨酸的衍生物,广泛分布于海洋动物的组织和细胞中,是一种条件必需氨基酸[29]。研究表明牛磺酸在细胞内发挥抗氧化保护机制,并且具有抗炎作用。次牛磺酸是牛磺酸和亚牛磺酸代谢途径中半胱胺双加氧酶的产物,在生物系统中次牛磺酸同样能够发挥抗氧化作用[30-31]。本研究中牛磺酸和次牛磺酸含量均降低,说明虾在受到呋喃西林胁迫后机体产生大量自由基,发生氧化应激,导致机体自身的抗氧化活性下降。Tian Xiuhui等[32]研究表明日本刺参暴露于氨基脲后会发生氧化应激反应,肌肉及肠道组织中的超氧化物歧化酶及过氧化氢酶活性发生变化,均呈现先增后减的趋势。牛磺酸可以防止抗氧化酶的损伤从而抑制氧化应激反应,本研究结果显示牛磺酸在该通路中受到抑制,提示虾在受到胁迫后产生氧化应激损伤。
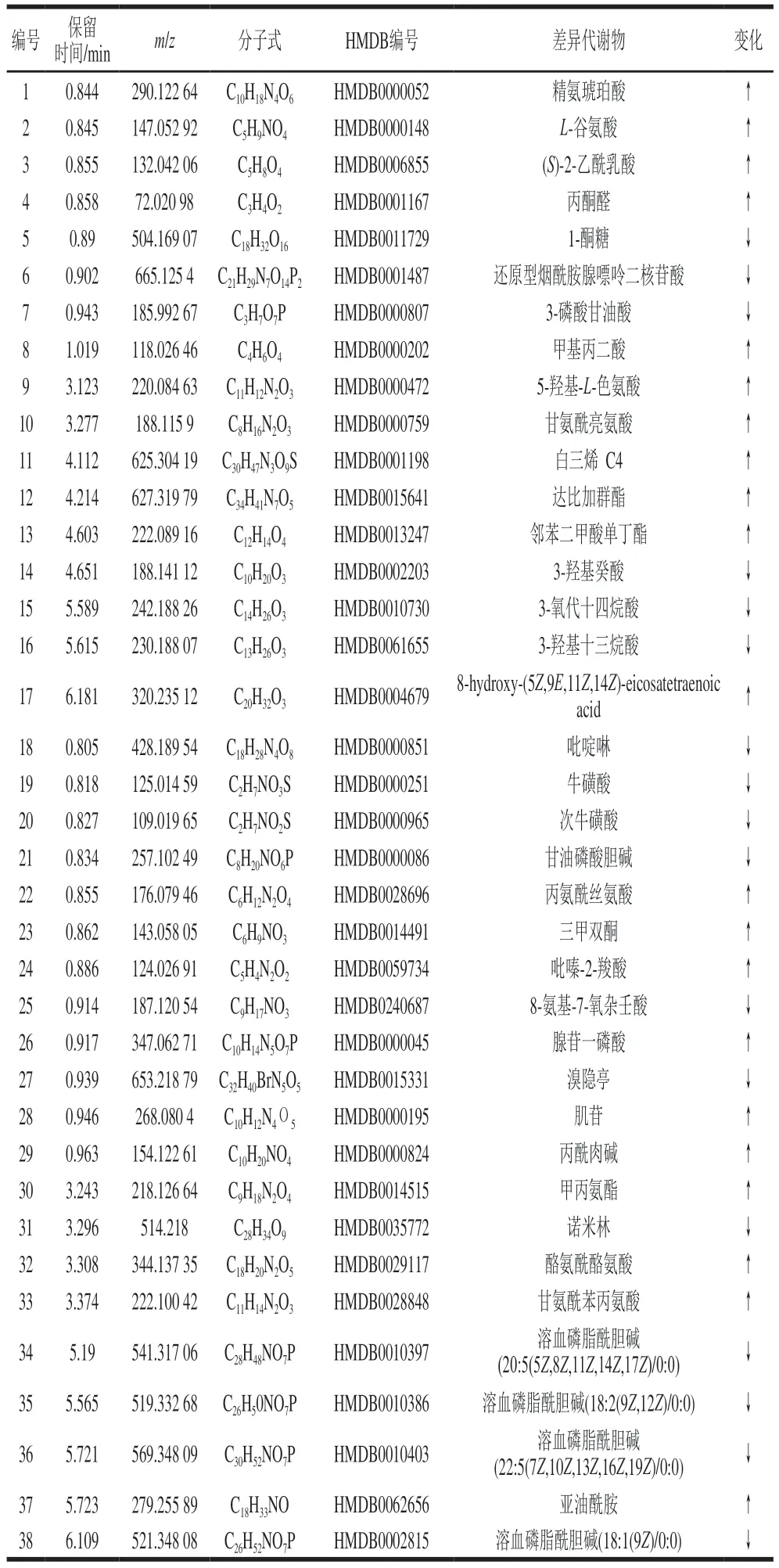
表2 4 h vs.24 h差异代谢物鉴定结果Table 2 Identification of differential metabolites at 4 vs.24 hours
在本研究中,呋喃西林胁迫下克氏原螯虾肌肉组织中精氨酸生物合成,丙氨酸、天冬氨酸和谷氨酸代谢及D-谷氨酰胺和D-谷氨酸代谢途径发生变化。研究表明,生物体在应对外界胁迫时,可通过提高自身氨基酸水平从而为机体供能[33-34]。呋喃西林胁迫诱导调节谷氨酸、精氨琥珀酸、5-羟基-L-色氨酸、甘氨酰亮氨酸、丙氨酰丝氨酸及酪氨酰酪氨酸及其代谢物的水平,说明呋喃西林胁迫下虾肌肉组织的能量代谢发生紊乱。在精氨酸生物合成途径中,L-谷氨酸及精氨琥珀酸显著上调,谷氨酸是动物神经系统中最丰富的快速兴奋性神经递质,说明在短时胁迫条件下,虾体内释放大量神经递质调节机体代谢。内源性氨基脲与精氨酸有一定关联性,Yu Wenlong等[17]对凡纳滨对虾全生长周期中的氨基酸进行研究,发现与氨基脲相关性最强的氨基酸为精氨酸。精氨琥珀酸作为精氨酸的前体物质,在受到呋喃西林胁迫后其量显著上升,进一步影响尿素循环中其他代谢物。
2.5 模拟氨基酸代谢途径下氨基脲含量变化
根据代谢组学通路分析可知,呋喃西林的代谢涉及牛磺酸及次牛磺酸代谢,精氨酸的生物合成,丙氨酸、天冬氨酸和谷氨酰胺代谢以及D-谷氨酰胺和D-谷氨酸代谢途径。氨基酸代谢过程中包括尿素循环这一过程,并且尿素循环与氨基酸之间关系密切,如精氨酸直接参与尿素循环[35]。氨基酸的一般代谢均包括脱氨基、氮代谢过程,而尿素循环是主要通过排泄氮以维持生命活动的一种代谢方式,因此在氨基酸代谢过程中离不开尿素的参与[36]。此外,由于虾类中还天然存在H2O2[17],因此氧化性也是呋喃西林代谢途径中必须考虑的因素。为确定与这些通路相关的氨基酸与代谢物氨基脲生成之间的关系,实验通过模拟生物代谢进行验证。如图6所示,氨基酸与尿素结合后经H2O2氧化体系处理,精氨酸、丙氨酸、牛磺酸、次牛磺酸、天冬氨酸及D-谷氨酰胺代谢后均不同程度检出氨基脲的存在。其中,牛磺酸和丙氨酸的氨基脲产生量最高,分别达到(72.05±6.5)ng/mL和(59.08±0.10)ng/mL。其次是精氨酸、D-谷氨酰胺,检测量分别为(7.73±1.55)、(7.46±0.11)ng/mL。以上结果表明,受影响代谢通路中相关的氨基酸在尿素及氧化条件下能够产生氨基脲,表明氨基酸在虾生物体循环过程中可能会转化为氨基脲。代谢通路中牛磺酸、丙氨酸、精氨酸和D-谷氨酰胺4 种物质可能是产生氨基脲的关键中间体。这一结果与代谢组学具有一致性,说明虾体内氨基脲的检出与氨基酸代谢途径关系密切。

图6 模拟条件下与代谢组学相关氨基酸的氨基脲转化情况Fig.6 Conversion of amino acids associated with metabolomics into semicarbazide under simulated conditions
3 结论
采用非靶向代谢组学技术对呋喃西林胁迫下克氏原螯虾肌肉组织进行代谢组学分析,并通过体外模拟验证实验证实了与代谢通路相关物质和氨基脲产生之间的联系。结果表明,在不同胁迫时间下,氨基脲及呋喃西林在肌肉组织中的含量具有显著差异,呋喃西林胁迫影响克氏原螯虾的牛磺酸及次牛磺酸代谢和氨基酸代谢途径。通过验证发现,精氨酸、丙氨酸、牛磺酸、次牛磺酸、天冬氨酸及D-谷氨酰胺在尿素结合下氧化后能够产生氨基脲,证实了代谢组学中的结果。在应对呋喃西林抗生素时,动物机体发生氧化应激反应,产生大量自由基,使自身的抗氧化能力下降。与此同时,胁迫后虾的能量代谢紊乱,氨基酸水平发生变化。本研究结果为呋喃西林代谢物氨基脲在甲壳类水产品中的研究提供了一定的方向及理论依据。
