岩藻糖基化胞外多糖降解产物对婴儿肠道菌群的影响
2023-12-14任昕淼肖梦诗南世豪陈伟苗付晓丹牟海津
任昕淼,肖梦诗,南世豪,陈伟苗,李 蓉,付晓丹,*,牟海津,*
(1.中国海洋大学食品科学与工程学院,山东 青岛 266003;2.食品科学与资源挖掘全国重点实验室,南昌大学,中国-加拿大食品科学与技术联合实验室(南昌),江西省生物活性多糖重点实验室,江西 南昌 330047;3.中国海洋大学医药学院,山东 青岛 266003;4.青岛市妇女儿童医院,山东 青岛 266003)
婴儿肠道菌群与婴儿早期发育和后天疾病风险密切相关。新生儿肠道内最初由需氧和兼性厌氧的肠球菌属(Enterococcus)和葡萄球菌属(Staphylococcus)定植,随后严格厌氧的双歧杆菌属(Bifidobacterium)、梭菌属(Clostridium)和拟杆菌属(Bacteroides)开始定植,并逐步成为肠道内的优势菌群[1]。在婴儿0~2 岁间肠道菌群发育的窗口期,婴儿肠道菌群结构受到分娩方式[2]、喂养方式[3]、抗生素的使用[4]、母乳寡糖分泌类型[5]以及各种生存环境因素的影响。不同肠道微生物谱对婴幼儿肠道发育和免疫应答的调节作用不同,并且影响后天过敏反应,肥胖,炎症性肠病、肠易激综合征等代谢紊乱疾病的发生概率[6]。因此,生命早期有益肠道微生物群的构建非常重要。
岩藻糖基寡糖有益生[7]、抗癌[8]和免疫调节[9]等多种生理活性,在食品和药品的开发中受到高度关注。尽管岩藻糖基化是自然界中最常见的糖基化形式之一,但岩藻糖基寡糖的天然丰度非常低[10]。母乳是岩藻糖基寡糖的来源之一,母乳中大于50%母乳寡糖是岩藻糖基化的,包括2’-岩藻糖基乳糖(2’-fucosylactose,2’-FL)、3-岩藻糖基乳糖等,其中2’-FL在母乳寡糖中占比近30%,是母乳中含量最丰富的寡糖之一[11]。作为婴儿营养领域新兴的功能性成分,2’-FL在构建肠道微生物群的重要作用受到广泛认同。研究表明,配方奶粉中添加2’-FL能够选择性增殖婴儿肠道中双歧杆菌等有益菌的丰度,与母乳喂养的婴儿肠道菌群特征相同[12]。肠道有益菌利用益生元产生的各种代谢产物,尤其是短链脂肪酸(short chain fatty acids,SCFAs),是婴儿肠道重要的营养素。
除了母乳来源,岩藻糖基寡糖还可以从富含岩藻糖的动物、植物和微生物多糖中获得,例如含岩藻糖的微生物胞外多糖(fucose-containing microbial exopolysaccharides,FcEPS)[13]。细菌胞外多糖(exopolysaccharides,EPS)由于其新颖特殊的组成结构和高效便捷的生产工艺,受到不少研究人员的关注。近几十年来,不同细菌产生的EPS组成、结构和功能特性也得到了广泛研究。其中,产FcEPS的细菌有上百余种,克雷伯氏菌(Klebsiellasp.)、克拉维杆菌(Clavibactersp.)和肠杆菌(Enterobactersp.)是产FcEPS菌种的丰富来源[14]。克拉维杆菌和肺炎克雷伯菌产生的EPS中,岩藻糖含量超过30%,是比较理想的岩藻糖基寡糖来源之一[15-16]。
商业化的2’-F L 在婴幼儿配方食品中应用有限。目前,婴幼儿配方食品中以低聚果糖(fructooligosaccharide,FOS)和低聚半乳糖(galactooligosaccharide,GOS)等普遍商用益生元作为替代母乳寡糖功能的添加物,但GOS和FOS与母乳寡糖的结构差异大,存在功能的局限性。EPS酸解获得的岩藻糖基寡糖,与岩藻糖基化母乳寡糖具有相似的单糖组成,本研究在体外发酵过程中,比较3 株双歧杆菌和2 株乳酸菌对EPS制备的岩藻糖基化胞外多糖降解产物(degradation products of fucosylated exopolysaccharide,DFcP)的利用和代谢偏好,分析DFcP对婴儿粪便菌群组成和代谢产物SCFAs的影响,旨在为发掘EPS来源岩藻糖基化碳水化合物作为婴儿肠道益生元的功能活性及其未来开发应用提供理论指导。
1 材料与方法
1.1 材料与试剂
长双歧杆菌婴儿亚种ATCC 15697(Bifidobacterium longumsubsp.infantisATCC 15697,后称为婴儿双歧杆菌ATCC 15697)、短双歧杆菌ATCC 15700(B.breveATCC 15700)、长双歧杆菌长亚种ATCC BAA-999(B.longumsubsp.longumBAA-999)美国典型培养物保藏中心;干酪乳杆菌ZX147(Lactobacillus caseiZX147)、植物乳杆菌CGMCC 1.19(Lactobacillus plantarumCGMCC 1.19)、乳酸乳球菌M1(Lactococcus lactisM1)和坂崎肠杆菌M1(Enterobacter sakazakiiM1)由中国海洋大学食品科学与工程学院应用微生物学实验室提供。2~6 月龄婴儿粪便由青岛妇女儿童医院捐赠提供,样品收集过程符合医院伦理要求(审批号QFELL-YJ-2020-27)。
FcEPS由本实验室提供;2’-FL 美国Layer Origin Nutrition公司;Silica gel 60 F254薄层层析色谱(thin-layer chromatography,TLC)板 德国Merck公司;有机酸标准品(甲酸、乳酸、乙酸、丙酸和丁酸(异丁酸和正丁酸))、内标异己酸 美国Sigma-Aldrich公司。
1.2 仪器与设备
RE-52A型旋转蒸发器 上海亚荣生化仪器厂;FD-1A-50+真空冷冻干燥机 北京博医康实验仪器有限公司;DNP-9052电热恒温培养箱 上海精宏实验设备有限公司;LAI-3T-N厌氧培养箱 上海龙跃仪器设备有限公司;1260高效液相色谱系统(配有可变波长紫外检测器)美国Agilent公司;PacBio Sequel II单分子实时测序(single molecule real time sequencing,SMRT)系统美国Pacific Biosciences公司;QuantStudio 3实时荧光定量聚合酶链式反应(polymerase chain reaction,PCR)仪美国Applied Biosystems公司;1510型酶标仪、Sorvall Legend Micro 17低温冷冻离心机 美国Thermo Fisher公司。
1.3 方法
1.3.1 FcEPS的制备
将接种坂崎肠杆菌M1菌株制备的5 L发酵液4 000 r/min离心20 min,上清液于55 ℃旋转蒸发浓缩至1/4体积,加入4 倍体积的无水乙醇过夜醇沉后4 000 r/min离心20 min,沉淀用超纯水复溶,加入1/5体积的Sevag试剂(氯仿∶正丁醇=4∶1,V/V),充分振荡30 min后置于分液漏斗中静置分层,取水相层再加入1/5体积的Sevag试剂,重复操作3 次。上层水相进一步冷冻干燥,获得FcEPS。
1.3.2 DFcP的制备纯化和单糖组成测定
10 g FcEPS用1 L 0.2 mol/L HCl溶液溶解,于80 ℃振荡反应4 h后,冷却后加入6 mol/L NaOH溶液中止酸解反应。酸解中和液(pH 6.5)于55 ℃旋转蒸发浓缩至1/4体积,加入3 倍体积的95%乙醇溶液,4 ℃醇沉过夜,4 000×g离心20 min收集醇沉上清液,旋蒸浓缩后冷冻干燥获得粗DFcP。使用乳酸乳球菌M1发酵脱除可消化性单糖(葡萄糖和半乳糖),发酵条件如下:粗DFcP质量浓度为20 g/L,接菌量为1%,37 ℃培养24 h,获得脱除半乳糖和葡萄糖的DFcP。
FcEPS和DFcP的单糖组成通过1-苯基-3-甲基-5-吡唑啉酮(5-methyl-2-phenyl-4H-pyrazol-3-one,PMP)柱前衍生法测定。2 mg样品溶于2 mL 2 mol/L三氟乙酸溶液中,于110 ℃水解6 h后,按照范斌等[17]的PMP衍生方法和高效液相色谱参数进行单糖组成测定。
1.3.3 益生菌的体外纯培养
MRS肉汤培养基(含有0.5 g/L半胱氨酸盐酸盐)用于体外培养3 株双歧杆菌(婴儿双歧杆菌ATCC 15697、短双歧杆菌ATCC 15700、长双歧杆菌BB536)和2 株乳杆菌(干酪乳杆菌ZX147和植物乳杆菌CGMCC 1.19)。无糖MRS培养基为空白组(CK组),其中酵母提取物和蛋白胨质量浓度分别调整为2.5 g/L和5 g/L。将DFcP和2’-FL以质量分数1%分别添加到无糖MRS培养基中作为DFcP组和2’-FL组,每组设置3 个平行(n=3)。各菌株接种上述培养基,37 ℃体外培养48 h。在体外纯培养的0、12、24、36 h和48 h收集发酵样品。样品冷冻离心后,上清液用于测定DFcP消耗量和SCFAs产量,沉淀用磷酸盐缓冲液涡旋复溶,酶标仪测定OD600nm评价菌株生长情况。
1.3.4 粪便菌群的体外厌氧发酵
用无菌的粪便收集管收集4 名健康婴儿(2~6 月龄)的粪便,于-80 ℃保存。粪便菌群活化和体外发酵的模拟肠道培养基根据Fu Xiaodan等[18]的方法配制。发酵前,婴儿粪便用无菌磷酸盐缓冲液混匀稀释,4 ℃静置15 min,上清液用模拟肠道培养基进行一次活化。体外发酵时,将DFcP、2’-FL以质量分数1%添加到装有50 mL模拟肠道培养基的厌氧瓶中,无糖模拟肠道培养基为空白组(CK组)。4 名婴儿的活化粪便菌液以体积分数2.5%接种到以上培养基中,37 ℃体外发酵72 h。在0、12、36 h和72 h收集所有组的发酵产物,样品冷冻离心后,上清液用于测定寡糖的消耗量和SCFAs产量,沉淀用于DNA提取和16S rRNA基因扩增。
1.3.5 SMRT
36 h粪便发酵液冷冻离心,用DNA提取试剂盒提取菌体沉淀的DNA,利用PacBio公司的sequel II平台进行全长16S rRNA基因测序(北京百迈客生物科技有限公司)。用于扩增16S rRNA 全长V1~V9区的引物为27 F(5’-AGAGTTTGATCCTGGCTCAG-3’)和1492 R(5’-GGTTACCTTGTTACGACTT-3’),PCR产物进行纯化、定量并均一化形成测序文库(SMRT Bell),用PacBio Sequel测序仪进行测序。PacBio Sequel的下机数据通过subreads进行校正得到循环共识测序(circular consensus sequencing,CCS)序列(SMRT Link,version8.0),然后使用lima(v1.7.0)软件,通过barcode序列识别不同样品的CCS并去除嵌合体,得到高质量的CCS。Uparse(v7.0.1001)将具有大于97%相似性的序列修剪分配给相同的操作分类单元(operational taxonomic units,OTU)。Silva数据库(http://www.arb-silva.de/)基于mothur算法用于注释生物分类信息。
使用实时PCR(real-time PCR)对CK组、DFcP组、2’-FL组36 h粪便发酵液(n=4)中双歧杆菌和乳杆菌进行绝对定量。标准品为短双歧杆菌ATCC 15700和植物乳杆菌CGMCC 1.19的基因组DNA。以不同浓度标准品拷贝数的对数(lg(copies/μL))作为横坐标,以real-time PCR过程中到达荧光阈值的初始循环数(Ct值)为纵坐标绘制标准曲线进行绝对定量计算。反应条件、引物序列和计算方法如Gopalsamy等[19]所述。
1.3.6 TLC
纯培养和粪便发酵过程中碳水化合物利用TLC进行评价。使用正丁醇-乙酸-水(3∶2∶1,V/V)溶液作为流动相,苯胺-二苯胺试剂(4 mL苯胺、4 g二苯胺、200 mL丙酮和30 mL 85%磷酸溶液)作为显色剂。
1.3.7 SCFAs的测定
使用配备紫外检测器(G1314F,210 nm)的1260高效液相色谱系统测定纯培养和粪便发酵过程中SCFAs产量。色谱柱为Shodex RSpak KC-811色谱柱(8.0 mm×300 mm,6 μm)。流动相为HClO4溶液(pH 2.1),流速为0.8 mL/min。乳酸、甲酸、乙酸、丙酸和丁酸作为标准品,异己酸作为内标,所有标准品浓度为10 mmol/L。
1.4 数据分析
2 结果与分析
2.1 FcEPS和DFcP的单糖组成
如图1 所示,从阪崎肠杆菌中提取的FcEPS由岩藻糖、葡萄糖、半乳糖、甘露糖和鼠李糖组成((32.81±0.01)%、(32.14±0.01)%、(17.91±0.04)%、(12.49±0.04)%、(4.64±0.03)%),岩藻糖含量丰富。DFcP由岩藻糖((36.64±0.02)%)、葡萄糖((35.84±0.02)%)和半乳糖((21.88±0.01)%)组成,比例约为3∶3∶2,同时含有少量的甘露糖((3.57±0.01)%)和鼠李糖((2.08±0.00)%)。与FcEPS单糖组成相比,DFcP中岩藻糖的物质的量占比增加。购买的母乳来源岩藻寡糖2’-FL是一种由乳糖和岩藻糖通过α-(1,2)-键形成的三糖(Fucα1-2Galβ1-4Glc),由葡萄糖、半乳糖和岩藻糖以1∶1∶1的比例组成。2’-FL作为母乳中含量最丰富的岩藻糖基寡糖,目前已经作为食品添加剂应用于婴幼儿配方食品中。DFcP的单糖组成结果显示,从细菌EPS酸解获得DFcP与2’-FL单糖组成相似,是获得岩藻糖基化碳水化合物的新型来源。

图1 FcEPS和DFcP的单糖组成液相色谱图Fig.1 Chromatograms of monosaccharide composition of FcEPS and DFcP
2.2 DFcP对典型益生菌增殖和SCFAs水平的调控
2.2.1 益生菌对DFcP的利用水平
图2显示各菌株以DFcP为唯一碳源时的生长情况(OD600nm)和碳源的消耗利用情况(TLC)。DFcP促进婴儿双歧杆菌ATCC 15697、短双歧杆菌ATCC 15700和植物乳杆菌CGMCC 1.19的增殖,纯培养12~48 h内OD600nm值均显著高于CK组(P<0.05)。TLC显示2 株双歧杆菌能够快速利用DFcP糖组分,而植物乳杆菌CGMCC 1.19对DFcP的利用率较低。长双歧杆菌BB536和干酪乳杆菌ZX147基本不利用DFcP。所有利用DFcP的菌株中,仅婴儿双歧杆菌ATCC 15697表现出对岩藻糖的快速利用,而其余菌株均无法有效利用岩藻糖。2’-FL于发酵48 h被婴儿双歧杆菌ATCC 15697完全利用,OD600nm值显著高于CK组和DFcP组,接近葡萄糖的促生长能力,但其余4 株益生菌基本不利用2’-FL生长增殖,TLC图谱中2’-FL点基本没有变化。已有体外纯培养验证了2’-FL不增殖大部分乳杆菌和双歧杆菌,但选择性促进婴儿双歧杆菌增殖的能力,与本研究单菌体外厌氧发酵的结果相同[7]。Matsuki等[20]发现,能够利用母乳寡糖强烈增殖的菌株中存在ABC转运蛋白和岩藻糖苷酶基因,表明不同菌株间识别转运含岩藻糖基化碳水化合物的基因和岩藻糖苷酶基因的差异,导致菌株对DFcP不同的利用偏好,使母乳岩藻糖基寡糖表现出特殊的益生活性。DFcP表现出与2’-FL类似的选择性益生效果,有更广谱的益生活性。
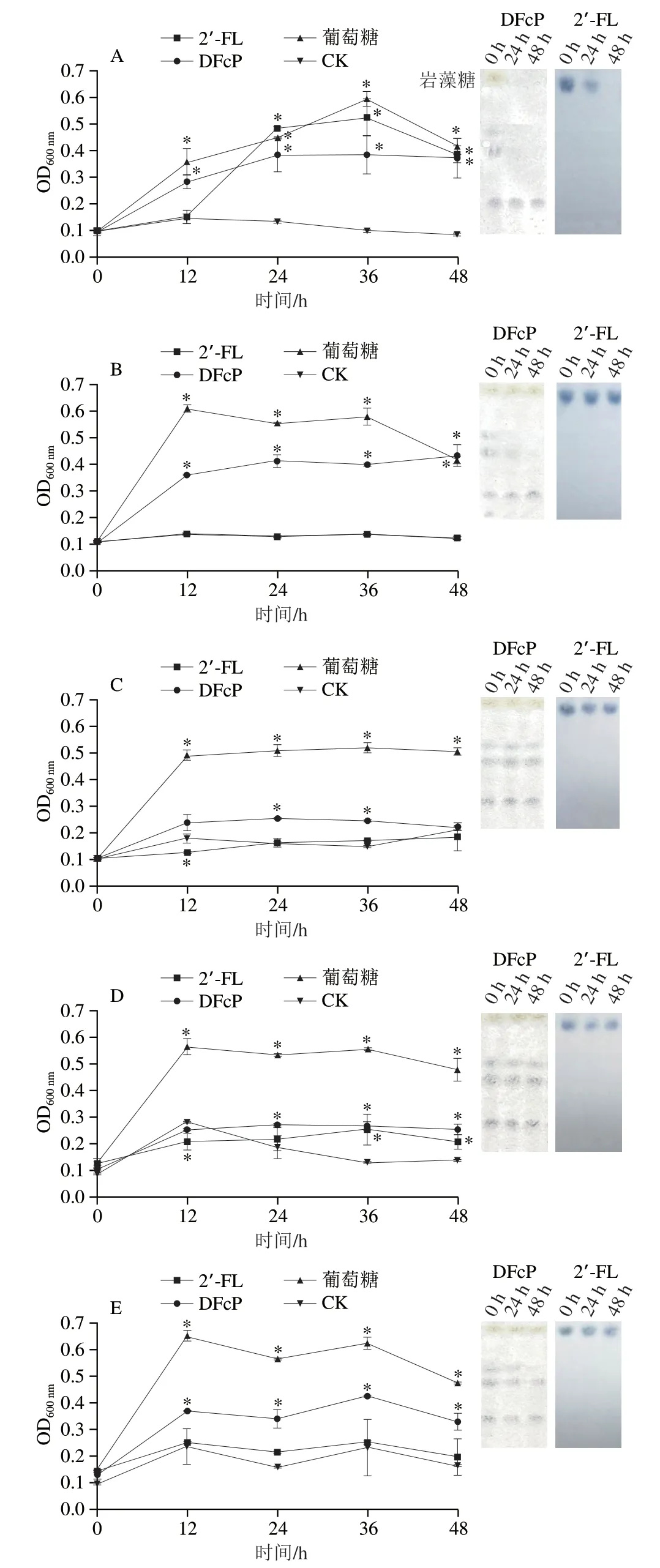
图2 DFcP或2’-FL作为唯一碳源对益生菌生长的影响Fig.2 Effect of DFcP and 2’-FL as sole carbon source on the growth of probiotics
2.2.2 菌株SCFAs产生水平
在体外发酵48 h后,各菌株SCFAs的产生情况如表1所示。益生菌代谢产物SCFAs积累量与寡糖底物的消耗利用度密切相关。DFcP 显著增加了婴儿双歧杆菌ATCC 15697、短双歧杆菌ATCC 15700和植物乳杆菌CGMCC 1.19的产酸量,总酸浓度分别为(49.23±0.12)、(69.32±3.82)mmol/L和(51.99±6.22)mmol/L,但不能促进长双歧杆菌BB536和干酪乳杆菌ZX147产酸,2 株菌的总酸产量均低于10 mmol/L。与DFcP组相比,2’-FL显著促进婴儿双歧杆菌ATCC 15697产生乳酸((20.22±0.10)mmol/L)(P<0.05),表明乳酸盐是婴儿双歧杆菌ATCC 15697代谢2’-FL和DFcP的差异SCFAs。SCFAs的产生水平进一步验证了短双歧杆菌ATCC 15700和植物乳杆菌CGMCC 1.19对DFcP的偏好利用。另外,DFcP促进2 株益生菌产丁酸((2.15±0.19)mmol/L和(3.81±0.45)mmol/L),丁酸盐主要为肠上皮细胞提供能量,是维持肠屏障功能完整和健康的关键物质[21]。观察到乙酸是益生菌利用DFcP和2’-FL的主要产物,在总SCFAs中占比最高,大于40%。据报道,乙酸盐是降低肠道内的pH值,抑制特定病原菌的繁殖重要贡献者,是婴儿肠道早期最重要的SCFAs之一[22]。综合5 株益生菌底物利用和代谢产酸的结果,DFcP促进婴儿双歧杆菌ATCC 15697,短双歧杆菌ATCC 15700和植物乳杆菌CGMCC 1.19的增殖和SCFAs的产生,具有与2’-FL相似的选择性益生活性。
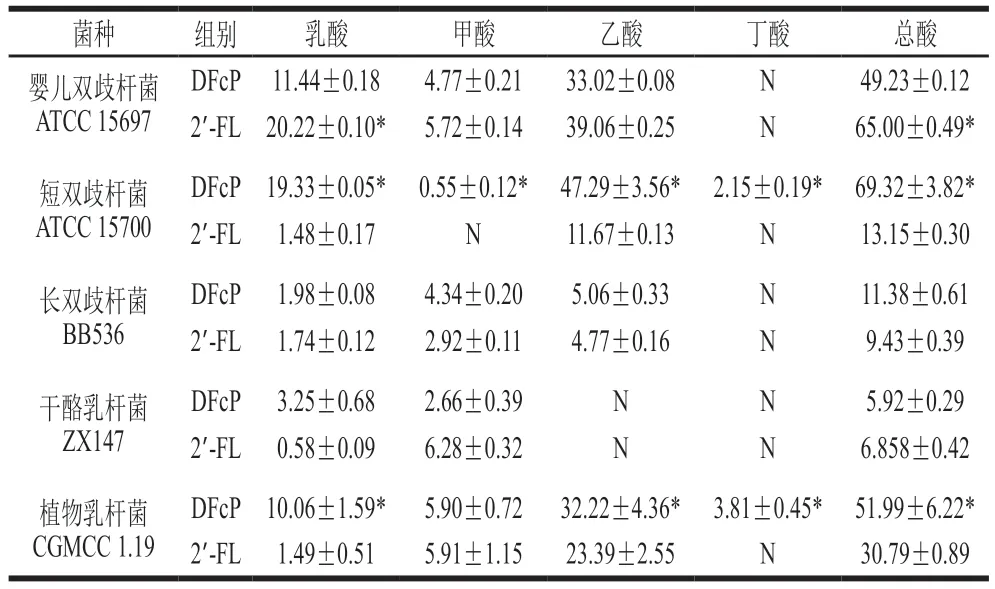
表1 益生菌SCFAs的产生浓度Table 1 Concentrations of SCFAs produced by probiotics cultured in MRS medium with DFcP and 2’-FL as sole carbon sourcemmol/L
2.3 DFcP对婴儿粪便菌群的调控作用
2.3.1 婴儿粪便菌群对DFcP的利用水平
通过体外厌氧发酵,探究DFcP对2~6 月龄婴儿肠道菌群及其代谢产物的影响。通过TLC法评价体外婴儿4 个粪便菌群样本发酵过程中DFcP的消耗情况。如图3所示,36 h后DFcP中岩藻糖和小分子糖组分被充分利用,仅剩余少量大分子质量糖点,而2’-FL的利用程度略低于DFcP,在TLC图谱中观察到2’-FL点颜色明显转浅,但36 h未被菌群完全利用,比较单菌和粪便菌群的TLC结果,DFcP的益生选择性弱于2’-FL,因此在相同底物浓度下,菌群表现出对DFcP的偏好利用。根据TLC图中2’-FL和DFcP的位置,推测DFcP位于2’-FL上方的两个寡糖点聚合度≤3,而位于2’-FL下方的寡糖点聚合度≥3,表明DFcP聚合度小,容易被菌群摄取利用。
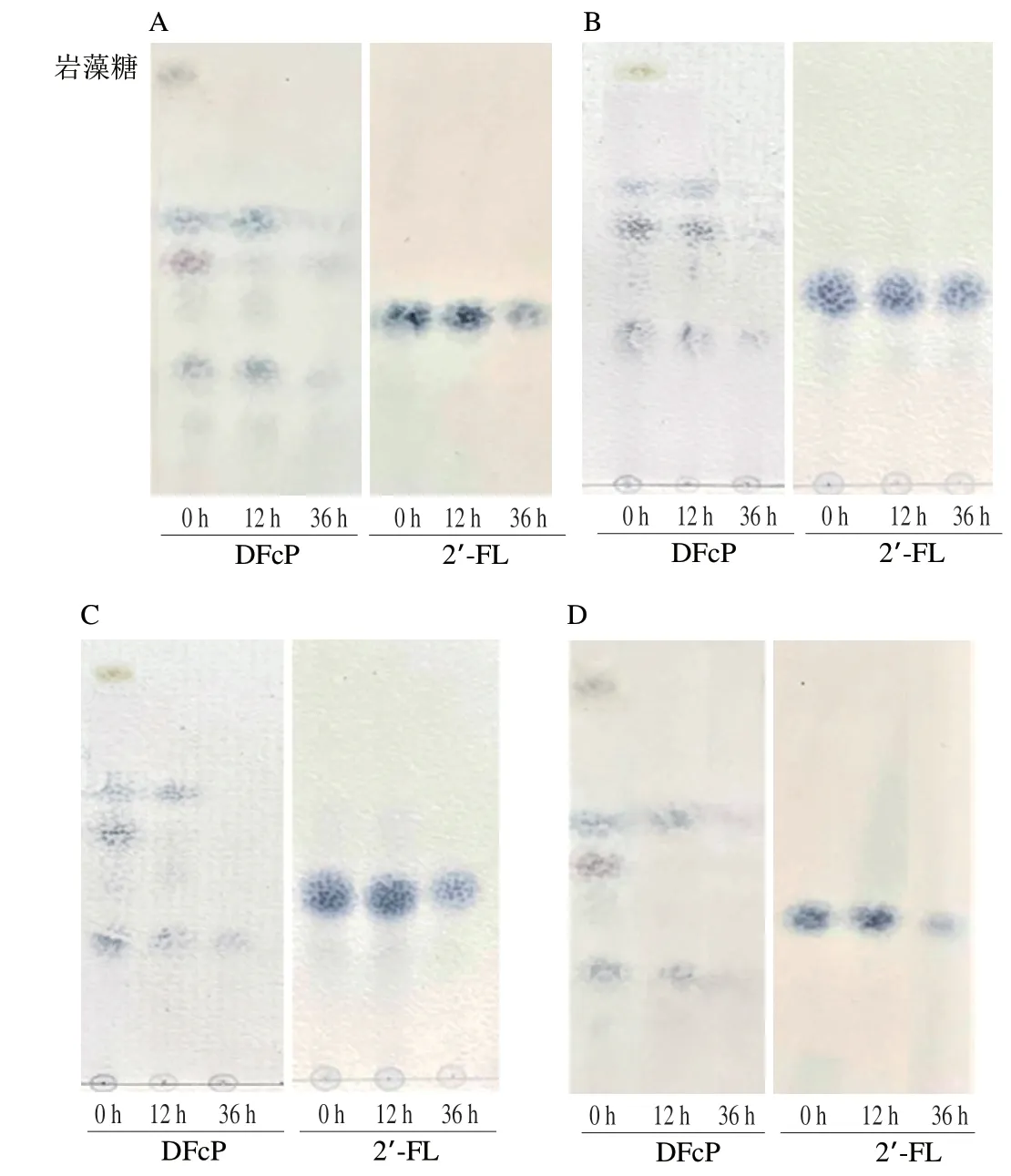
图3 体外婴儿粪便菌群发酵中DFcP和2’-FL的消耗利用情况Fig.3 Consumption and utilization of DFcP and 2’-FL by in vitro infant fecal flora
2.3.2 婴儿粪便菌群SCFAs的产生情况
如图4所示,DFcP组的总SCFAs浓度随发酵时间的延长而增加,且产酸量显著高于2’-FL组(P<0.05)(图4A)。母乳喂养的婴儿中,琥珀酸盐、甲酸盐、乳酸盐和乙酸盐是生命早期(0~6 月龄)肠道主要的SCFAs,其中肠道甲酸盐的增加和菌群对岩藻糖的代谢利用有关,乳酸盐是各种SCFAs的中间代谢产物,乙酸盐在婴儿肠道中占比最高,而丙酸盐和丁酸盐则在婴儿8 个月大后才开始增加[23]。DFcP组总SCFAs浓度为(34.57±5.99)mmol/L,其中,乳酸盐、甲酸盐和乙酸盐分别占比27.4%、33.1%和39.5%(图4B~D)。在2’-FL组中也观察到高水平的甲酸盐和乙酸盐(41.8%和36.8%)含量,表明岩藻糖的代谢提高了菌群甲酸的产量。两种岩藻糖基化碳水化合物能够促进婴儿肠道菌群产生与母乳喂养婴儿(2~6 月龄)肠道类似的SCFAs谱,且由于菌群对DFcP的消耗利用度更高,DFcP对菌群产酸促进作用优于2’-FL。
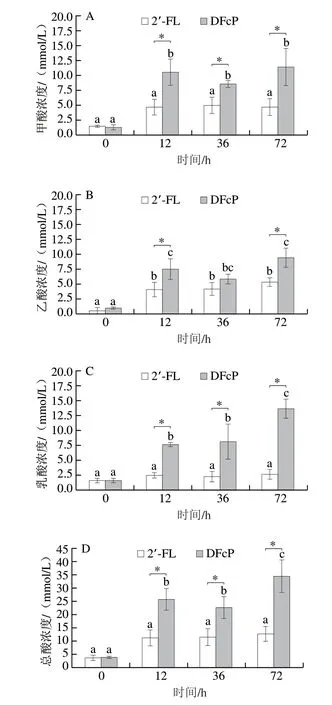
图4 DFcP和2’-FL对粪便菌群SCFAs产量的影响Fig.4 Effect of DFcP and 2’-FL on the production of SCFAs by infant fecal flora in vitro
2.3.3 DFcP对婴儿粪便菌群结构的影响
通过16S rRNA测序检测36 h发酵过程中粪便菌群组成的变化,α和β多样性分析结果如图5所示。在婴儿粪便体外发酵36 h后,与CK组相比,DFcP组和2’-FL组均未观察到Chao指数的显著差异(P>0.05),但2’-FL组的Chao指数显著高于DFcP组,表明2’-FL组物种丰富度更高(P<0.05)(图5A)。与CK组和DFcP组相比,2’-FL组Shannon指数显著升高(P<0.05),表明2’-FL组微生物多样性有所降低(图5B)。主成分分析(principal component analysis,PCA)显示CK组、2’-FL组和DFcP组的菌群组成存在显著差异(ANOSIM检验,R2=0.845,P=0.001)。β多样性分析结果表明,2’-FL和DFcP显著改变了粪便菌群组成,与2’-FL相比,DFcP组与CK组间距离更远,两组间菌群组成的差异更大。
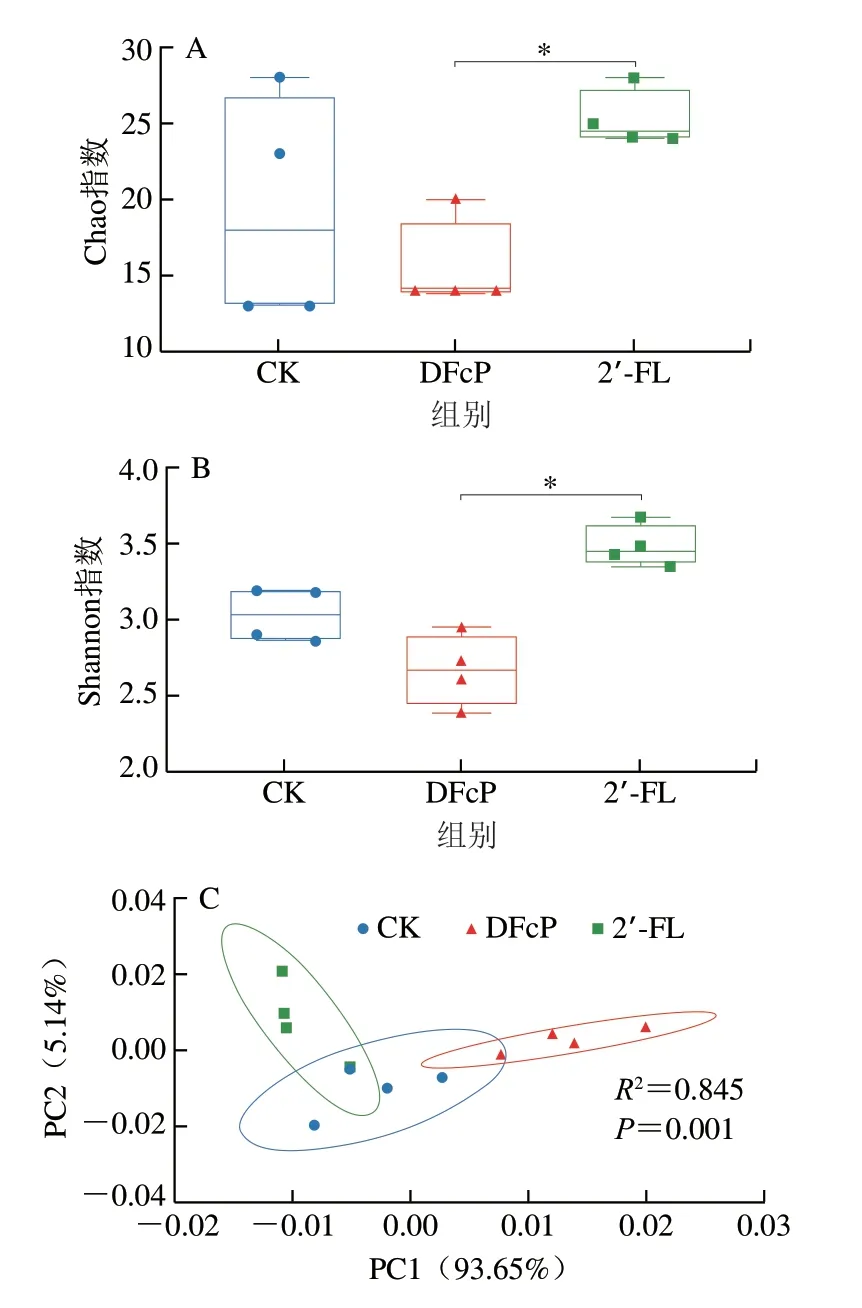
图5 体外发酵36 h婴儿粪便菌群多样性分析Fig.5 Chao index,Shannon index and PCA plot of infant fecal flora at 36 h of in vitro fermentation
门水平上(图6A),婴儿粪便菌群发酵的优势菌门是变形菌门(Proteobacteria),其次为厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes),放线菌门(Actinobacteria)的相对丰度小于1%。变形菌门和厚壁菌门在婴儿肠道中占主导地位,厚壁菌门在母乳喂养婴儿粪便中的比例更高,变形菌门在配方奶粉喂养的婴儿中占比更高[24]。与CK组和2’-FL组相比,DFcP组中变形菌门显著降低(P<0.001),厚壁菌门丰度显著增加(P<0.001),而2’-FL和CK组间无显著差异。

图6 体外发酵36 h婴儿粪便菌群组成分析Fig.6 Compositional analysis of infant fecal flora at 36 h of in vitro fermentation
如图6B所示,属水平上,菌群具有高丰度的兼性厌氧菌,肠杆菌属(Escherichia)和肠球菌属的相对丰度和大于81%,乳杆菌属(Lactobacillus)和双歧杆菌属丰度较低。与CK组相比,乳杆菌属和肠球菌属的丰度在DFcP组中显著增加(P<0.05),肠杆菌属的丰度显著降低(P<0.001)。与2’-FL组相比,DFcP组中肠杆菌属和梭菌属的丰度显著降低(P<0.001),肠球菌属的丰度显著增加(P<0.001),乳杆菌属的丰度上调(图6C)。双歧杆菌属在CK组中检测不到,但在2’-FL和DFcP组中以较低丰度存在。Kuang等[25]比较了中国和其他5 个国家的婴儿粪便菌群组成,美国、加拿大等国家的婴儿主要肠型是A型(放线菌门优势),以双歧杆菌为代表的放线菌门丰度极高,而中国婴儿的肠型均为P型(变形菌门优势)。同时,与新生儿相比,2 月龄中国婴儿的肠道微生物群显著富集了韦荣氏球菌属(Veillonella)、梭菌属、链球菌属、粪杆菌属和乳杆菌属等微生物,而双歧杆菌仅在两月龄婴儿肠道中初步定植(相对丰度<2%)。双歧杆菌的丰度与婴儿肠型有关,本研究4 个婴儿粪便样本中变形菌门和厚壁菌门是主要优势菌门,以双歧杆菌为代表的放线菌门占比较低。表2显示2’-FL和DFcP组中双歧杆菌属和乳杆菌属的绝对定量结果,与CK组相比,2’-FL和DFcP组显著增加了双歧杆菌和乳杆菌属的绝对丰度,与菌群相对丰度的分析结果相符。DFcP显著改变了婴儿粪便菌群组成,上调乳杆菌属和双歧杆菌属等有益菌属的丰度,表明DFcP显著改变了粪便菌群组成。
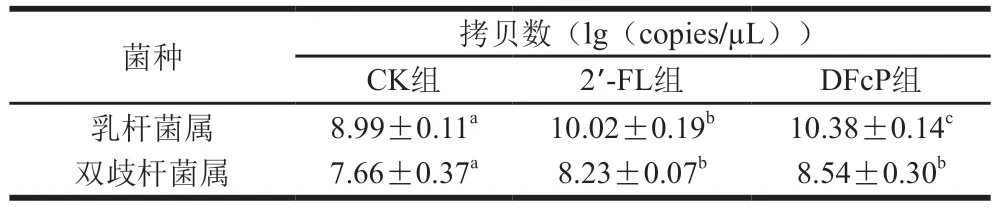
表2 体外发酵36 h婴儿粪便菌群中乳杆菌属和双歧杆菌属的16S rDNA拷贝数Table 2 Number of 16S rDNA copies from Lactobacillus and Bifidobaterium in infant fecal flora at 36 h of in vitro fermentation
通过线性判别分析(linear discriminant analysis,LDA)effect size(LEfSe)比较CK组、2’-FL组和DFcP组的菌群组成,并显示了物种的LDA评分(图6D)。DFcP组和2’-FL组中均有2 个物种丰度差异大(P<0.05)。相比于2’-FL组,DFcP组肠球菌属和乳杆菌属丰度较高,菌群中高丰度的肠球菌属主要由共生菌粪肠球菌组成,乳杆菌属主要由发酵乳杆菌和植物乳杆菌组成,粪肠球菌和乳杆菌作为乳酸菌,其代谢产生的乳酸、乙酸等SCFAs能够降低粪便的pH值,促进婴儿肠道钙、镁、铁和铜等离子吸收并抑制肠道病原体的生长定植[26-27]。肠杆菌属和梭菌属在2’-FL组中显示出更高的丰度。梭菌属在婴儿肠道中与肠球菌科、乳杆菌科共生,其代谢产物,例如丁酸、胆汁酸、吲哚乙酸等有利于肠道健康和免疫[28]。
发酵上清液中SCFAs含量与微生物菌群组成的相关性如图7所示,肠球菌属、乳杆菌属和双歧杆菌属与SCFAs的产生呈正相关(图7A)。Spearman相关性系数证实所有SCFAs与乳杆菌属的丰度均呈显著正相关,与肠杆菌属的丰度呈显著负相关(P<0.05),且双歧杆菌属和肠球菌属的丰度与SCFAs的产生呈正相关(图7B)。其中,乳酸的产生与肠球菌属的增加呈显著正相关(R=0.503,P=0.03)。双歧杆菌属和乳杆菌属是肠道中的代表性有益菌,而肠球菌属则属于典型的乳酸菌,其代谢寡糖产生的乳酸等SCFAs,降低了婴儿肠道pH值,提高了婴儿肠道病原体的定植抗性[29]。

图7 体外发酵36 h SCFAs含量与婴儿粪便菌群的相关性分析Fig.7 Correlation between SCFA concentration and infant gut microbiota at 36 h of in vitro fermentation
通过京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路功能预测分析了DFcP组和CK组之间肠道菌群在功能上的差异(图8)。DFcP组和CK组之间丰度前20的功能基因差异主要富集在代谢通路、环境信息处理和遗传信息处理中。在KEGG代谢通路代谢二级水平上,DFcP组和CK组之间肠道菌群的功能存在显著差异,DFcP组中碳水化合物代谢、核苷酸代谢、脂质代谢、萜类和聚酮类代谢、其他次生代谢产物的生物合成等功能基因的相对丰度显著高于CK组(P<0.05)。DFcP显著增加了菌群中与碳水化合物吸收和代谢相关的功能基因丰度,从而影响了其他辅因子和维生素代谢、氨基酸代谢和能量代谢等功能基因的丰度变化,表明DFcP对婴儿粪便菌群功能基因的显著调节。
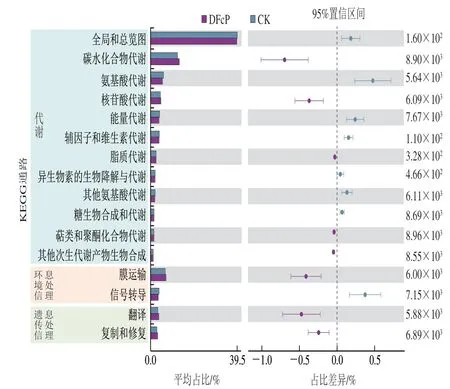
图8 体外发酵36 h婴儿粪便菌群代谢通路富集分析Fig.8 KEGG pathway enrichment analysis of functional differences in infant fecal microbiota between DFcP and control groups at 36 h of in vitro fermentation
3 结论
本实验通过体外模拟发酵体系评估EPS来源的DFcP对婴儿粪便来源菌群的益生活性。DFcP与母乳寡糖2’-FL单糖组成相似,对婴儿双歧杆菌ATCC 15697、短双歧杆菌ATCC 15700和植物乳杆菌CGMCC 1.19具有显著的益生作用,并促进3 株益生菌SCFAs积累((49.23±0.12)、(69.32±3.82)mmol/L和(51.99±6.22)mmol/L )。2’-FL对婴儿双歧杆菌ATCC 15697的显著增殖效果也再次得到验证。在婴儿粪便菌群体外发酵过程(0~72 h)中,DFcP组产生的SCFAs主要是甲酸、乙酸和乳酸。2’-FL和DFcP组中与岩藻糖代谢相关的甲酸盐占比大于30%,表明岩藻糖基化碳水化合物的代谢促进了甲酸的产生。TLC表明DFcP被菌群快速利用,总SCFAs产量显著高于2’-FL组(P<0.05)。DFcP和2’-FL组的菌群组成变化表明两者对婴儿肠道菌群的调节作用,DFcP提高了菌群厚壁菌门的丰度,显著上调乳酸菌肠球菌属和乳杆菌属的相对丰度,并增加了双歧杆菌属的丰度。与商业化的婴儿益生元2’-FL相比,EPS制备的DFcP也显示出对婴儿肠道菌群的调控作用和作为新型益生元的潜力,为进一步开发新型岩藻寡糖资源提供了新的落脚点,为进一步评价不同结构岩藻糖基化碳水化合物在调节生命早期肠道菌群建立及肠道健康发展过程中的作用提供了新的理论基础。
