外泌体miRNAs在糖尿病微血管并发症中的作用研究进展
2023-12-13杨叶虹
刘 滢 张 力 杨叶虹
(复旦大学附属华山医院内分泌科 上海 200040)
糖尿病是由于胰岛素分泌和(或)作用缺陷引起的,以慢性高血糖为特征的一类代谢性疾病。预计到2045 年全球糖尿病人数将从4.63 亿人跃升至7亿人,患病率增长46%[1]。糖尿病已成为全球最常见、发病增长速度最快的慢性病之一。据统计,大约25%的2 型糖尿病患者患有糖尿病肾病和糖尿病视网膜病变,近50%的糖尿病患者会出现糖尿病神经病变[2]。长期慢性高血糖水平可损伤脉管系统,引起微血管并发症,使肾脏、心脏和视网膜等器官发生功能障碍,严重影响患者生活质量,缩短预期寿命。从机制上看,多种机制参与调控糖尿病微血管并发症,包括晚期糖基化终末产物途径、慢性炎症反应、己糖胺途径、多元醇途径和蛋白激酶C 通路激活氧化应激等[3]。此外,高血糖还可能直接刺激生长因子和细胞因子的表达,导致血管损伤和细胞功能障碍[4]。临床上糖尿病微血管并发症的一线治疗仍以药物治疗为主。但多数患者长期服用药物只能延缓疾病进展,且可能出现低血糖、恶心、呕吐、头痛等药物相关不良反应。故迫切需要寻找糖尿病微血管并发症新的诊断工具和治疗靶点。细胞和器官之间的级联信号传递系统在糖尿病微血管损伤中起到重要作用[5]。外泌体(exosome)是内吞体和脂膜内陷形成的纳米级细胞外囊泡(extracellular vesicles,EVs),不仅能通过循环系统介导细胞通讯过程,也能参与炎症和代谢反应诱发全身性疾病[6]。其携带的miRNAs 在体液中能稳定存在,可以囊泡形式经血液循环运输至靶细胞,进而调控受体细胞的病理生理过程。已有多种外泌体miRNAs 被报道参与调控糖尿病微血管并发症的发生发展,是新的诊断标志物和潜在的治疗靶标[7]。本文针对近年来外泌体miRNAs 的概况及其在糖尿病微血管并发症的相关研究进行综述,旨在为糖尿病微血管并发症的临床预防、诊断和治疗提供新依据。
外泌体miRNAs 概况
外泌体miRNAs 的发现和研究现状1981 年,Trams 等首次发现细胞外膜脱落具有5’-核苷酸酶活性的微囊泡,并推测这类膜囊泡可能具有生理功能。随后Pan 和Johnstone 在追踪绵羊网织红细胞成熟过程中发现,转铁蛋白受体释放到细胞外的过程与分泌性囊泡相关,并首次将这类囊泡命名为“exosomes”。随后的研究证明在B 淋巴细胞、T 淋巴细胞以及树突状细胞等多种类型的细胞中,多囊泡体可与溶酶体或自噬小体融合后被降解,或通过与质膜融合向细胞外分泌构成外泌体[8]。外泌体腔内可携带生长因子、DNA、RNA 和蛋白质等多种生物活性物质,广泛存在于几乎所有的生物体液中[9]。
外泌体miRNAs 的生成机制miRNAs 是一类长度约18~24 个核苷酸长度的短链非编码RNA,具有高度保守性,能在转录水平或翻译水平调控基因表达,参与调控炎症反应、氧化应激、血流动力学改变等生理病理过程[10]。在经典miRNAs 合成途径中,编码miRNAs 基因通过DNA 依赖性RNA 聚合酶Ⅱ催化生成初级转录物(primary miRNA transcripts,pri-miRNAs),pri-miRNAs 在细胞核内由RNA 酶Ⅲ Drosha 及其辅助因子Pasha 剪切形成60~110 核苷酸长度的具有茎环结构的miRNAs 前体(precursor miRNAs,pre-miRNA)。再由输出蛋白5(exportin 5,Exp5)将pre-miRNAs 转运至细胞质,细胞质中的Dicer 酶会进一步切割pre-miRNAs形成双链RNA(即miRNA/miRNA duplex)。哺乳动物体内,一条miRNA 能与Argonaute(Ago)蛋白结合形成RNA 诱导沉默复合物(RNA induced silencing complex,RISC)。通过miRNA 与mRNA的序列匹配,RISC 复合体结合到目标mRNA 的3’端非翻译区诱导基因沉默[11](图1)。在细胞外或循环系统中,miRNAs 已被证实可存在于唾液、血液和尿液等体液中,其中由外泌体脂质双层包裹的miRNAs 可保护其免受体液中RNA 酶的降解,直接递送至远端的靶细胞对mRNA 靶标进行功能调节。多项研究表明外泌体miRNAs 与糖尿病、心肌梗死和恶性肿瘤等多种疾病密切相关,有望作为早期诊断和预后治疗的生物标志物[12-13]。
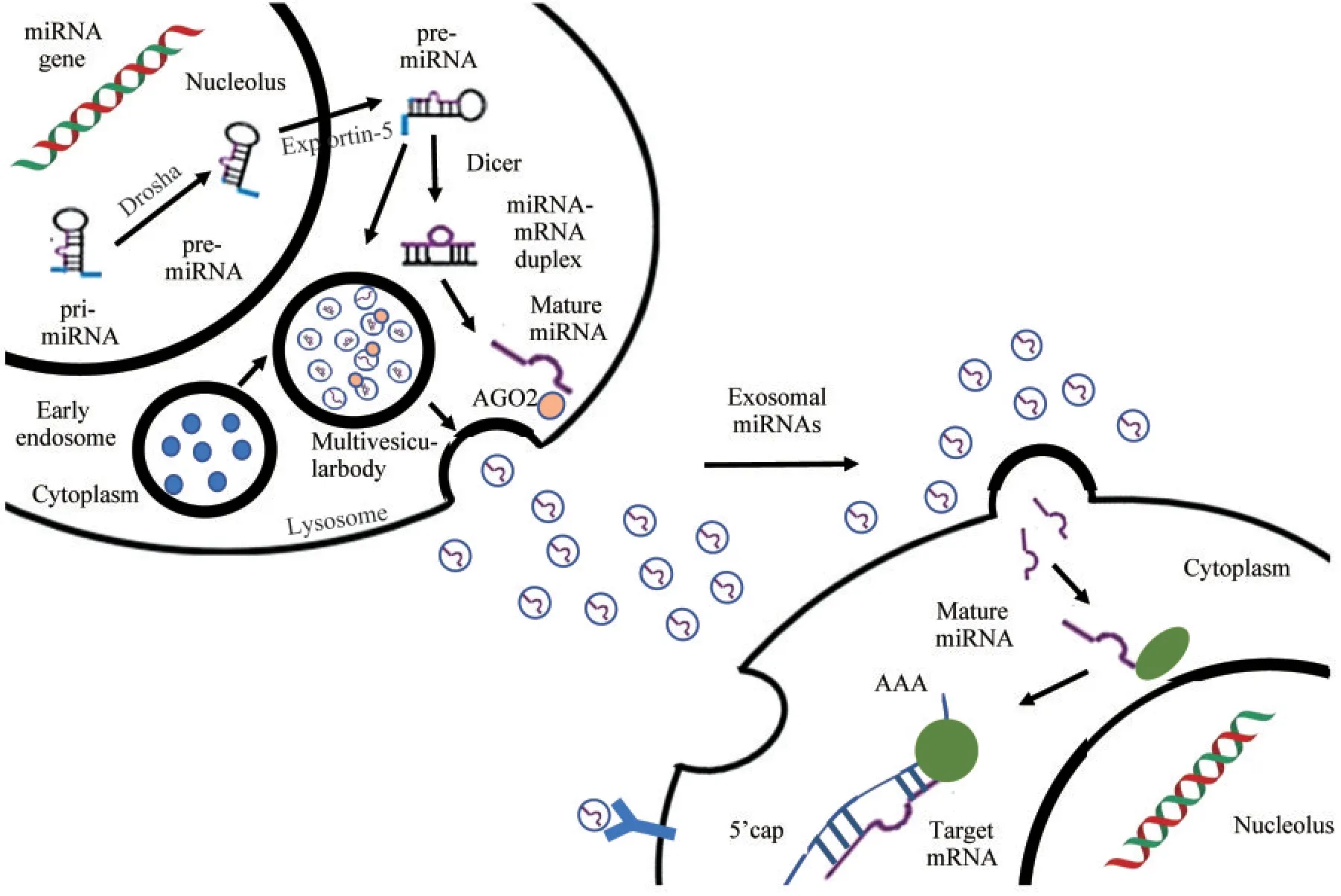
图1 外泌体miRNAs 的生成、分选和分泌过程Fig 1 Process of biogenesis, sorting and secretion of exosomal miRNAs
外泌体miRNAs 的分选机制miRNAs 在EVs核酸中的比例高于其亲代细胞,且外泌体miRNAs的表达水平在不同的病理生理条件下发生改变,说明miRNAs 是主动装载到外泌体中[14]。目前研究指出miRNAs 可以通过4 种途径分选进入外泌体:第一,中性鞘磷脂酶2(nSMase2)依赖性途径。nSMase2 是第一个被发现与包装外泌体miRNAs相关的分子,其过表达会上调外泌体中miRNAs 的含量,表明nSMase2 依赖性通路与外泌体中miRNAs 的分类有关[15]。第二,miRNAs诱导RISC(miRISC)相关途径。在人类细胞中miRISC中AGO2蛋白能与miRNAs 5’端的U 碱基或A 碱基结合,调控外泌体中miRNAs的分泌类型或丰度。敲除AGO2基因可降低HEK293T细胞释放的miR-142-3p、miR-150 和miR-451 等外泌体miRNAs 的含量[16]。第三,核异质核糖核酸蛋白(hnRNPs)依赖性途径。研究表明类泛素化修饰(small ubiquitin-related modifier,SUMOylation)的hnRNPA2B1 能识别特定的miR-185 3’端GGAG 和GGCU 碱基序列,使miRNAs 包裹进外泌体中[17]。第四,miRNAs 3’端序列依赖性途径。在正常细胞中存在两种外泌体miRNAs,经尿嘧啶化修饰的miRNAs 或经腺苷酰化修饰的miRNAs,其中经腺苷酰化修饰后的miRNAs分泌囊泡更为富集;而在肿瘤组织中,外泌体中主要携带尿嘧啶化修饰的内源性miRNAs[18]。以上两种修饰方式表明miRNAs 3’端携带关键的分选信号,可经尿嘧啶化修饰或者腺苷酰化修饰后组装到外泌体中。
外泌体miRNAs 的功能和应用一方面,外泌体miRNAs 能抑制翻译或诱导靶mRNA 降解。人肺癌细胞系A549 细胞、H460 细胞和Calu-1 细胞均分泌miR-619-5p,而上调的miR-619-5p 靶向抑制血管内皮细胞内的钙调磷酸酶调节因子1.4(regulator of calcineurin 1.4,RCAN 1.4),诱导肿瘤细胞血管生长促进肿瘤远处转移[19]。脂肪细胞衍生的外泌体miR-27a 和脂肪组织内巨噬细胞衍生的miR-155 通过靶向抑制PPARγ 通路导致肌细胞胰岛素抵抗[20-21]。另一方面,外泌体miRNAs 可通过调控p53信号通路、凋亡通路和Toll 样受体家族蛋白等通路参与免疫反应,如源自肺腺癌细胞的外泌体miR-125b 可调控p53 信号通路介导巨噬细胞复极化,从抗炎的M2 型巨噬细胞转向促炎和抗肿瘤的M1 型巨噬细胞[22]。黑色素瘤细胞分泌的外泌体miR-125b-5p 靶向溶酶体酸性脂肪酶A(LIPA),可增加肿瘤相关巨噬细胞M1 表型标志物白细胞介素1β(IL-1β)、CC 趋化因子家族中CCL1、CCL2 和免疫球蛋白超家族CD80 的表达[23]。相比于直接释放到循环系统中的miRNAs,双层脂质封装的外泌体miRNAs 更为稳定,在疾病诊断和治疗上具有广阔的应用前景。例如前列腺癌、乳腺癌和口腔鳞状细胞癌中外泌体miR-1246 的表达与肿瘤病理分级、远处转移和预后不良密切相关[24]。Zheng 等[25]还建议将血浆外泌体miR-30d-5p 和let-7d-3p 作为宫颈癌非侵入性筛查的标志物。有研究报道外泌体miRNAs 作为新型疗法有望参与肿瘤治疗,如以肿瘤细胞来源的外泌体为载体将miR-155 递送到树突状细胞,上调MHCII(I/A-I/E)、CD86、CD40、CD83、IL-12p70、IFN-γ 和 IL-10 的表达水平,促进树突状细胞成熟,改善肿瘤细胞的免疫功能[26]。
外泌体miRNAs 在糖尿病微血管并发症中的相关研究1 型糖尿病(T1DM)和2 型糖尿病(T2DM)可对机体多个器官的微血管系统造成损伤,且长期高血糖引起的微血管并发症是糖尿病患者致死和致残的重要原因。2017 年美国内分泌协会指出,尽管T1DM 和T2DM 的发病机制不同,但他们都存在长期慢性的微血管损伤和功能障碍[27]。高血糖是造成糖尿病微血管并发症的主要危险因素。典型微血管病变包括糖尿病肾病(diabetic nephropathy,DN)、糖尿病视网膜病变(diabetic retinopathy,DR)和糖尿病周围神经病变(diabetic peripheral neuropathy,DPN)。多项研究表明糖尿病微血管并发症的发生、发展和转归,与外泌体miRNAs 的种类和功能密切相关[28],可作为糖尿病微血管并发症诊断的分子标志物或潜在治疗靶点(图2)。

图2 外泌体miRNA 调控糖尿病微血管并发症的分子机制Fig 2 Molecular mechanism of exosomal miRNAs regulation of diabetes microvascular complications
糖尿病肾病DN 是糖尿病患者最常见的微血管并发症,早期无明显临床症状,若未及时干预,晚期可发展为终末期肾病。肾活检是目前诊断DN 的金标准,但由于该技术属于侵入性操作且检查成本较高,并不适用所有的糖尿病患者[29]。鉴于外泌体的双层脂膜结构能有效保护其装载的内容物避免miRNAs 降解,因此尿外泌体miRNAs 可用于分析DN 患者的临床特征。杜鹏举等[30]采集了168 例T2DM 患者尿液进行外泌体鉴定,结果显示早期DN 患者尿外泌体miR-129 表达降低,尿高迁移率族B1 蛋白(HMGB1)水平升高,miR-129 的表达与尿HMGB1 水平、尿蛋白/肌酐比值呈负相关性,和肾小球滤过率呈正相关性(P<0.05),联合检测尿外泌体miR-129 和HMGB1 的水平对于早期DN 患者的诊断具有潜在价值。在晚期接受腹膜透析治疗的DN 患者血清外泌体中,miR-301a 是主要差异表达的miRNA。高表达miR-301a 的患者在临床上发生心血管事件风险增加,推测外泌体miR-301a 可能通过调控炎症因子诱发心血管风险事件[31]。取DN 患者的尿液进行二代测序发现,T2DM 患者尿液中有72 个差异表达的外泌体miRNAs,miR-188-5p 上调水平最高[32]。体外细胞实验进一步证实高糖诱导miR-188-5p 分泌,通过PTEN/PI3K/Akt 通路促进人近端肾小管细胞系HK-2 细胞发生上皮间充质转化,损伤肾小管功能,诱发肾纤维化[33]。
除了干扰PI3K/Akt 通路,外泌体miRNAs 还能调控转化生长因子-β(TGF-β)信号通路促进或延缓糖尿病肾纤维化的发生发展。miR-21 和miR-433是糖尿病肾病中常见的两种促纤维化miRNAs,与糖尿病肾病患者纤维化严重程度和肾功能损伤呈正相关。从机制上看,这两种miRNA 可下调Smad7、PTEN、PPARα等抗纤维化基因,从而加重糖尿病肾纤维化进程;此外,miR-Let-7 和miR-29 等细胞外囊泡包裹的抗纤维化miRNAs 也能通过靶向TGFR1、TGF-β2、胶原蛋白等促纤维化基因,负向调控TGF-β1/Smad3 信号通路以延缓肾纤维化进展[34]。另有研究指出尿外泌体miR-30a-5p 与餐后血糖水平以及糖尿病患者肾小球滤过率下降正相关。生物信息学预测发现受高血糖和氧化应激调控的miR-30a-5p 可参与调控泛素-蛋白酶体信号通路和嘌呤代谢过程,加重糖尿病肾损伤[35]。Tsai等[36]检测了db/db 小鼠尿液和T2DM 患者尿液中的EVs 发现,在EVs 中miR-15b-5p 的水平较高,且高表达的miR-15b-5p 与尿白蛋白和肌酐比值升高相关。体外模型进一步证实,高糖刺激的miR-15b-5p通过靶向抗凋亡因子Bcl-2 诱导肾小球系膜细胞凋亡,表明miR-15b-5p 可能是DN 进展的关键因素。
此外,外泌体miRNAs 还能通过促进炎症反应、细胞焦亡、内质网应激加重DN 进程。Gao 等[37]发现miR-4449 在糖尿病肾病患者的血清外泌体中富集,miR-4449 靶向抑制癌高甲基化基因1(HIC1),增加肾小管上皮细胞ROS 水平,上调促炎细胞因子IL-1β、IL-18 的表达并促进细胞焦亡。2023 年有研究发现,高葡萄糖刺激近端肾小管上皮细胞分泌miR-92a-1-5p,随后该外泌体miR-92a-1-5p 被肾小球系膜细胞摄取,在系膜细胞中抑制Reticulocalbin-3(RCN3)的表达,进而诱导内质网应激和上皮间质转分化,加重糖尿病肾损伤[38]。
糖尿病视网膜病变DR 是严重的微血管并发症,也是造成糖尿病患者失明的主要原因。血管损伤初期视网膜细胞受损、新血管生成、炎症反应以及氧化应激等导致患者视力下降[39]。病变后期,持续高血糖环境导致几乎所有类型的视网膜神经细胞发生结构和功能的改变,血-视网膜屏障完整性丧失,微血管的通透性增加、血流量减少甚至出现闭合,最终使视网膜微血管细胞结构完全破环,导致患者出现严重的视力障碍甚至失明[40]。众多学者近年来致力于寻找更有效的生物标志物,期望用来监测和治疗DR。目前多种外泌体miRNAs,如miR-3197、miR-2116-5p、miR-152、miR-34a,被鉴定为直接参与调节DR 的特异性生物标志物[41-42]。
Zeng 等[43]发现DR 患者血液中的外泌体miR-29b-3p 可与SIRT1 的3’-UTR 直接结合,上调的miR-29b-3p 会降低SIRT1 的表达并增加Bax/Bcl-2的比值,促进人视网膜微血管内皮HRMEC 细胞凋亡,造成视网膜损伤;使用miR-29b-3p 抑制剂SRT1720 可以上调SIRT 1 蛋白的表达,减轻高糖条件诱导的促凋亡作用。Maisto 等[44]报道血液中葡萄糖浓度升高会增加视网膜感光细胞内血管内皮生长因子(VEGF)的水平,同时降低感光细胞和外泌体中抗血管生成miRNAs,如miR-106a-5p、miR-20a-5p 和 miR-20a-3p 的表达。 体外转染上述miRNAs 后,HUVEC 细胞内管状毛细血管结构和血管分支点增多促进血管生成。最新研究报道称Müller 胶质细胞来源的外泌体miRNA-9-3p 在高糖条件下会导致视网膜血管功能障碍。这是由于外泌体miRNA-9-3p 被转移到视网膜内皮细胞后与1-磷酸鞘氨醇受体S1P1序列结合,经AKT/ERK 通路促使 VEGFR2 磷酸化,进而促进人原代视网膜内皮细胞的增殖、迁移和血管形成[45]。
此外内皮间质转化也能参与DR 的病理性纤维化过程。在高糖刺激下,视网膜色素上皮细胞分泌的外泌体通过转移miR-202-5p 作用于TGF /Smad信号通路,调控HUVEC 细胞的生长和迁移,抑制内皮间质转化过程[46]。也有研究指出间充质干细胞(MSCs)分泌的外泌体miRNAs 可有效缓解DR 中的肾小管上皮细胞EMT 和血管形成[47]。在链脲佐菌素诱导的糖尿病视网膜病变大鼠模型中,MSCs分泌的EVs 使大鼠视网膜中miR-18b 的表达升高,miR-18b 通过靶向丝裂原激活蛋白激酶激酶激酶1(mitogen-activated protein kinase kinase kinase 1,MAP3K1)抑制NF-κB p65 磷酸化,减轻视网膜炎症反应并减少HUVEC 细胞凋亡进而缓解DR,为DR的防治提供了新策略[48]。Safwat 等[49]在DR 兔模型中揭示MSC 衍生的外泌体miR-222 与视网膜的再生变化密切相关,指出外泌体miR-222 在视网膜组织修复过程中起重要的作用。因此,在未来DR 治疗中有望通过外源性增加人体内某些外泌体miRNAs 的含量来改善视网膜相关细胞的状态。
糖尿病周围神经病变一半以上的慢性糖尿病患者后期会出现周围神经病变,据估计到2030 年全世界将有近50 亿人患有DPN。DPN 的症状因疾病的不同阶段而异,早期患者主要表现为疼痛和痛觉过敏,随着疾病的进展患者逐渐出现肌肉无力、麻木和足部溃疡等。除了负担昂贵的医疗费用,DPN 患者长期自觉身体不适也会导致抑郁和焦虑发作,肢体溃疡和截肢的概率较高,整体生活质量较差[50]。临床研究发现控制血糖水平只能延缓DPN 进展,故亟需寻找有效疗法减轻DPN 相关的外周神经系统损伤。Jia 等[51]报道过表达的miR-28、miR-31a 和miR-130a 源自高糖刺激的施万细胞向外分泌,分泌出来的miRNAs 可与背根神经节(Dorsal Root Ganglion,DRG)的轴突进行细胞间通讯。若向糖尿病db/db 小鼠的坐骨神经局部注射外泌体miR-28、miR-31a 和miR-130a 后,外泌体miRNAs 可调节DNA 甲基转移酶-3α(DNMT3A)、突触体相关蛋白25(SNAP25)、内吞衔接蛋白NUMB 以及轴突中生长相关蛋白43(GAP43)的表达,减慢神经传导速度,诱导机械痛和热痛感觉减退,加重周围神经病变的发生发展。在T2DM db/db 小鼠模型中注射施万细胞分泌的外泌体后,miR-21、miR-27a 和miR-146a 表达增加,促进糖尿病小鼠DRG 的轴突生长,改善坐骨神经传导速度,增加热痛和机械痛的敏感性[52]。此外,MSCs 分泌的外泌体还可以修复受损的神经元和星形胶质细胞,逆转神经功能障碍。在大鼠DPN 模型中,源自间充质干细胞的外泌体miR-221、miR-17 和miR-23a 能负向调控NF-κB 信号通路、晚期糖基化终产物受体(RAGE)和细胞因子信号转导抑制分子3(SOCS3)的表达,下调前列腺素E2、IL-6、IL-1β 和TNF-α 等促炎介质的水平,缓解DPN 大鼠的神经血管功能障碍[53-54]。以上结果证实外泌体miRNAs 有望作为糖尿病神经损伤的有效治疗靶标。
外泌体miRNAs 在糖尿病微血管并发症治疗的应用外泌体运输功能性miRNAs 是细胞间信息通讯的重要途径之一。相比于传统的基因载体,外泌体作为运载体具有独特的生物学优势:(1)作为细胞来源的纳米级膜囊泡,外泌体具有低免疫原性;(2)外泌体的生物相容性结构使其更容易进入细胞,高效提高基因传递效率;(3)外泌体外膜坚硬,可有效保护囊泡内容物,避免溶酶体吞噬外泌体降级其包裹的生物活性物质,在体液中具有良好的耐受性;(4)定向归巢,修饰后的外泌体可用于靶向递送实现组织或细胞特异性分布[55-58]。近年来,将miRNAs、miRNAs 激动剂或抑制剂等靶向分子加载到EVs 和外泌体中,或筛选出天然富含某些miRNAs 的外泌体,再运送到特定的细胞(如人视网膜内皮细胞、足细胞和成纤维细胞)的相关研究表明,外泌体递送miRNAs 系统对非小细胞肺癌、阿尔茨海默病等多种疾病具有潜在的治疗作用,是下一代药物输送系统的研究热点,也是治疗糖尿病微血管并发症的新策略。
研究表明用骨髓间充质干细胞衍生的外泌体治疗可增加miR-146a 的表达,减少大脑中星形胶质细胞的炎症,从而导致突触形成,改善糖尿病引起的认知障碍[59]。Huang 等[60]在糖尿病大鼠足缺血模型中证实,过表达人MSCs 来源的外泌体miR-21-5p具有显著的促血管活性。外泌体治疗处理14 天后,数字减影血管造影术分析显示相比对照组,注射外泌体miR-21-5p 后大鼠缺血后肢新生血管数量增加3 倍,血管密度明显提高。体外实验进一步揭示外泌体miR-21-5p 通过上调VEGF 受体,激活AKT 和MAPK 信号通路促进血管生成,是用于治疗糖尿病足的新的潜在生物标志物。Yan 等[61]通过电穿孔法负载牛奶来源的外泌体miR-31-5p(mEXO-31),体内实验证实mEXO-31 在内皮细胞表达上调,通过下调靶基因缺氧诱导因子1 亚基α 抑制剂(HIF1 AN)的表达促进糖尿病伤口的愈合过程;在糖尿病小鼠背部伤口模型中mEXO-31 能使伤口再上皮化、诱导胶原和血管生成,显著加快糖尿病伤口愈合。以上研究结果为基于外泌体递送的miRNAs 疗法在糖尿病微血管并发症中的临床应用提供了实验基础。
然而,外泌体miRNAs 应用于实际临床治疗仍存在一些问题。第一,外泌体分离、纯化和鉴定方法尚未达到成熟水平。目前多采用差速离心、密度梯度离心、尺寸排阻色谱法、超滤法、聚合物沉淀法和免疫亲和法等方法收集外泌体[62]。但是由于外泌体粒径较小且与多种其他生物分子混合在一起,其分离纯化困难。如超高速离心分离出的外泌体通常会含有蛋白质和脂蛋白;超滤法过滤后可能会导致堵塞,缩短外泌体的寿命降低分离效率,甚至可能影响下游机制分析。第二,若将外泌体作为治疗方法,目前急需解决的问题是治疗性外泌体miRNAs 的产量低,装载效率低。如前所说牛奶来源的外泌体囊泡构建药物递送平台的新技术可能会解决外泌体产量低的问题[61]。第三,天然未经过工程化改造的外泌体靶向性不足,进入体内容易被非靶细胞快速摄取,导致外泌体治疗药物半衰期短,降低治疗效率。尽管目前出现多种增强外泌体靶向性的方法,仍急需开发新技术拓展携带miRNAs 的外泌体囊泡。多项体外研究发现MSC衍生的外泌体miRNAs 对胰腺癌、黑色素瘤、糖尿病等疾病治疗效果突出。 但有关MSC 衍生的miRNAs 的制备标准、保存运输、供体来源等关键问题还需解决。相信随着外泌体运载非编码RNAs 研究的深入,有望开发出更准确、高效、标准化的外泌体miRNAs 分离纯化技术,外泌体miRNAs 也将在糖尿病微血管并发症的预防、诊断和治疗中发挥巨大价值。
结语外泌体和外泌体内容物可作为糖尿病微血管并发症的生物标志物,但其机制尚未完全明确。外泌体具有良好的生物相容性,能穿过生物屏障,且其双层脂膜保护miRNAs 免受RNA 酶降解,显著增加miRNAs 的稳定性。近年来众多学者逐渐转向外泌体miRNAs 与糖尿病微血管并发症的诊断、监测和治疗的研究。虽然外泌体miRNAs 在糖尿病微血管病变中的研究是该领域的热点,但特异性miRNAs 的分选、装载、转运及对受体细胞的调控机制仍需进一步探究。随着生命科学的发展,外泌体miRNAs 将为糖尿病微血管并发症的预防、诊断和治疗带来新的策略。
作者贡献声明刘滢 文献查阅,制图,论文构思、撰写和修订。张力 综述修订和审校。杨叶虹 综述构思、修订和审校。
利益冲突声明所有作者均声明不存在利益冲突。
