兔膀胱出口部分梗阻解除后膀胱功能和细胞超微结构的改变
2023-12-13程姜铤林文耀张思弘许培榕黄嘉琪何敏坷李耀辉
程姜铤 林文耀 张思弘 许培榕 黄嘉琪 何敏坷 李耀辉 程 捷 王 杭△
(1复旦大学附属中山医院泌尿外科 上海 200032; 2上海市徐汇区中心医院泌尿外科 上海 200032;3上海市闵行区中心医院泌尿外科 上海 201100)
老年人群中的良性前列腺增生(benign prostatic hyperplasia,BPH)是膀胱出口梗阻的常见诱因。据统计,BPH 在60 岁以上老年男性中,良性前列腺增生的发生率高达50%,至80 岁时,其发生率可达80%[1]。第七次全国人口普查结果显示:65岁及以上人口为1.9 亿人,占总人口的13.50%,较第六次人口普查增加4.63%。随着社会人口的老龄化,老年性疾病成为人们关注的焦点之一。
膀胱出口部分梗阻(partial bladder outlet obstruction,pBOO)是临床上BPH 常导致的继发疾病,长时间的pBOO 容易发生逼尿肌功能障碍,继而引起相应临床症状。目前治疗BPH 的主要方法为解除膀胱出口的梗阻,往往会忽视对逼尿肌功能障碍。据报道,约50%的BPH 患者合并膀胱不稳定,其中约30%的患者由于长期梗阻造成的逼尿肌功能障碍,在接受治疗后临床症状不能有效缓解[2],因此成为治疗上的难点。学界仍缺乏对此过程中逼尿肌超微结构变化的深层次探究,因此在临床实践中依旧缺乏恢复长时间梗阻后膀胱功能的有效治疗手段。
新西兰雄性白兔膀胱构造同人体具有一定相似性,在既往研究中多次用于pBOO 模型的构建,以研究长期梗阻之后逼尿肌功能变化。在本次研究中,我们应用新西兰雄性白兔建立pBOO 动物模型,在梗阻一定期限后解除梗阻,进行膀胱逼尿肌功能学与形态学实验,以探讨继发于pBOO 后逼尿肌超微结构的变化,从微观层面解释其功能学的变化。
材 料 和 方 法
实验动物分组依据随机分组原则,将情况相近的24 只新西兰雄性白兔随机分为3 组(对照组、梗阻2 周组、梗阻解除组)。实验动物由复旦大学附属中山医院动物房提供,实验兔平均体重约为3 kg。对照组仅进行假手术操作,即仅打开和缝合下腹部,其余两组实验动物均制成pBOO 动物模型,梗阻组在梗阻2 周后处死,梗阻解除组梗阻2 周后解除梗阻并继续饲养3周。
建立pBOO 动物模型[3]利用戊巴比妥(10 mg/kg)试剂麻醉雄性新西兰兔,将其固定于实验操作台。于下腹部做耻骨上正中切口,暴露雄兔膀胱及颈部结构。用周长为2 cm 的1-0 丝线圈套结扎膀胱颈口,构建pBOO 动物模型。手术结束后,将切口分两层逐步缝合,将实验兔送入动物房饲养。2 周后,依据前述步骤沿原手术入路再次暴露雄兔膀胱颈,拆除膀胱颈部的结扎线,随后缝合手术切口。
兔膀胱容量和重量的测定在戊巴比妥麻醉状态下对实验兔进行膀胱容量测试。将8F 导尿管插入膀胱后,持续以50~60 cm H2O (1 cm H2O=0.098 kPa,下同)的压力灌注生理盐水。待导尿管发生溢尿时,记录此刻的生理盐水灌注量并将其视为膀胱最大容量。在测定完毕后处死实验兔,打开下腹并取出膀胱,剔除膀胱周围脂肪组织和结缔组织,将其置于天平上称量。
逼尿肌超微结构的观察和测量取膀胱体部的逼尿肌组织,于4 ℃中制成多个1 mm×1 mm 的小块,使用2.5%戊二醛溶液固定标本。使用透射电子显微镜(型号:PHILIPS CM 120)于6×103倍和2×104倍下分别观测内质网和线粒体。使用Imagine Too 对电镜图像进行分析,最高密度设定为255,最低密度设定为0。对每个视野单位内细胞核周围的粗面内质网的面积进行观测,连续测量5~7个视野。内质网测量完毕后将放大倍数切换至2×104,于不同的视野下取15 个线粒体,并在这些线粒体结构中选择20 个观测点,测量观测点中的线粒体平均密度。于细胞质中选择60 个观测点计算细胞质平均密度,将线粒体平均密度除以细胞质平均密度,计算得到线粒体的相对密度,借此来排除曝光时间对线粒体密度测量造成的误差。
膀胱逼尿肌束的收缩实验将兔膀胱标本纵向剖开,并于输尿管嵴上方切取长约1.0 cm、宽约0.2 cm 的两条纵向逼尿肌束。将肌束浸泡于Tyrode 缓冲液中,用95%O2与5%CO2混合气体平衡。将张力换能器同肌束的一端连接,以实时记录肌束收缩力的变化。以2 g 张力静息平衡30 min 后,将电极同肌肉束连接,并施加1~32 Hz 的电场刺激,使用双向方形脉冲波,80 V持续电压0.5 ms,刺激肌束20 s,两次刺激间隙2 min。在不同的溶液环境下进行重复测试(Tyrode 缓冲液、阿托品液0.05 mmol/L),即高K+环境([K+]=120 mmol/L),ATP 环境(0.1 mmol/L),低Ca2+环境([Ca2+]=0 mmol/L),从而确定肌束在不同环境下的反应性。每次测试前用新鲜缓冲液洗涤肌束3 次。记录肌束的最大张力、最大张力速度,将其作为肌肉反应性特征。
统计学方法所有数据均使用STATA 16.0 软件进行统计处理,实验数据用x±s表示,所有实验均重复3 次以上。实验数据组间比较采用独立样本t检验,多组间数据使用单因素方差分析法(ANOVA),P<0.05 为差异有统计学意义。
结 果
膀胱的重量和容量对照组、梗阻解除组、梗阻组兔膀胱重量分别为(3.94±0.53)g、(12.43±2.72)g、(15.75±3.87)g。膀胱容量分别为(98.16±18.71)mL、(57.43±6.02)mL、(48.43±16.83)mL。对照组相较于其余两组膀胱重量明显降低(P<0.01),且膀胱容量增大(P<0.01),而梗阻组与梗阻解除组的膀胱重量和容量未发现明显差异。
逼尿肌束收缩功能为便于分析,仅比较30 Hz 电场刺激下兔肌束的最大张力及最大张力速度。最大张力以g/100 mg 膀胱肌肉组织表示,最大张力产生速度以g·s-1·100 mg-1膀胱肌肉组织表示(表1、表2)。
表1 30 Hz 刺激下单位重量逼尿肌最大收缩速度Tab 1 Maximum contraction velocity per unit weight detrusor under 30 Hz stimulation(±s)

表1 30 Hz 刺激下单位重量逼尿肌最大收缩速度Tab 1 Maximum contraction velocity per unit weight detrusor under 30 Hz stimulation(±s)
P value was compared between control and relief groups.
Group Control Relief Obstruction P Maximum contraction velocity (g·s-1·100 mg-1)High K+0.081±0.067 0.035±0.017 0.014±0.004<0.05 Tyrode 0.842±0.531 0.161±0.042 0.043±0.045<0.01 ATP 0.453±0.302 0.084±0.057 0.042±0.032<0.01 Atropine 0.624±0.573 0.123±0.032 0.034±0.024<0.01 Ca2+-free 0.143±0.084 0.092±0.067 0.044±0.024 0.079
表2 30 Hz 刺激下单位重量逼尿肌最大张力Tab 2 Maximum tension power per unit weight detrusor under 30 Hz stimulation(±s)
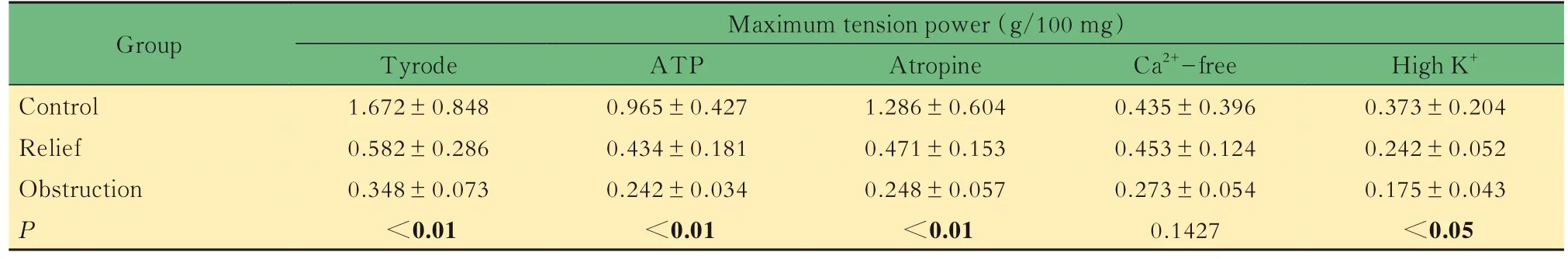
表2 30 Hz 刺激下单位重量逼尿肌最大张力Tab 2 Maximum tension power per unit weight detrusor under 30 Hz stimulation(±s)
P value was compared between control and relief groups.
Group Control Relief Obstruction P Maximum tension power (g/100 mg)High K+0.373±0.204 0.242±0.052 0.175±0.043<0.05 Tyrode 1.672±0.848 0.582±0.286 0.348±0.073<0.01 ATP 0.965±0.427 0.434±0.181 0.242±0.034<0.01 Atropine 1.286±0.604 0.471±0.153 0.248±0.057<0.01 Ca2+-free 0.435±0.396 0.453±0.124 0.273±0.054 0.1427
对照组、梗阻解除组单位重量逼尿肌最大收缩速度和最大张力明显大于梗阻组(P<0.05),除在无钙液中对照组单位重量逼尿肌最大收缩速度及最大张力与梗阻解除组无明显差异外,在其他溶液中对照组都明显大于梗阻解除组,两者比较差异有统计学意义(P<0.05)。
内质网和线粒体形态梗阻组和梗阻解除组核周围内质网相对于对照组均发生明显扩张(图1)。梗阻组线粒体发生明显的水肿,相对密度降低,相对于对照组更为稀疏(图2)。

图1 电子显微镜下对照组(A)、梗阻解除组(B)、梗阻组(C)逼尿肌细胞内的内质网(×6 000)Fig 1 The endoplasmic reticulum in the detrusor cells of control group (A), relief group (B) and obstruction group (C) under the electron microscope (×6 000)

图2 电子显微镜下对照组(A)、梗阻解除组(B)、梗阻组(C)逼尿肌细胞内的线粒体(×20 000)Fig 2 The mitochondria in the detrusor cells of control group (A), relief group (B) and obstruction group (C)under the electron microscope (×20 000)
粗面内质网面积观测视野面积为108.02~114.25 μm2。 其中对照组平均内质网面积为(0.189±0.140)μm2,梗阻组为(3.204±2.281)μm2,梗阻解除组为(2.740±1.232)μm2。梗阻组及解除梗阻组内质网平均面积均明显大于对照组,且两组之间差异无统计学意义。
线粒体相对密度对照组线粒体平均相对密度为1.645±0.276,梗阻组为0.832±0.197,梗阻解除组为1.253±0.084。梗阻组的线粒体相对密度明显下降,且低于其他两组,对照组的线粒体相对密度最大。
讨 论
由于BPH 患者的膀胱功能障碍多继发于pBOO,在应用手术或药物解除pBOO 后,逼尿肌功能是否恢复是令人关心的问题。在兔pBOO 模型中,梗阻2 周后解除梗阻,2~4 周后其膀胱功能可以恢复至正常水平[4]。长时间的膀胱梗阻会造成实验兔膀胱功能不可逆的受损:经过8 周pBOO 后,膀胱功能随着恢复时间增长逐渐好转,但始终低于正常水平[5]。学界关于解除梗阻后逼尿肌恢复时间仍有争论,但多以2 周为主要观点,因此本实验认为解除梗阻后3 周兔逼尿肌恢复已较为完全。本研究以新西兰白兔制成pBOO 动物模型,于梗阻2 周后解除梗阻模拟人类BPH 患者治疗后的情况,观察逼尿肌功能的恢复情况。结果显示:在膀胱出口梗阻2 周后解除梗阻3 周,其逼尿肌功能可以部分恢复,单位重量逼尿肌的最大张力及最大张力速度在台氏液及各种溶液中皆明显大于梗阻2 周组。但是这种恢复作用是不完全的,梗阻解除组的膀胱重量及容量较梗阻组并未好转;梗阻解除组的膀胱逼尿肌功能在3 周后并不能恢复至正常水平,仅在无钙液中和对照组的收缩功能比较无显著性差异。这是由于在逼尿肌细胞中,钙是介导粗细肌丝耦合,引起肌肉收缩的重要离子[6],无论是对照组或是梗阻解除组膀胱逼尿肌的细胞在无钙液中都不能有效收缩。
由于本研究中制成的动物模型是严重梗阻模型,在2 周梗阻后其逼尿肌的病理生理改变已进入失代偿期,而当膀胱功能进入失代偿期后,其部分变化已不可逆。从而造成逼尿肌功能无法完全恢复。由此可见,BPH 患者治疗后(解除梗阻后),其逼尿肌的功能恢复不仅与梗阻的时间有关,而且与梗阻的严重程度相关。在梗阻时,逼尿肌细胞内的线粒体酶活性明显下降,而解除梗阻后大部分酶活性可以恢复至正常水平,同时线粒体自噬标志物Bnip3 和LC3B-II 也表现出上升趋势[7]。这可能与逼尿肌功能无法完全恢复有关。Chai 等[8]动物实验证实,部分动物解除pBOO 后,其排尿症状无明显好转,膀胱测压提示仍然存在出口梗阻,但是尿道灌注测压证实无梗阻存在,我们认为存在“功能性pBOO”,即膀胱功能障碍。
本次实验中,我们为进一步测观测增生逼尿肌细胞内部的超微结构变化,使用透射电镜对逼尿肌组织标本进行扫描观察,希望能在亚显微层次发现逼尿肌增生背后的超微结构变化。梗阻组中粗面内质网的面积增加,提示其合成蛋白质的功能得到了加强,处于相对活跃状态;而梗阻解除组内质网面积相较于梗阻组有所回落,但仍然大于对照组。内质网作为细胞内蛋白质合成的主要场所,在细胞蛋白大量合成时会发生形态改变。Swärd 团队对膀胱梗阻后的大鼠膀胱平滑肌进行检测,发现其内质网扩展超过10 倍,且高尔基体也发生了扩张[8]。本研究中,由于pBOO,逼尿肌细胞需要合成大量的蛋白以满足自身增生需要,因此必定会引发细胞内粗面内质网合成功能的增强。结合后续逼尿肌的功能学实验,我们有理由相信其内质网结构变化同肌束收缩功能改变有所关联。
膀胱逼尿肌增生不可避免地会对其内在线粒体微环境造成影响。有研究报道,逼尿肌内部线粒体的肿胀程度和结构破坏随着梗阻严重程度的提升而增加[9]。此外,线粒体内部的三羧酸循环酶活性也会随水肿而活力降低,从而减少了能量产出。Lin 等[10]在对梗阻后膀胱逼尿肌进行了线粒体酶活性测试,发现在梗阻2 周后,逼尿肌的收缩反应明显降低。在进一步探究分子层面变化后发现,逼尿肌三羧酸循环中大部分酶活性均降低,且琥珀酸细胞色素还原酶水平发生了不可逆转的损伤,这均会对线粒体的产能造成极大影响。Zhu 等[11]则对梗阻后线粒体功能进行检测,结果表明线粒体基线耗氧率和最大耗氧率相较于无梗阻组均出现了明显下降,提示线粒体氧化功能受损。本实验发现兔梗阻组逼尿肌细胞中线粒体发生水肿且相对密度明显下降,这一趋势在解除梗阻后得到了改善。这一变化特点同肌束的功能学变化存在一定的相关性,线粒体的形态完好与否与逼尿肌收缩功能相关联。pBOO 后的膀胱逼尿肌变化复杂多样,除线粒体与内质网外,也有研究提示在梗阻后膀胱逼尿肌超微结构中存在大量细胞间隙,促进了相邻细胞膜的去极化和广泛的细胞间电通信,造成膀胱过度活动症[12]。
临床上由于长期排尿困难、反复尿潴留而行手术治疗的患者往往由于长期的pBOO 导致膀胱功能的失代偿,应注意到术后逼尿肌功能的恢复问题。在对BPH 患者进行治疗时,不仅要注意到出口梗阻的解除,更为重要的是在治疗前了解逼尿肌的功能状态,对其受损程度进行评价,以客观估计治疗后尤其是手术后膀胱功能恢复的可能,采取综合治疗方案,在解除梗阻的同时,根据不同的逼尿肌功能状态采用针对性治疗措施,以获得最佳的临床疗效。
本研究存在以下不足:(1)对兔pBOO 模型中梗阻前后的细胞微环境变化进行分析;(2)未涉及人体标本,降低了实验结论的临床外推可靠性。在本研究的基础上,我们进一步探究pBOO 中的潜在机制。
作者贡献声明程姜铤,林文耀 模型构建,数据采集,论文撰写。张思弘,许培榕 文献调研,论文修改。黄嘉琪,何敏坷 透射电子显微镜拍摄指导。李耀辉,程捷 逼尿肌电生理实验指导。王杭 实验设计和指导,论文撰写和修改。
利益冲突声明所有作者均声明不存在利益冲突。
