基于miR-181c-3p/STAT3通路探讨增液润燥汤治疗干燥综合征作用机制
2023-12-12杨瑞祥陈慧敏李纪高
杨瑞祥,周 全,陈慧敏,李纪高
(1.河南中医药大学第一临床医学院,河南 郑州 450046;2.河南中医药大学第一附属医院,河南 郑州 450099)
干燥综合征(Sjogren’s syndrome,SS)是一种慢性炎症性自身免疫性疾病,其主要特征是腺体上皮细胞炎症、损伤及破坏,导致腺体分泌减少或缺失[1]。目前,SS的病因和发病机制尚未完全明确,现阶段认为炎症反应和免疫系统异常与其发病密切相关[2]。西医对于SS的治疗主要采用免疫抑制和替代疗法,但存在临床症状改善不明显、药物不耐受、长期服药依从性差等问题。既往研究表明,信号转导与转录激活因子3(Signal transducer and activator of transcription 3,STAT3)信号通路直接参与SS的发病[3]。miR-181c-3p是miR-181c表达出的一个成熟序列,miR-181c模拟物的外源表达可直靶向抑制同源异形盒基因A1(Homologous heteromorphic box gene A1,HOXA1)及其下游分子STAT3的表达,抑制T细胞的活化,减轻免疫炎症[4-5]。
中医根据临床症候特点,将SS归属于“燥证”“燥痹”等范畴,其病因病机复杂,涉及肺、脾、肝、肾等多个脏腑[6-7]。增液润燥汤是我科治疗SS的临床经验方,具有益气滋阴、生津润燥、祛瘀通络的功效。本课题组前期研究发现,低、中、高剂量的增液润燥汤干预SS模型小鼠,均能够显著降低炎症因子白介素(IL)-1β、IL-17的表达水平[8-9],但对于其具体的上下游通路尚不明确。因此,本研究通过建立SS模型小鼠,观察各组小鼠的相关指标,从STAT3信号通路及miR-181c-3p表达的角度探讨增液润燥汤对SS的干预机制,以期为增液润燥汤防治SS的进一步研究提供参考。
1 材料与方法
1.1 实验材料
1.1.1 实验动物:选取SPF级BALB/c雄性小鼠21只,6~8周龄,体重(22.3±2.1)g,购自北京华阜康生物科技股份有限公司,合格编号:SCXK(京)2019-0008。实验过程中无动物死亡。本实验已通过康泰医学检验服务河北有限公司实验动物伦理委员会审查,批准号:MDL20220602-01。
1.1.2 实验药物与试剂:增液润燥汤(组方为北沙参、天冬、桔梗各15 g,紫菀、知母、乌梅、桃仁各10 g,制附子、炙甘草各6 g),由河南中医药大学第一附属医院门诊颗粒药房提供;白芍总苷胶囊(批号210813,规格0.3 g)。免疫球蛋白G(IgG)检测试剂盒(货号:CEA544Mu,武汉优尔生商贸有限公司);Citrate柠檬酸盐缓冲液、PBS磷酸盐缓冲液、苏木素染液(货号分别为ZLI-9064、ZLI-9061、ZLI-9609,北京中杉金桥生物技术有限公司);HOXA1抗体、STAT3抗体、磷酸化STAT3(p-STAT3)抗体、白细胞介素17A(IL-17A)抗体、叉头盒蛋白P3(Foxp3)抗体、β-actin抗体(货号分别为DF3187、AF6294、AF3293、DF6127、AF6544,美国Affinity Biosciences公司);STAT3通路激活剂[10](Colivelin,美国MCE公司);miR-181c-3p激动剂(湖州河马生物科技有限公司)。
1.1.3 实验仪器:酶标仪(美国Bio-rad公司);全自动脱水机、石蜡切片机、加热石蜡包埋系统(德国Leica公司);台式高速冷冻离心机、分光光度计(美国Thermo Fisher公司);荧光定量PCR仪(美国Applied Biosystems公司);微量分光光度计(杭州优米仪器有限公司);电泳仪(北京百晶生物技术有限公司);低温离心机(美国Sigma公司);流式细胞仪(常州必达科生物科技有限公司)。
1.2 实验方法
1.2.1 SS模型小鼠的建立:免疫诱导法制备SS模型小鼠[11]。另取同种小鼠颌下腺组织,剔除淋巴结,放入PBS缓冲液中,在4 ℃条件下匀速离心5 min,充分匀浆,取上清液,检测蛋白浓度,将蛋白与弗氏完全佐剂乳化,得到质量分数为400 mg/L的抗原溶液。随机选取3只小鼠作为对照组,除对照组外,其余小鼠第0、14天经两侧腹股沟皮下注射抗原溶液共0.1 ml,首次免疫后第2、7天时,给予以上小鼠腹腔注射0.05 ml百白破联合疫苗加强免疫。
1.2.2 分组和给药:将造模成功的BALB/c小鼠随机分为模型组、白芍总苷组、增液润燥汤低剂量组、增液润燥汤高剂量组、增液润燥汤高剂量+Colivelin组、增液润燥汤高剂量+miR-181c-3p激动剂组,每组3只。另取3只作为对照组。从造模完成后即第15天开始给药,增液润燥汤低、高剂量组分别给予4、12 mg/g增液润燥汤灌胃,白芍总苷组给予0.234 mg/g白芍总苷灌胃,模型组、对照组给予等体积蒸馏水灌胃,连续给药60 d;增液润燥汤高剂量+Colivelin组给予1 mg/kg的Colivelin腹腔注射,2次/周,增液润燥汤高剂量+miR-181c-3p激动剂组给予miR-181c-3p激动剂腮腺原位多点注射,2次/周,持续60 d。给药后第60天麻醉状态下处死小鼠,进行后续处理。
1.3 观察指标
1.3.1 饮水量:每日于固定时间添加水并记录,次日于相同时间观察容器内水剩余量,两次之间的差即为小鼠每日的饮水量,连续测量60 d。
1.3.2 唾液流率:小鼠麻醉后肌肉注射毛果芸香碱,15 min后小鼠头向下将毛细管置于口底,收集唾液20 min;称量收集唾液前后的毛细管重量,计算唾液量和唾液流率。唾液流率(mg/min)=唾液量(mg)/20 min。
1.3.3 颌下腺脏器指数:各组小鼠于给药后第60天称量体重后麻醉状态下处死,低温摘取双侧颌下腺称重,计算脏器指数。颌下腺脏器指数(mg/g)=双侧颌下腺重量(mg)/小鼠体重(g)。
1.3.4 红细胞沉降率:采用自动血沉分析仪检测增液润燥汤高剂量组、增液润燥汤高剂量+miR-181c-3p激动剂组小鼠的红细胞沉降率。
1.3.5 血清IgG水平:收集小鼠外周血液样本,分离血清,参照IgG检测试剂盒指导步骤,采用ELISA法检测增液润燥汤高剂量组、增液润燥汤高剂量+miR-181c-3p激动剂组小鼠的血清IgG水平。
1.3.6 颌下腺组织病理学观察:取石蜡包埋的小鼠颌下腺组织,切片后进行脱蜡,行苏木素-伊红(HE)染色后脱水、透明、封片。显微镜下拍照,观察颌下腺组织病理学变化。
1.3.7 RT-qPCR法检测小鼠颌下腺miR-181c-3p的表达:使用Trizol法行小鼠颌下腺组织样本总RNA提取,微量分光光度计测定纯度后使用试剂盒进行逆转录合成cDNA,按照以下条件反应上机进行PCR扩增,反应程序:预变性95 ℃、10 min,变性95 ℃、10 s,退火58 ℃、20 s,延伸72 ℃、20 s,共循环40次。实验得到每个基因的Ct值,以β-actin为内参基因,采用2-ΔΔCt法计算目的基因相对表达量。引物序列:miR-181c-3p-F:5’-TCGGCAGGACCATCGACCGTTGAG-3’,miR-181c-3p-R:5’-CTCAACTGGTGTCGTGGAGT-3’。
1.3.8 Western blot法检测小鼠颌下腺HOXA1、STAT3、p-STAT3、IL-17和Foxp3的表达:取小鼠颌下腺组织,加液氮进行匀浆,加入1 ml的PBS清洗后,估计样品体积,加入5倍体积裂解液,混匀;裂解后以 4 ℃、12000 r/min离心15 min,收集上清;用BCA蛋白定量法测定蛋白浓度;蛋白上样Buffer将蛋白定量为5 mg/ml,-20 ℃保存备用,避免反复冻融;配备SDS-PAGE凝胶,分离提取蛋白并用PVDF膜转膜;小心取出转移膜置于封闭液中封闭1 h;加入一抗后4 ℃下反应过夜;洗膜后加入二抗室温、避光孵育60 min;采用ECL法显色曝光、显影冲洗,使用化学发光成像系统成像分析。以β-actin为各蛋白内参,计算目的蛋白的相对表达水平。
1.3.9 流式细胞仪检测Th17/Treg细胞含量:采用流式细胞术测定外周血辅助性T细胞17(Th17)、调节性T淋巴细胞(Treg)含量,严格按照说明书进行检测。

2 结 果
2.1 各组小鼠日饮水量比较 见表1。给药前,各组小鼠日饮水量无明显变化,差异无统计学意义(P>0.05)。给药60 d,与模型组比较,各组小鼠日饮水量明显下降(均P<0.05);与增液润燥汤高剂量组比较,增液润燥汤高剂量+Colivelin组小鼠日饮水量明显升高,增液润燥汤高剂量+miR-181c-3p激动剂组日饮水量明显下降(均P<0.05)。

表1 各组小鼠日饮水量比较(ml)
2.2 各组小鼠唾液流率比较 见表2。与模型组比较,各组小鼠唾液流率明显升高(均P<0.05);与增液润燥汤高剂量组比较,增液润燥汤高剂量+Colivelin组唾液流率无明显变化(P>0.05),增液润燥汤高剂量+miR-181c-3p激动剂组唾液流率显著升高(P<0.05)。

表2 各组小鼠唾液流率比较(mg/min)
2.3 各组小鼠颌下腺指数比较 见表3。与模型组比较,对照组、增液润燥汤高剂量组、增液润燥汤高剂量+miR-181c-3p激动剂组小鼠颌下腺指数明显增高(均P<0.05)。

表3 各组小鼠颌下腺指数比较(mg/g)
2.4 各组小鼠颌下腺组织病理变化 模型组小鼠腺泡大小不等,淋巴细胞浸润明显,形成较多浸润灶;对照组结构正常,腺泡大小均匀,排列整齐,未见淋巴细胞浸润;白芍总苷组、增液润燥汤低剂量组、增液润燥汤高剂量组腺泡结构基本正常,淋巴细胞浸润数量较模型组有不同程度减少;增液润燥汤高剂量+Colivelin组淋巴细胞浸润数量高于增液润燥汤高剂量组。见图1。
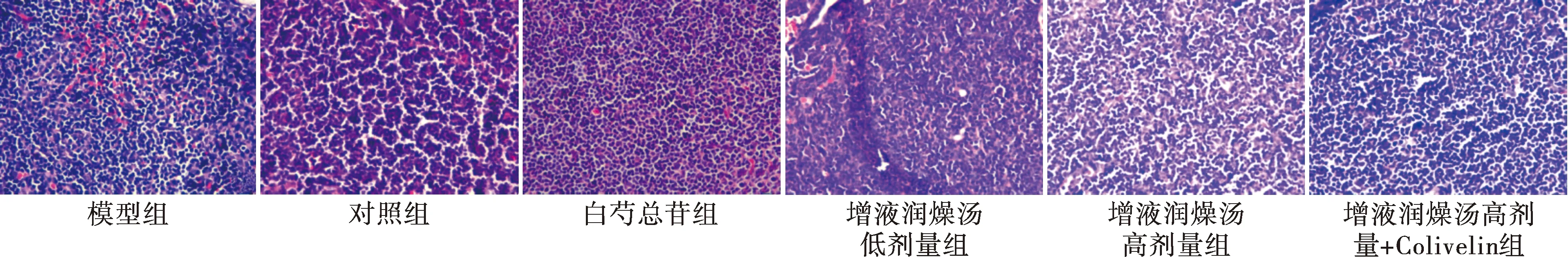
图1 各组小鼠颌下腺组织病理变化(HE染色,×400)
2.5 各组小鼠红细胞沉降率、IgG水平比较 见表4。与增液润燥汤高剂量组比较,增液润燥汤高剂量+miR-181c-3p激动剂组红细胞沉降率、血清IgG水平明显下降(均P<0.05)。

表4 各组小鼠红细胞沉降率、IgG表达水平比较
2.6 各组小鼠颌下腺HOXA1、STAT3、p-STAT3、IL-17和Foxp3蛋白相对表达量比较 与模型组比较,各组HOXA1、STAT3、p-STAT3、IL-17表达明显下调,Foxp3表达明显上调(均P<0.05);与增液润燥汤高剂量组比较,增液润燥汤高剂量+miR-181c-3p激动剂组HOXA1、STAT3、p-STAT3、IL-17的表达明显下调,Foxp3表达明显上调(均P<0.05)。见表5(图2)。

A:模型组;B:对照组;C:白芍总苷组;D:增液润燥汤低剂量组;E:增液润燥汤高剂量组;F:增液润燥汤高剂量+miR-181c-3p激动剂组

表5 各组小鼠颌下腺HOXA1、STAT3、p-STAT3、IL-17和Foxp3蛋白相对表达量比较
2.7 各组小鼠颌下腺miR-181c-3p表达比较 见表6。与模型组比较,各组miR-181c-3p表达明显上调(均P<0.05);与增液润燥汤高剂量组比较,增液润燥汤高剂量+miR-181c-3p激动剂组miR-181c-3p表达明显上调(P<0.05)。

表6 各组小鼠颌下腺miR-181c-3p表达比较
2.8 各组小鼠外周血T淋巴细胞亚群比较 见表7。与模型组比较,各组Treg细胞比例明显上升,Th17细胞比例、Th17/Treg明显下降(均P<0.05);与增液润燥汤高剂量组比较,增液润燥汤高剂量+Colivelin组Treg细胞比例明显下降,Th17细胞比例、Th17/Treg明显上升(均P<0.05);与增液润燥汤高剂量组比较,增液润燥汤高剂量+miR-181c-3p激动剂组Treg细胞比例明显上升,Th17细胞比例、Th17/Treg明显下降(均P<0.05)。

表7 各组小鼠外周血T淋巴细胞亚群比较
3 讨 论
中医古籍中虽无SS病名的记载,但早在《黄帝内经》中即有“燥胜则干”“燥者濡之”的论述,其病机多以阴虚为本,可夹杂燥毒、瘀血等邪气[12]。中医药可通过多途径发挥整体调节作用,在本病的治疗中具有独特的优势[13]。增液润燥汤针对本病阴虚夹杂燥毒、瘀血等的病理特点,消补兼施,标本兼顾,润燥得宜,行津有法,共奏津液滋润濡养之功。方中北沙参、天冬性味甘寒,共奏滋养肺胃、养阴生津之功;知母、乌梅清热养阴生津;紫菀润肺化痰,开肺布津,与桔梗配伍,以增强宣发肺气之功;附子温肾化气,阳中求阴;久病必瘀,方用桃仁活血行瘀,畅通气血运行,使津液得以运化全身。诸药合用,共奏滋阴润燥、补气生津、祛瘀通络之功,则燥证自愈。
miRNA是一类长度约22个核苷酸的单链RNA分子,不编码蛋白质,但调节基因表达[14]。在机体的多种生理及病理过程中,尤其是在自身免疫性疾病中,miRNA起着关键作用[15]。研究表明,部分miRNA可以调节免疫细胞发育和免疫反应[16]。miR-181c是一种新发现的免疫细胞活化负调节因子,当提高细胞中miR-181c表达时,可以降低促炎细胞因子的表达水平[17];miR-181c-3p是其表达出的一个成熟序列,表达水平与血清IL-17水平呈负相关,是免疫系统疾病的新型潜在治疗靶点[18]。本研究结果显示,与模型组比较,对照组及各给药组小鼠颌下腺miR-181c-3p的表达均显著上调,且与增液润燥汤高剂量组比较,增液润燥汤高剂量+miR-181c-3p激动剂组红细胞沉降率与血清IgG水平明显下降,表明增液润燥汤可能通过调节miR-181c-3p表达发挥对SS的治疗作用。
T淋巴细胞亚群在自身免疫性疾病及炎症性疾病中发挥着重要作用[19]。Th17细胞由初始CD4 T淋巴细胞分化而来,是典型的促炎细胞,Treg细胞功能与其相反,具有抗炎和免疫耐受性[20]。在生理条件下,机体Th17/Treg细胞保持动态平衡,当平衡被打破时,Th17细胞过度增殖,则会使IL-17等炎性细胞因子过度表达,引发炎症反应[21]。研究表明,Th17/Treg细胞平衡向促炎Th17轴的转变会加剧原发性干燥综合征和其他自身免疫性疾病,因此调节Th17/Treg细胞平衡被认为是调控SS免疫炎症的关键[22-23]。Foxp3是Treg细胞的标志性转录因子,Foxp3在维持Treg细胞的分化成熟及功能中发挥着重要的作用[24]。在前期研究中,本课题组证实增液润燥汤治疗SS有着良好的疗效,尤其是在降低炎性指标等方面显示出了一定的优势[8-9]。在本研究中,进一步观察到增液润燥汤可上调Foxp3的表达,使Th17/Treg细胞平衡向Treg方向偏移,从而改善SS临床症状。
STAT家族有7个成员,其中STAT3由约750个氨基酸组成,在控制炎症和调节免疫细胞活化中具有重要的信号转导作用[25]。STAT3磷酸化的过度增强,可以调节炎性细胞因子的表达,促进Th17细胞的增殖以及免疫球蛋白的产生,并抑制Treg细胞,诱发免疫炎症[26]。在类风湿关节炎、溃疡性结肠炎等免疫性疾病的发病中STAT3具有关键作用,能够激活T淋巴细胞,因而降低STAT3的磷酸化可以对其发挥治疗作用,且STAT3通路已被证明可调节SS的发病[27]。本研究发现,增液润燥汤可降低STAT3的磷酸化,调节Th17/Treg细胞平衡,从而改善SS临床症状,发挥治疗作用。表明增液润燥汤可能是通过抑制STAT3通路发挥治疗作用。Zhao等[28]相关研究证实miR-181c-3p通过抑制转录因子HOXA1的表达下调STAT3;结合本研究相关结果,提示增液润燥汤可以上调SS模型小鼠颌下腺中miR-181c-3p表达水平,下调其直接靶点HOXA1的表达,抑制STAT3磷酸化,调节Th17/Treg细胞失衡,减少IL-17等炎性因子的释放,从而减少颌下腺淋巴细胞浸润,发挥治疗作用。
综上所述,增液润燥汤可以通过上调SS模型小鼠颌下腺中miR-181c-3p表达,抑制STAT3活化,从而改善Th17/Treg细胞失衡,纠正免疫炎症失调状态。
