对乙酰氨基酚配伍腺苷蛋氨酸复方片剂的制备及质量评价
2023-12-06陈俊唐其蔚胡秀虹谭荣黄雨骥
陈俊,唐其蔚,胡秀虹,谭荣,黄雨骥
(1.凯里学院,贵州 凯里 556011,2.黔东南州人民医院,贵州 凯里 556099)
对乙酰氨基酚(Acetaminophen,APAP)又名扑热息痛,作为OTC类解热镇痛药是目前全球最常用的解热镇痛药物,其解热作用缓慢而持久,且具有刺激性小、极少有过敏反应等优点,在推荐治疗量范围内通常被认为是安全的,但服用不当或药物过量会引起药物性肝损伤,目前是临床上导致DILI最常见药物,引起全世界范围内越来越多的关注[1-2]。
腺苷蛋氨酸(S-adenosy-L-methionine,SAMe)于1952年由意大利科学家Cantoni发现[3],存在于人体所有组织和体液中的内源性物质及生物活性成分。大量的实验研究表明,外源性SAMe通过调节肝细胞生长、分化和死亡的重要代谢产物可减轻肝癌的发生[4]。它可参与合成内源性谷胱甘肽,减弱氧化应激反应;促进腺苷蛋氨酸依赖性质膜磷脂的合成而恢复细胞质膜的流动性,降低术后急性总胆红素增高;克服转硫基反应障碍,促进了内源性解毒过程中巯基的合成;抑制肝星状细胞的活化,减弱肝纤维化,增加DNA的甲基化作用,抑制恶性肿瘤的发生、发展[5]。鉴于对体内多种生化反应起重要作用,它的不足可引起多种病理生理及病理学改变,补充外源性的SAMe可以恢复体内不足引起的肝损伤及减低慢性肝病中肝硬化的发展[6-7]。
药物性肝损伤(Drug-induced liver injury,DILI)是在服用某种或几种药物后,由药物、药物在体内的代谢产物以及辅料导致肝损伤或肝脏对其发生过敏反应引起的肝损伤[8]。药物性肝损伤(DILI)发病率呈现上升趋势。作为肝病大国,对DILI的认识并进行相关研究提供理论指导刻不容缓。国内外未见有文献明确报道对SAMe和APAP复方制剂的研究。课题组前期研究表明SAMe对APAP引起的DILI有保护作用,其作用与SAMe的剂量呈相关性且效果优于等剂量的N-乙酰半胱氨酸。根据其生物药剂学特性,有针对性地开展复方制剂的剂型研究,为一种安全有效复方制剂的开发和实际应用提供基础理论依据。本课题的实施对开发具有副作用较小的对乙酰氨基酚复方制剂具有指导作用。
1 材料与方法
1.1 材料
1.1.1 试剂
腺苷蛋氨酸(陕西森弗天然制品有限公司,批号:SX171005);对乙酰氨基酚(源叶生物科技有限公司,批号:B19M8E36136);聚乙烯吡咯烷酮(大连美仑生物技术有限公司,批号:N0928A);硬脂酸镁(大连美仑生物技术有限公司,批号:M0509A);交联聚乙烯吡咯烷酮(上海源叶生物科技有限公司,批号:B24N9S75970);低取代丙纤维素(阿拉丁试剂有限公司,批号:B1629352);交联羧甲纤维素(北京索莱宝科技有限公司,批号:521K021);羧甲淀粉钠(安徽山河药用辅料股份有限公司,批号:J02M6R1);乳糖(大连美仑生物技术有限公司,批号:A000007);微晶纤维素(大连美仑生物技术有限公司,批号:M0126A);可压性淀粉(北京索莱宝科技有限公司,批号:308M021);无水乙醇(重庆川东化工(集团)有限公司;批号:20170301);微粉硅胶(上海源叶生物科技有限公司,批号:141202)。
1.1.2 主要仪器
AUY120型分析天平(日本岛津公司产品);超纯水纯化系统(四川沃特尔科技有限公司);紫外可见分光光度计(北京普析通用仪器有限责任公司);DP30A型单冲式压片机(北京国药龙立科技有限公司);ZRS-6G型溶出仪(天津市天大天发科技有限公司);YD-35型片剂硬度测试仪(天津盛达三合光学仪器有限公司);CS-2型脆碎度测试仪(天津市精拓仪器科技有限公司)。
1.2 方法
1.2.1 APAP颗粒的制备工艺
原料药与辅料过100目筛(筛孔径0.15 mm)备用,将APAP、稀释剂和崩解剂均匀混合,然后加入5%PVP乙醇溶液,混合均匀制成软材(握之成团,触之即散),20目(筛孔径0.85 mm)整粒过筛,于50 ℃下干燥30 min,干燥后在20目筛(筛孔径0.85 mm)进行整粒,加入润滑剂(等量递加)混匀,压片。
1.2.2 APAP崩解剂、填充剂、润滑剂的选择
处方中APAP用质量分数为76.5%。填充剂用质量分数为11%,黏合剂用质量分数为7%,崩解剂用质量分数为5%,润滑剂用质量分数为0.5%。分别以交联聚乙烯吡咯烷酮(PVPP)、低取代丙纤维素(L-HPC)、交联羧甲纤维素钠(CCNa)、羧甲淀粉钠(CMS-Na)采用内加法,PVPP和CMS-Na以质量比1∶1采用内外加法作为崩解剂。固定以MCC为填充剂,PVP-K30为黏合剂,硬脂酸镁为润滑剂。分别以乳糖、微晶纤维素(MCC)、可压性淀粉作为填充剂,固定以PVPP为崩解剂,PVP-K30为黏合剂,硬脂酸镁为润滑剂。分别以硬脂酸镁,微粉硅胶作为润滑,固定以MCC为填充剂,PVP-K30为黏合剂,PVPP为崩解剂。按制备工艺进行处方压片,随机选取6片进行溶出度的测定,并计算溶出度平均值,筛选合适的崩解剂、填充剂、润滑剂。
1.2.3 对乙酰氨基酚颗粒辅料用量的优化
在以上单因素试验结果的基础上,固定处方其他因素,本次试验确定PVP-K30为黏合剂,得最佳崩解剂,最佳稀释剂,最佳润滑剂,但其用量需进一步优化。采用正交试验的方法,设计一个三因素三水平的正交试验。通过L9(34)正交表,以APAP在15 min时的溶出度为主要考察指标,优化辅料的用量。因素水平表见表1。
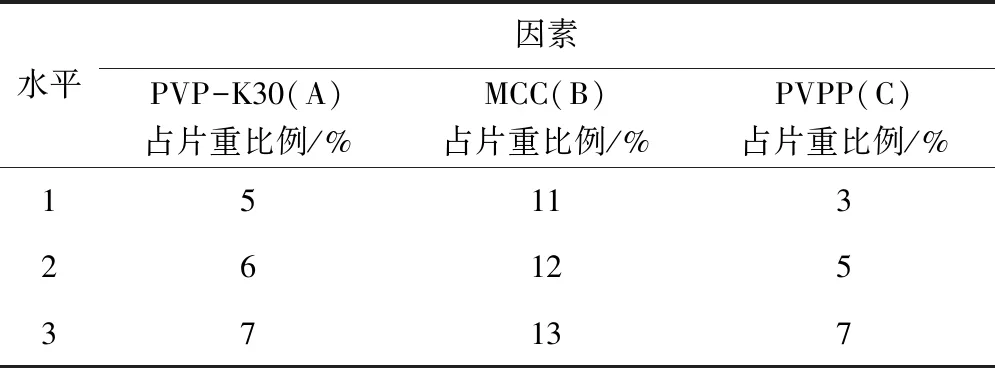
表1 正交设计因素水平表
1.2.4 腺苷蛋氨酸颗粒处方设计
1.2.4.1 SAMe颗粒的制备工艺
将腺苷蛋氨酸及辅料分别过100目筛(筛孔径0.15 mm)备用,按照要求取适量L-HPC、MCC、乳糖,采用等量递加的方法加入研钵混合均匀,腺苷蛋氨酸的用质量分数为67%,微晶纤维素用质量分数为22.8%,乳糖用质量分数为9.2%,微粉硅胶用质量分数0.5%,低取代丙纤维素用质量分数0.5%,加入5% PVP-K30乙醇溶液制备软材,20目筛(筛孔径0.85 mm)制粒,50 ℃鼓风干燥30 min后,20目筛(筛孔径0.85 mm)整粒,加入微粉硅胶作为润滑剂(等量递加)混匀,压片。
1.2.4.2 填充剂的比例筛选
腺苷蛋氨酸的吸湿性较强,前期的实验研究表明优选微晶纤维素和乳糖作为填充剂能很好解决吸湿性导致的颗粒不易成型。故本次优选两者的比例作为优选的填充剂。按照《中国药典》2020版 四部 9103 药物引湿性试验指导原则下的规定,对腺苷蛋氨酸的吸湿效果进行考察,从而确定填充剂的比例,微晶纤维素和乳糖的比例用量见表2。

表2 微晶纤维素和乳糖的比例
1.2.5 复方对乙酰氨基酚片剂的制备
本实验按照前期筛选的最优处方和制备工艺,使用DP30A型单冲式压片机,14号冲模为囊型模具制备复方片剂。
1.2.6 复方对乙酰氨基酚片的溶出度测定
从制得的复方片剂中随机选取6片(批号20191110),溶出度采用(《中国药典》2015年版 四部 通则 0931 第二法),以pH值6.8的磷酸盐缓冲溶液1000 mL为溶出介质,升温使温度保持在(37±0.5)℃,转速为50 r/min,放入已精密称定的片剂,同时开始计时,分别在1,5,10,15,30,45 min时取样10 mL,同时补加同温等体积的溶出介质。用0.45 μm微孔滤膜过滤,取续滤液,精密量取续滤液1 mL置25 mL量瓶中,并用溶出介质稀释至刻度。相似因子法评价复方对乙酰氨基酚片剂主药成分的体外溶出度,简单的模型非依赖性方法采用差异因子f1和相似因子f2比较溶出曲线。差异因子f1是计算在每一个时间点两个曲线差异的百分率(%),是两条曲线相对误差的衡量参数。相似因子f2对偏差的平方根的倒数进行对数转换。为两条曲线溶出百分率(%)相似性评价的衡量参数。
f1={[|Rt﹣Tt|]/[Rt]}×100%
(1)
f2=50×log{[1+(1/n)(Rt﹣Tt)2]-0.5×100%}
(2)
式中:Rt为参比制剂,Tt为受试制剂在时间t的释放度,n为时间点的个数。
1.2.7 外观性质
随机筛选实验所制的片剂,考察其外观性状。
1.2.8 片重差异
按片重差异的测定方法(《中国药典》2015版 四部 0101片剂),精密称取自制片20片的总质量,求得平均片重。再分别精密称定每片的质量,将每片质量与平均片重相减,再除以平均片重,即得质量差异百分比。按照限度规定:平均质量0.30 g以下的质量差异限度为±7.5%,0.30 g或0.30 g以上的为±5%。
1.2.9 硬度的测定
随机取片剂6片,用硬度测定仪测定硬度。调整仪器上硬度指示为零,打开硬度盒盖,让药片径向放在顶柱与夹头间,夹住被测药片。开启电源开关,按下启动按钮,当加压指针右移,药片破碎显示的值即为硬度值。
1.2.10 脆碎度测定
按照(《中国药典》2015年版 四部 通则0923)的要求,取10片药片,用吹风机吹去脱落的粉末后精密称量置圆桶中,转动100次取出,同法除去粉末,精密称重。
2 结果
2.1 对乙酰氨基酚的处方筛选
2.1.1 崩解剂的选择
以PVPP、L-HPC、CCNa、CMS-Na用内加法,PVPP、CMS-Na质量比为1∶1用内外加法,综合考虑选用PVPP作崩解剂。
2.1.2 稀释剂的选择
分别以乳糖、微晶纤维素、可压性淀粉作为稀释剂时主药的溶出曲线结果见图1,综合考虑最终决定选用MCC作稀释剂。
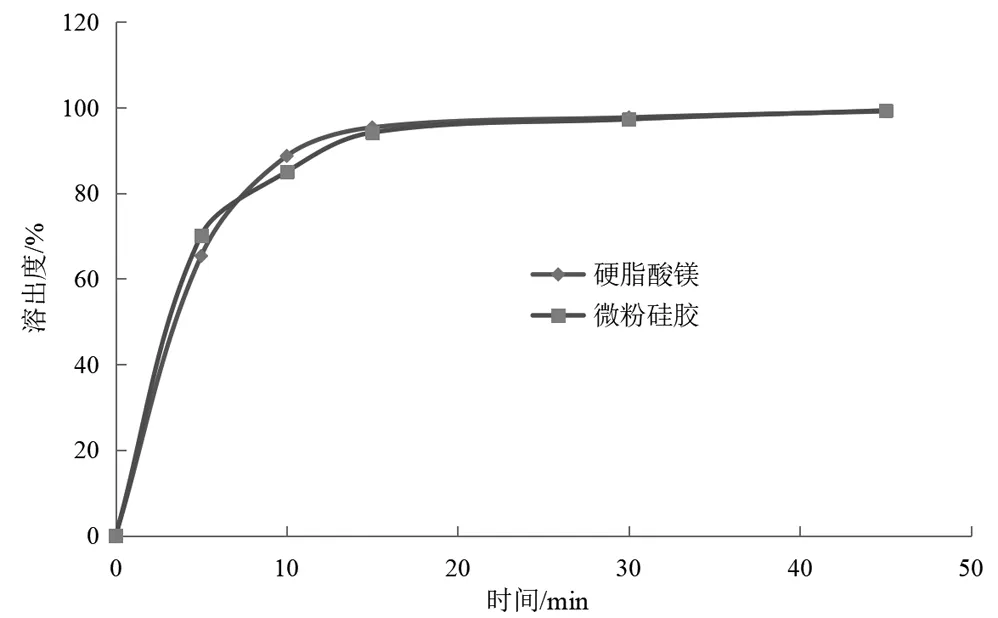
图1 稀释剂(填充剂)的选择
2.1.3 润滑剂的选择
分别以硬脂酸镁,微粉硅胶作为润滑剂时主药的溶出曲线结果见图2,综合考虑最终决定选用硬脂酸镁作为润滑剂。

图2 润滑剂的选择
2.1.4 正交试验方案及结果
正交试验方案及结果见表3。由正交数据分析结果可知,因素C的极差最大,说明因素C对实验结果影响较大,其次是因素A和因素B。影响溶出度的重要性依次为:因素C>因素A>因素B。A 影响因素A3>A2>A1,B 影响因素B1>B2>B3,C 影响因素C2>C1>C3。综合分析最优组合为A3B1C2,即PVPP为崩解剂用质量分数为5%,MCC用质量分数为11%,PVP-K30的用质量分数为7%。
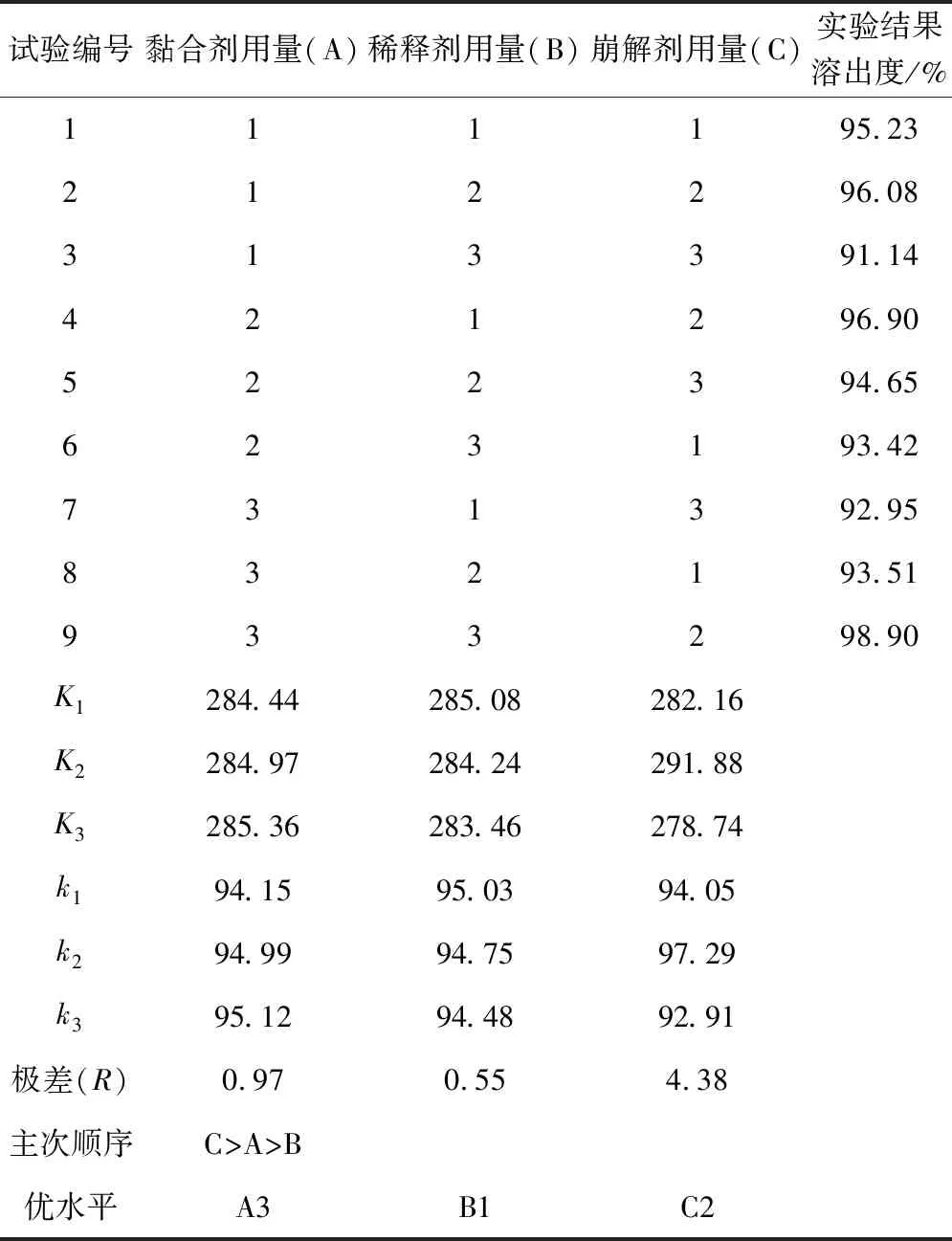
表3 正交试验方案及结果
2.2 腺苷蛋氨酸的处方优化
优选稀释剂MCC和乳糖的比例见表4,在此比例下的平衡吸湿量最低。

表4 微晶纤维素和乳糖比例的选择
2.3 复方对乙酰氨基酚片剂处方的确定
复方对乙酰氨基酚片剂处方见表5。按制备方法,将主药与辅料采用等量递加的方法加入研钵混合均匀,加入5% PVP-K30乙醇溶液制备软材,20目筛(筛孔径0.85 mm)制粒,50 ℃鼓风干燥30 min后,20目筛(筛孔径0.85 mm)整粒,加入润滑剂硬脂酸镁(等量递加)混匀,压片,即得复方对乙酰氨基酚片剂。

表5 复方对乙酰氨基酚片剂处方
2.4 相似因子法评价复方对乙酰氨基酚片剂主药成分的体外溶出度
对于溶出相似性曲线,一般情况下,差异因子f1值≤15且相似因子f2≥50,则认为两条溶出曲线相似,反之,认为不相似。结果见表6,f1=4.16<15,f2=67.42>50,说明自制复方对乙酰氨基酚片的主药成分(对乙酰氨基酚)与通过一致性评价的市售产品(对乙酰氨基酚片,通化万通药业股份有限公司)溶出度相近,体外释放度相似无明显差异,本次试验对自制的复方片剂具有参考价值。

表6 APAP与SAMe溶出曲线相似性比较
2.5 外观检查
所检查的片剂表面完整光洁,色泽均匀,边缘整齐,均符合中国药典2015版四部制剂通则中0101片剂的要求。
2.6 片重差异
所制备的三批片剂的片重平均值分别为800.60,799.58,803.43 mg,根据药典规定允许片重差异±5%,三批片剂的片重在760.57~840.63,759.60~839.56,763.26~843.60 mg之间,符合规定。
2.7 硬度的测定
三批片剂平均硬度分别为115.3,128.7,119.2 N,在100~150 N之间,符合标准规定。
2.8 脆碎度的测定
三批片剂平均脆碎度分别为0.11%,0.23%,0.19%,均小于1%,检测无断裂、龟裂及粉碎的片剂。符合片剂脆碎度检查法标准规定。
3 讨论
药物的处方筛选中,APAP的溶解性不好,在制备过程中选用加入崩解剂可提高药物的溶出度。SAMe是吸湿性很强的药物通过大量的实验筛选抗吸湿剂的种类和用量,找到了适宜的抗吸湿性辅料,从而严格控制了样品制备过程中出现的吸潮现象。辅料的性质及用量可影响药物的安全、有效、稳定和可控性,因此选择恰当的药物辅料是处方工艺筛选的重要步骤。
固体制剂口服给药后,药物的吸收取决于药物从制剂中的溶出或释放、药物在生理条件下的溶解以及在胃肠道的渗透,对吸收具有重要影响[9]。体外溶出度试验常用于指导药物制剂的研发,评价制剂批间、批内质量的一致性,以及评价药品处方工艺变更前后质量和疗效的一致性等[10]。通常采用多条溶出曲线测定药物的溶出行为,相对体内试验具有更高的灵敏度和更强的区分能力,可更好地反映制剂质量的特点[11]。
普通口服固体制剂仿制药质量一致性评价主要采用比较体外多条溶出曲线相似性这一技术手段进行[12]。本实验中比较实验室自制的复方对乙酰氨基酚片剂主药成分与市售的万通药业对乙酰氨基酚片剂的体外溶出曲线时,能客观反映制剂特点、具有适度的灵敏度和区分力。
本节实验参照《中国药典》2015版 四部 0101片剂项下的要求,主要针对自制复方片剂的外观性状、片重差异、脆碎度、硬度、含量测定以及稳定性实验建立初步的标准。为了制剂中主药成分可同时测定,本实验采用高效液相色谱法。它具有分离效能高、分析速度快、应用范围广等特点,在药品检验中应用较广泛。
