污泥无机湿法资源化回收铜镍的研究
2023-12-06曾斌龙
曾斌龙
(厦门晖鸿环境资源科技有限公司,福建 厦门 361000)
目前《国家危险废物名录》(2021年版)自2021年1月1日实施,该《名录》增加了更多的利用豁免环节,促进了危险废物的利用。电镀污泥因含大量的金属离子,对土壤及水环境潜在污染风险巨大,被收录于《国家版危险废物名录》,类别HW17。但因其常富集有铜、镍等金属离子,资源化利用可行性高。目前国内无机湿法资源化多采用酸溶+除杂+分步碳酸化合物法工艺制取碳酸铜、碳酸镍,但存在资源化的电镀污泥品质要求单一,只适用于单项提取铜、镍,当电镀污泥中铜、镍含量均较高时,存在分离不彻底,产品纯度低等问题。因此,研究一套可行的无机湿法资源回收工艺显得尤为重要。
1 酸溶浸取部分
在污泥的湿法资源化回收铜、镍离子工艺中,有效地浸取所需的有价金属是非常关键的步骤,直接影响到产品的数量。Silva J E等[1]的研究显示,采用硫酸浸取金属所需时间基本上在1 h内可以完成,在所有的硫酸浸出测试中采用(100 g/L)的测试可在最经济的条件下最有效地获得所需的有价金属。酸浸法的主要特点是对铜、锌、镍等有价金属的浸取效果较好,对杂质的选择性较低,特别是对铬、铁等杂质的选择性较差[2]。Veglib等[3]的研究显示,硫酸对铜、镍的浸出率可达95%~100%。
因此针对污泥中铜、镍金属的资源化,采用硫酸-酸溶浸取方法是一种较好的选择。考虑到泵对含固流体的输送能力问题,工艺上可采用的100 g/L硫酸,液固比10∶1(L∶kg),进行酸溶浸取,同时,为避免电镀污泥中碱性物质含量过高,影响酸溶浸取效果,其过程控制pH值不高于0。
2 湿法工艺除杂控制理论分析
硫酸-酸溶步骤可分离出不溶物滤饼(砂石、泥浆等),但其浸取液中除存在铜、镍资源化金属离子外,仍富集了大量的铁(Ⅲ)、铬(Ⅲ)、锌等杂质金属离子,该部分杂质金属离子将直接影响铜、镍资源化产品纯度及质量。
因此,浸取液的除杂显得尤为重要,一方面要求尽可能的去除浸取液中存在的铁(Ⅲ)、铬(Ⅲ)等杂质金属离子,另一方面应尽可能的避免因除杂导致的铜、镍等资源化离子的损耗;根据溶度积理论,在浸取液中要实现资源化金属离子与杂质金属离子较理想的分离,除离子浓度影响外,两者化合物的溶度积差值应尽可能大,避免因共沉淀致使资源化金属离子的损失;
一般情况下,经酸溶后的浸取液中的重金属离子主要以铁、铬、锌、铜、镍及钙的离子为主,其常见的无机化合物溶度积常数详见表1[4],相关的弱酸电离常数详见表2[4]。
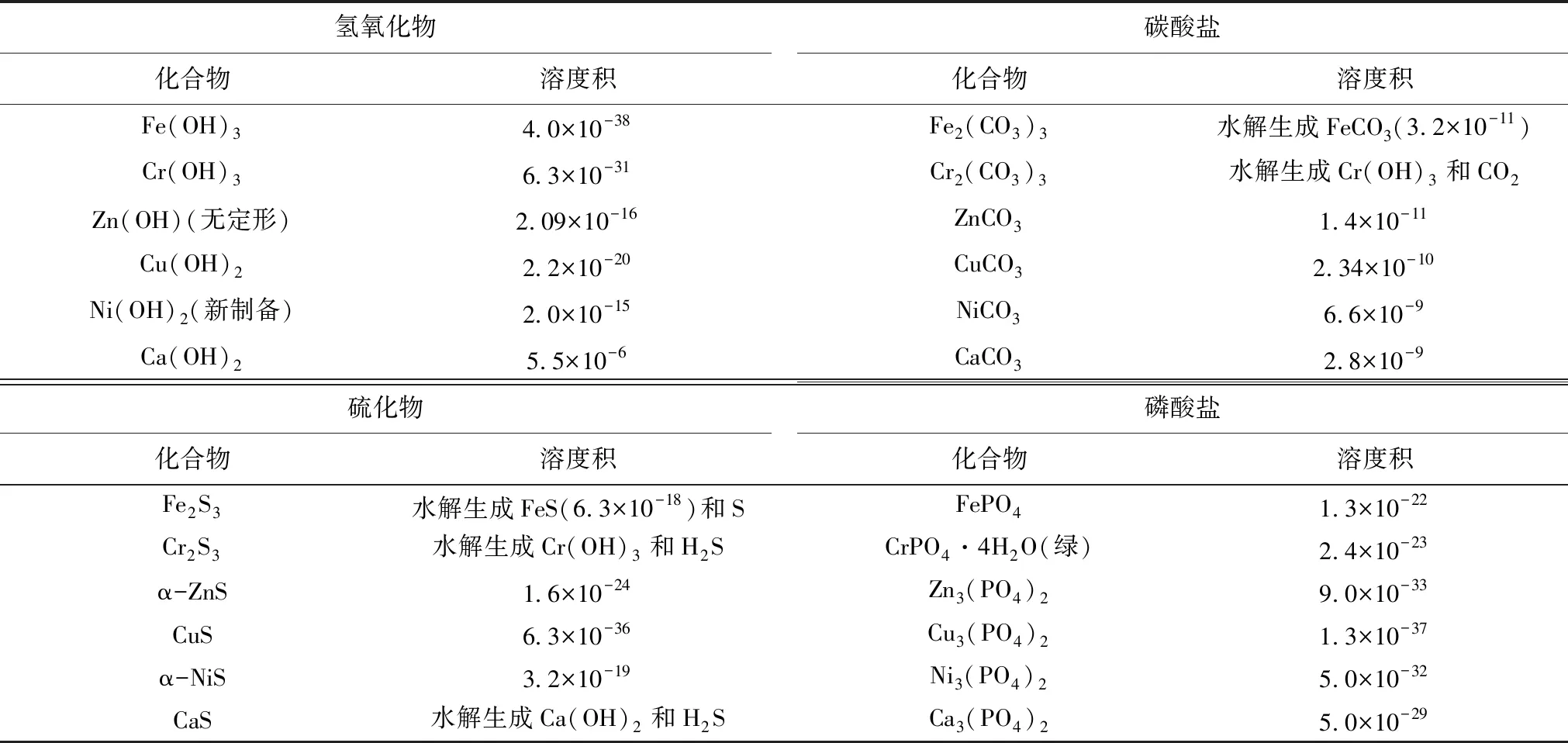
表1 铬、铁、镍、铜、锌无机化合物溶度积表

表2 相关弱酸电离常数表
在浸取液中,当某种金属离子浓度低于10-5mol/L时,可认为该种金属离子已完全沉淀,根据溶度积及电离平衡理论及表1、表2数据,采用不同方式除杂的控制终点pH值计算如下。
2.1 氢氧化法方式除杂理论分析
以铁(Ⅲ)离子除杂过程为例,涉及的化学方程式如下:
Fe3++3OH-=Fe(OH)3↓
其理论除杂控制终点pH值计算为:
Ksp,Fe(OH)3=c(Fe3+×c3(OH-)⟹c(OH-)=
298 K条件下,水的电离常数[8]:
KaH2O=1.0×10-14
c(H+)=Ka(H2O)/c(OH-)=6.29×10-4mol/L
⟹ pHFe(OH)3,(除杂)值=3.20
同理可得:
pHCr(OH)3,(除杂)值=5.60
pHCa(OH)2,(除杂)值=13.87
pHZn(OH)2,(除杂)值=8.66
2.2 硫化法方式除杂理论分析
因硫化钙、硫化铬均水解生成相应的氢氧化合物,故其理论除杂控制终点pH值可基本按相应的氢氧化合物的控制终点计。而酸性条件下,硫化铁水解生成硫化亚铁,故其除杂控制终点pH值按硫化亚铁计。
其中以锌离子除杂过程为例,涉及的化学方程式如下:
Zn2++S2-=ZnS↓
H2S=H++HS-
HS-=H++S2-
⟹ Zn2++H2S=ZnS↓+2H+
故其总化学反应平衡常数可写为:
其理论除杂控制终点pH值如下:
K=c2(H+)/c(Zn2+)
⟹pHZnS,(除杂)值=1.12
同理可得:pHFeS,(除杂)值=4.42
2.3 碳酸化法方式除杂理论分析
因碳酸铁、碳酸铬均水解生成相应的氢氧化合物,故其理论除杂控制终点pH值可基本按相应的氢氧化合物的控制终点计。而碳酸锌及碳酸钙法除杂控制终点pH值计算过程与硫化法除杂控制终点pH值计算过程类似,故可得:
pHZnCO3,(除杂)值=5.38
pHCaCO3,(除杂)值=6.54
2.4 磷酸化法方式除杂理论分析
同样,以锌离子除杂过程为例,涉及的化学方程式如下:
3Zn2++2PO42-=Zn3(PO4)2↓
H3PO4=H++H2PO4-
H2PO4-=H++HPO42-
HPO42-=H++ PO43-
⟹ 3Zn2++2H3PO4=Zn3(PO4)2↓+6H+
故其总的化学平衡常数分别为:
其理论除杂控制终点pH值如下:
⟹ pHZn3(PO4)2,(除杂)值=4.38
同理可得:
pHCa3(PO4)2,(除杂)值=5.01
pHCr(PO4)2,(除杂)值=4.69
3 铜、镍离子分步提取理论分析
硫酸-酸溶的浸取液中,镍、铜的存在形态基本以硫酸镍、硫酸铜的电解离子存在,根据硫酸镍、硫酸铜的溶解度曲线,在293 K下,硫酸镍的饱和溶解度约为370 g/L即c(Ni2+)=2.39 mol/L,硫酸铜的饱和溶解度为207 g/L即c(Cu2+)=1.29 mol/L[6]。
3.1 氢氧化法分步提取理论分析
采用氢氧化法分步提取铜、镍离子过程,涉及的化学方程式如下:
Cu2++2OH-=Cu(OH)2↓
Ni2++2OH-=Ni(OH)2↓
参照本文第2.1章节计算过程,其理论完全沉淀pH值为:
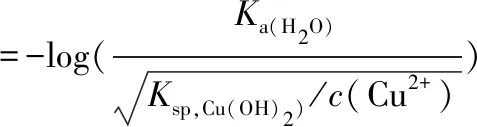
⟹ pHCu(OH)2,(完全沉淀)值=6.67
同理,pHNi(OH)2,(完全沉淀)值=9.15
同理,浸取液中铜、镍离子浓度饱和时,其理论开始沉淀pH值为:
pHCu(OH)2,(饱和,开始沉淀)值=4.11
pHNi(OH)2,(饱和,开始沉淀)值=6.46
3.2 硫化法分步提取理论分析
采用硫化法分步提取铜、镍离子过程,其总化学方程可写为:
Cu2++H2S=CuS↓+2 H+
Ni2++H2S=NiS↓+2 H+
参照本文第2.2章节计算过程,其理论完全沉淀pH值为:

⟹ pHCuS,(完全沉淀)值=-4.58
同理,pHNiS,(完全沉淀)值=3.77
同理,浸取液中铜、镍离子浓度饱和时,其理论开始沉淀pH值为:
pHCuS,(饱和,开始沉淀)值=-7.14
pHNiS,(饱和,开始沉淀)值=1.08
3.3 碳酸化合法分步提取理论分析
采用碳酸化合法分步提取铜、镍离子过程,其总化学方程可写为:
Cu2++ H2CO3=Cu CO3↓+2 H+
Ni2++ H2CO3=Ni CO3↓+2 H+
参照本文第2.3章节计算过程,其理论完全沉淀pH值为:
pHCuCO3(完全沉淀)值
⟹ pHCuCO3,(完全沉淀)值=6.00
同理,pHNiCO3,(完全沉淀)值=6.72
同理,浸取液中铜、镍离子浓度饱和时,其理论开始沉淀pH值为:
pHCuCO3,(饱和,开始沉淀)值=3.44
pHNiCO3,(饱和,开始沉淀)值=4.03
3.4 磷酸化合法分步提取理论分析
采用磷酸化合法分步提取铜、镍离子过程,其总化学方程可写为:
3Cu2++2H3PO4=Cu3(PO4)2↓+6H+
3Ni2++2H3PO4=Ni3(PO4)2↓+6H+
参照本文第2.4章节计算过程,其理论完全沉淀pH值为:
pHCu3(PO4)2(完全沉淀)=-log
⟹ pHCu3(PO4)2,(完全沉淀)值=3.58
同理,pHNi3(PO4)2,(完全沉淀)值=4.51
同理,浸取液中铜、镍离子浓度饱和时,其理论开始沉淀pH值为:
pHCu3(PO4)2,(饱和,开始沉淀)值=1.06
pHNi3(PO4)2,(饱和,开始沉淀)值=1.95
3.5 铁粉置换法分步提取理论分析
在298 K、标准状态下,各电极反应方程式、标准电极电势及电极能斯特方程详见表3[5]。

表3 298 K、标准状态下标准电极电势及电极能斯特方程
根据表3可得,浸取液中,铁粉置换铜、镍离子的置换反应方程式、标准反应电动势、反应能斯特方程,具体详见表4。

表4 298K、标准状态下标准反应电动势及反应能斯特方程
由表4可知,其标准反应电动势E1>E3>E2,一般情况下,往酸性浸取液中添加铁粉,其反应优先级(1)>(3)>(2),根据反应能斯特方程,随着反应离子和产物离子的浓度比不断降低,其反应电动势随之降低,反应趋势亦逐渐减小,直至反应达到平衡。
当酸性浸取液中铜离子置换完全即c(Cu2+)=10-5mol/L时,联立式(1)、(3)可得:

⟹c(H+)=1 710.44 mol/L
⟹ pHCu(置换完全)值=-3.23
同理,当酸性浸取液中镍离子置换完全时,联立式(2)~(3)可得:
⟹c(H+)=3.22×10-7mol/L
⟹ pHNi(置换完全)值=6.49
当酸性浸取液中铜离子浓度饱和即c(Cu2+)=1.29 mol/L时,联立式(1)、(3)可得:
c(H+)=6.14×105mol/L⟹ pHCu(饱和,开始置换)值=-5.79
当酸性浸取液中镍离子浓度饱和即c(Ni2+)=2.39 mol/L时,联立式(2)~(3)可得:
c(H+)=1.58×10-4mol/L⟹ pHNi(饱和,开始置换)值=3.80
4 工艺设计方案选择分析
无机湿法资源化回收工艺设计方案基本工艺组合框架一般为:资源化金属离子浸取工艺+不溶性杂质去除工艺+杂质金属离子去除工艺+分步提取资源化金属离子工艺。
其中杂质金属离子去除工艺及分步提取工艺的选择是评价整个湿法资源化回收工艺的核心所在,针对铜、镍离子的资源化,根据本文第二节、第三节理论分析结果,各工艺理论pH值控制点详见表5。

表5 湿法资源回收工艺方案pH值理论控制点表
根据表5数据分析,若采用单一的杂质金属离子去除工艺,均存在某种杂质金属离子去除理论pH值控制点高于铜或镍离子开始沉淀理论pH值控制点,将造成较大量的资源化金属离子的损失。
若采用单一的资源化金属离子分步提取工艺,要么铜、镍离子存在共沉淀pH值区域,例如氢氧化法、碳酸化合法、磷酸化合法;要么存在工艺过程处于强酸环境,造价成本高,pH值计选型较难,产品对下游冶炼工业可能遭二次污染,例如硫化物法、磷酸化合法;要么为液-固相反应,反应速率较慢,特别是铁粉置换镍金属时其反应电动势小反应速率将非常缓慢。
因此,综上所述,单一杂质金属离子去除工艺及资源化金属离子分步提取工艺均存在明显缺陷。通过对表5数据综合分析,可采用硫酸-酸溶浸取+过滤不溶性杂质+铁粉置换铜离子+过滤+硫化除锌+氢氧化法爆气除铁铬+过滤+氢氧化法制氢氧化镍的组合形式进行工艺设计方案。
5 湿法资源回收工艺实验验证
对工艺设计研究方案进行实验,实验步骤:硫酸-酸溶浸取(硫酸浓度100 g/L;pH值<0;反应时间2 h)+过滤不溶性杂质+铁粉置换铜离子工艺(铁粉细度150 μm,过量1.2~1.5,pH值<0.5;反应时间2 h)+过滤得产品铜(水洗除盐晾干)+硫化钠除锌(pH值=0.8~1.0;反应时间0.5 h)+ 氢氧化法爆气除杂沉淀(pH值=5.0~6.0;反应时间1.5 h)+过滤沉淀+氢氧化合物法制氢氧化镍工艺(pH值=9.0~10.0;反应时间0.5 h)+过滤得氢氧化镍。
检测标准:pH值的测定均采用《水质 pH值的测定 玻璃电极法》(GB 6920);铜镍、铁、铬离子的测定均采用《水质 32种元素的测定 电感耦合等离子体发射光谱法》(HJ 776);固体均采用微波消解法《土壤和沉积物 金属元素总量的消解 微波消解法》(HJ 832)
实验数据详见表6,数据计算结果详见表7。
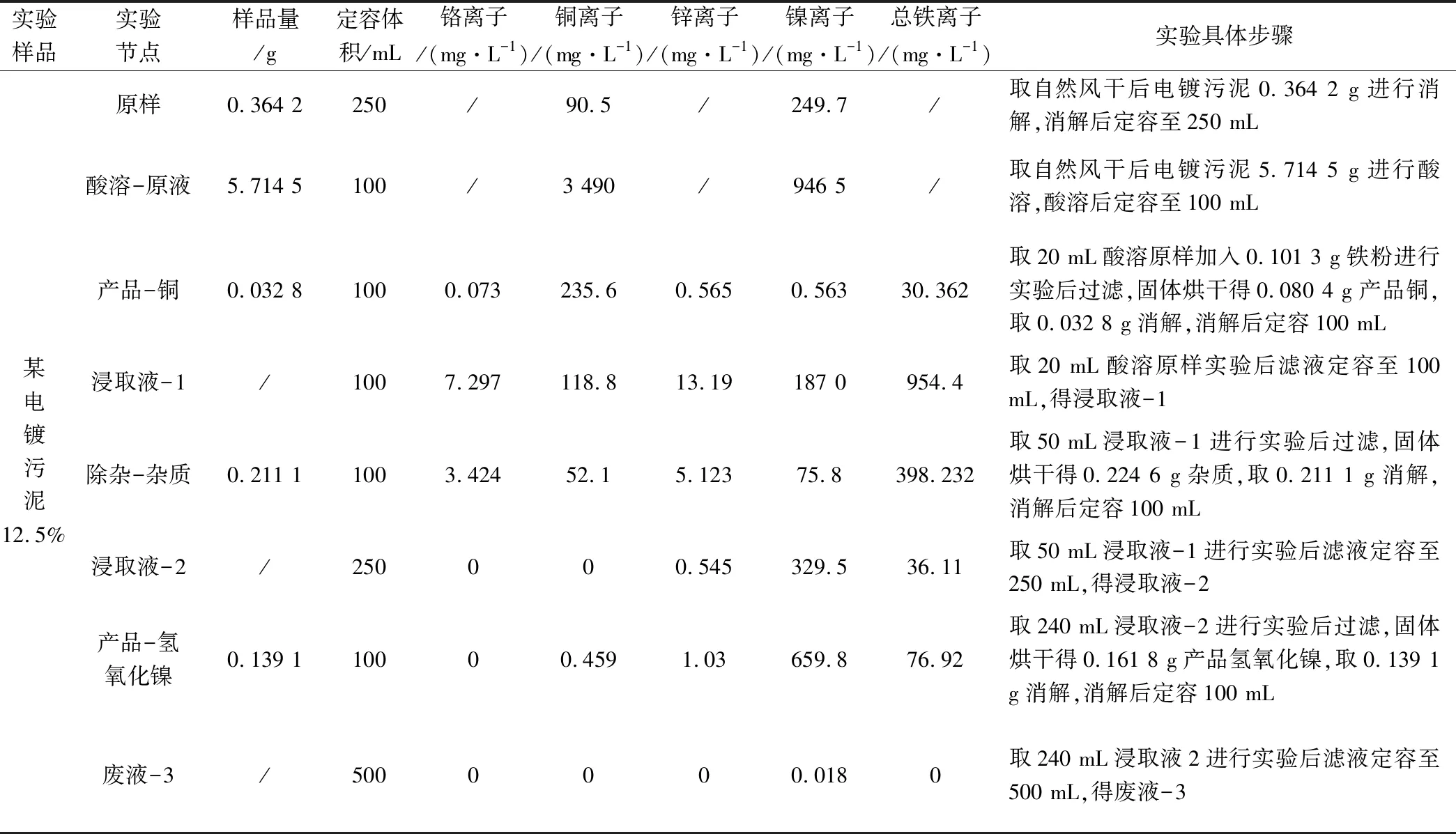
表6 具体实验数据一览表

表7 实验数据计算结果(均折算为20 mL酸溶原样折算)
实验分析:
(1)铁粉置换铜离子工艺段:铜离子置换率为82.98%,铜纯度为71.83%,主要残留为未完全反应的铁粉。限制其置换率及纯度的主要原因为置换时间不足,随着反应进行,当溶液中铜、亚铁离子比例降低,其反应电动势随之降低,反应趋势亦减小,反应速率下降,越到反应后期所需反应时间越长。
(2)硫化钠除锌工艺段:锌离子去除率为82.65%,其锌的去除率较低的主要原因为实验过程为减少硫化镍共沉淀的可能性,pH值过程控制点为0.8~1.0,未能完全去除锌离子。
(3)氢氧化法爆气除铁铬工艺段:铬离子去除率可达99.85%,其去除率较高原因为铁粉置换过程产生的亚铁离子在酸性条件下,具有较强的还原性,可将溶液中六价铬全部还原成三价铬,在后续除杂过程去除。铁离子去除率为88.79%,去除率较低的主要原因为小试采用爆气法,氧化不完全,致使部分亚铁离子未完全氧化为铁离子,氢氧化亚铁溶度积8.0×10-16[4]与氢氧化镍溶度积接近,未能在除杂工艺段去除,遗留至氢氧化合物法制氢氧化镍工艺段中与氢氧化镍共沉淀,且碱性条件下亚铁离子也易氧化成铁离子形成氢氧化铁沉淀,这也是氢氧化镍产品纯度为75.24%,主要残留物为氢氧化亚铁、氢氧化铁的主要原因。
(4)浸取液2中镍保留率为88.10%,造成镍离子损失的主要原因为氢氧化铁絮凝沉淀过程的电位网捕作用,部分的镍离子被网捕沉淀,同时在除杂工艺氢氧化法的控制点pH值为5.0~6.0,根据水的电离平衡常数可知,该区域调节过程所需碱液较少,pH值变化较灵敏,容易出现超pH值现象引起氢氧化镍的共沉淀。
综上所述,可对设计的工艺控制条件进行微调改进提高铜、镍离子资源化的质量:在铁粉置换金属铜工艺段置换时间延长或采用粒径更小的铁粉;硫化钠除锌工艺段pH值过程控制点改为1.0~1.3;爆气氢氧化法除铁铬工艺段中添加适量的双氧水增强氧化效果且对pH值控制点精确控制;
6 结语
1)通过理论分析及实验验证,针对资源化回收对象为铜、镍产品时,采用本文设计工艺方案可行性高,适用于各种品质的电镀污泥的资源化回收利用,铜、镍含量适用区间广泛,电镀污泥中铜、镍分离彻底。
2)通过本文实验验证,采用硫酸-酸溶浸取电镀污泥(硫酸浓度100 g/L;pH值<1.5;反应时间2 h),铜离子浸取率可达98.31%、镍离子浸取率可达96.63%,基本与Veglib等[5]的研究结论一致。
3)通过理论分析及实验验证,采用设计工艺可有效去除铬、锌、铁等离子,并有效资源化回收产品铜、产品氢氧化镍。铜、镍、铬、锌、铁等离子基本不发生共沉淀现象,并可有效去除铬、锌、铁等离子,其中铬离子去除率不低于99.85%,锌离子去除率不低于82.65%,铁离子去除率不低于88.79%。其铁粉置换铜离子率不低于82.98%,铜产品纯度不低于71.83%,镍保留率不低于88.10%,氢氧化镍产品纯度不低于75.24%。
4)采用本文设计工艺后,废液中铜、镍、铬、锌、铁离子可满足《污水综合排放标准》(GB 8978—1996)第一类污染物最高允许排放浓度,无需增设车间污水处理设施。
