克霉唑阴道乳膏的使用中稳定性研究
2023-12-06廖志刚叶德晓游泽芳
廖志刚,叶德晓,游泽芳
(广东华润顺峰药业有限公司,广东 佛山 528000)
使用中稳定性是已上市药品在临床使用过程中的稳定性,包括医院临床用药期间的稳定性和患者在家使用中的稳定性。需要进行使用中稳定性考察的药物包括多剂量包装药物、临床前需重新配制药物、部分高阻隔包装的药物及部分需再处理的口服固体制剂等。关于使用中稳定性试验的考察目的,ICH、WHO、EMEA、FDA和NMPA均有相关指南描述。其中ICH Q1A(R)《新原料药和制剂稳定性试验》中的制剂章节中明确规定:在稀释或配伍后的药物进行使用中稳定性试验,建立一个使用期限(in-use period),为说明书或标签提供关于制备、贮存条件、配伍后药物的使用期限等信息[1]。WHO在2018年更新发布的《原料药及药品的稳定性测试》中对药物使用中稳定性考察要求尽可能地模拟实际使用的过程,检测药品制剂使用期间的化学、微生物和物理特性等项目。WHO指导文件草案212110条款中描述对多剂量药物在开启包装第一次使用后,建立一个使用期限,在该时间期限内制剂可以在保证质量的前提下继续使用。EMA在2001年发布的《关于人用药物使用期间稳定性试验的指导文件》中明确了使用中稳定性的概念,同时较为详细地描述了使用中稳定性考察的试验设计、试验参数、批次的选择、试验的对象、试验条件、分析过程、数据描述和数据评价等。FDA明确规定对于多剂量包装的软膏、气雾剂等创面用制剂和无菌眼用制剂,在存放和使用过程中易泪液、受创伤面及环境中微生物的污染,均应进行使用中稳定性考察。《中国药典》2020版通则9001“原料药物与制剂稳定性试验指导原则”要求部分药物制剂应考察临用时配制和使用过程中的稳定性。《化学药物(原料药和制剂)稳定性研究技术指导原则》明确了使用中稳定性的研究对象为临用现配的制剂,或是多剂量包装开启后有一定使用期限的制剂;并指出长期稳定性试验的放置条件及考察时间要充分考虑贮藏和使用的整个过程。同时,《已上市化学药品药学变更研究技术指导原则》和《创新药(化学药)临床试验期间药学变更技术指导原则》等多个指导原则均提出部分药物还应进行药物使用中稳定性研究,但缺少具体详细的描述。
本次研究用药品为阴道用克霉唑阴道乳膏,在注册申报的使用中稳定考察中依据原研产品说明书和国内外指南要求设计,全面评价了产品的使用中稳定性,保证产品在开封后的有效性和安全性,为产品的开封后的使用期限提供依据。
1 仪器与材料
1.1 主要仪器
显微镜(DM70,德国徕卡(Leica)仪器有限公司);高效液相色谱仪(Agilent 1200,安捷伦科技有限公司);高效液相色谱仪(Agilent 1260,安捷伦科技有限公司);数显黏度计(DV-S,广州艾欣科学仪器有限公司);pH计(S220-B,梅特勒-托利多仪器有限公司);超声波清洗器(KQ3200,昆山市超声仪器有限公司);流变仪(MCR102e,安东帕);多功能透皮扩散仪(SYT-103,延吉艾迪扼科技有限公司)。
1.2 试剂药品
克霉唑阴道乳膏(广东华润顺峰药业有限公司生产,1%,30 g/支,20210601批和20210602批留样12月样品);克霉唑阴道乳膏(加拿大拜耳,1%,GP01Z3H批);邻苯二甲酸氢钾标准缓冲液(pH值4.003);磷酸盐标准缓冲液(pH值5.865);磷酸氢二钾(化学纯,广州化学试剂厂);磷酸二氢钾(化学纯,广州化学试剂厂);四丁基硫酸氢铵(化学纯;上海阿拉丁生化科技股份有限公司);磷酸(化学纯,广州化学试剂厂);聚乙二醇400(化学纯,上海凌峰化学试剂有限公司);乙腈(色谱纯,上海星可高纯溶剂有限公司);甲醇(色谱纯,上海星可高纯溶剂有限公司);克霉唑对照品(中国食品药品检定研究院);苯甲醇对照品(中国食品药品检定研究院);克霉唑杂质A对照品(CTAO);TSA培养基、SDA培养基、TSB培养基、SDB培养基、CAM培养基、MSA培养基。
1.3 方案设计
根据克霉唑阴道乳膏说明书中描述“(1)阴道内给药,每天用药1次,每次5 g,连续治疗6 d;(2)阴道外给药,每天用药1~2次,每次适量,连续治疗不超过7 d”,并模拟产品在临床中使用的实际过程,从放置条件、取样时间点和考察项目进行产品使用中稳定性试验方案的设计。
放置条件设计:依据产品说明书的贮藏环境及实际使用过程中的环境进行设置,克霉唑阴道乳膏两批样品的放置条件为室温。
试验时间区间和取样时间点设计:依据产品说明书的使用说明和实际使用过程,为保证产品在该期限内的有效性和安全性,试验时间区间设置为30 d,使用过程中产品稳定性试验共包括9个取样点(每次取样每管取样约1 g或5 g,剩余样品拧盖密封好,继续于试验条件放样),取样点设计如表1所示。

表1 试验时间区间和取样点设计
考察项目设计:使用中稳定性试验考察项目需选择最能反映该过程变化以及产品使用有效性和安全性的项目。本产品的考察项目涉及外观性状、均匀性、分层现象、乳滴、含量、有关物质、黏度、酸碱度、微生物、流变学性质、体外释放。不同取样时间点所考察的项目有所不同,其中第0天、第6天、第30天进行全部项目的检测,第15天进行外观性状、均匀性、分层现象、乳滴、含量、有关物质、黏度、酸碱度项目检测,1,2,3,4,5 d只进行外观性状的检测,对于考察项目的限度参考内控质量标准限度。
2 方法和结果
2.1 性状、均匀性、分层现象
采用目视法对两批0,1,2,3,4,5,6 ,15,30 d取样点的样品进行性状观察,0,6,15,30 d取样点样品进行均匀性和分层现象的检测。结果显示:性状结果均为白色乳膏;均匀性结果为均涂布于手上观察基质均匀、膏体细腻,无刺激性;分层现象结果为膏体无油水分离的分层现象。性状、均匀性、分层现象均符合标准要求。
2.2 乳滴
取0,6,15,30 d取样点样品的乳膏适量置于载玻片上,用盖玻片盖住,置于显微镜下观察,观察并统计乳滴粒径分布。结果如表2所示,两批样品乳滴大小均匀,大多数乳滴在5 μm以内,视野中存在有极少数6~10 μm的大乳滴,符合标准要求。
2.3 黏度
取0,6,15,30 d取样点样品适量,照黏度测定法(《中国药典2020年版》四部通则0633第三法)测定。结果如表3所示,两批样品开封使用后黏度与0 d相比有上升趋势,但均符合标准要求,说明使用过程中产品的黏度较稳定。

表3 克霉唑阴道乳膏黏度测定结果 单位:Pa·s
2.4 酸碱度
取0,6,15,30 d取样点样品,依法测定(《中国药典2020 年版四部》通则0631)。结果如表4所示,两批样品开封使用后酸碱度与0天相比有下降趋势,但仍均符合标准要求,说明使用过程中酸碱度较稳定。
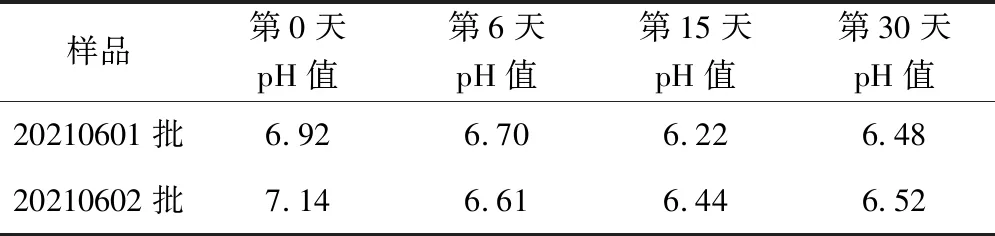
表4 克霉唑阴道乳膏酸碱度测定结果
2.5 含量与鉴别
采用高效液相色谱法(《中国药典》2020年版通则0512)测定产品中克霉唑和苯甲醇的含量,色谱柱(Waters XBridge Shield RP184.6 mm×150 mm 5 μm),检测波长:215 nm,流速:1.0 mL/min,柱温:30 ℃,进样体积10 μL,试剂为磷酸氢二钾和乙腈。含量测定项下的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致,按外标法以峰面积计算供试品中克霉唑和苯甲醇的含量。结果如表5所示,两批样品开封后克霉唑含量具有下降趋势,第30天为标示量的99.6%,符合标准要求;苯甲醇含量在0.1~0.2 mg间波动,与0 d相比无明显上升或降低趋势,各时间点均符合标准要求。

表5 克霉唑阴道乳膏含量测定结果
2.6 有关物质
采用高效液相色谱法(《中国药典2020年版四部》通则0512)测定产品中有关物质。使用甲醇处理供试样品、克霉唑对照品、克霉唑杂质A对照品;色谱柱(Ultimate XB-C84.6 mm×150 mm 5μm),捕集柱(Ghost-Buster Column Ⅱ 3.0 mm×50 mm);检测波长:210 nm,流速:1.0 mL/min,柱温:40 ℃,进样体积10 μL,试剂为磷酸二氢钾、四丁基硫酸氢铵和乙腈。测定结果如表6所示,两批开封后使用样品的有关物质总杂与0 d相比在0.024%~0.068%之间波动,杂质A在0.001%~0.007%波动,其他未知单杂在0.002%~0.042%波动,无明显上升或降低趋势,符合标准要求。

表6 克霉唑阴道乳膏有关物质质量含量测定结果 单位:%
2.7 微生物
采用微生物培养法测定产品中的微生物,对两批样品的需氧菌总数、霉菌和酵母菌总数、铜绿假单胞菌、金黄色葡萄球菌、白念珠菌进行测定。结果如表7所示,两批样品开封使用后需氧菌总数、霉菌和酵母菌总数、铜绿假单胞菌、金黄色葡萄球菌、白念珠菌与0 d相比无变化,抑菌能力稳定,限度均符合标准要求。

表7 克霉唑阴道乳膏微生物测定结果
2.8 流变学特性
采用安东帕MCR102e流变仪测定产品中的流变学特性,测定两批样品的黏度曲线、3ITT触变性、振幅扫描、屈服应力。结果如表8所示,两批开封前后的样品均为假塑性流体,平均黏度与0 d相比有上升趋势,与2.3用黏度计测定的结果相似;3ITT触变性(δ)在0.25~13.90间波动,无明显变化趋势;振幅扫描下线性粘弹区两批样品的变化趋势存在差异,但仍在变化范围中,20210601批储能模量为下降趋势,20210602批整体为上升趋势;屈服应力两批整体呈上升趋势,说明需要增加应力才能发生流动,但在变化范围内。两批开封前后的流变特性整体上与0 d相比较稳定。
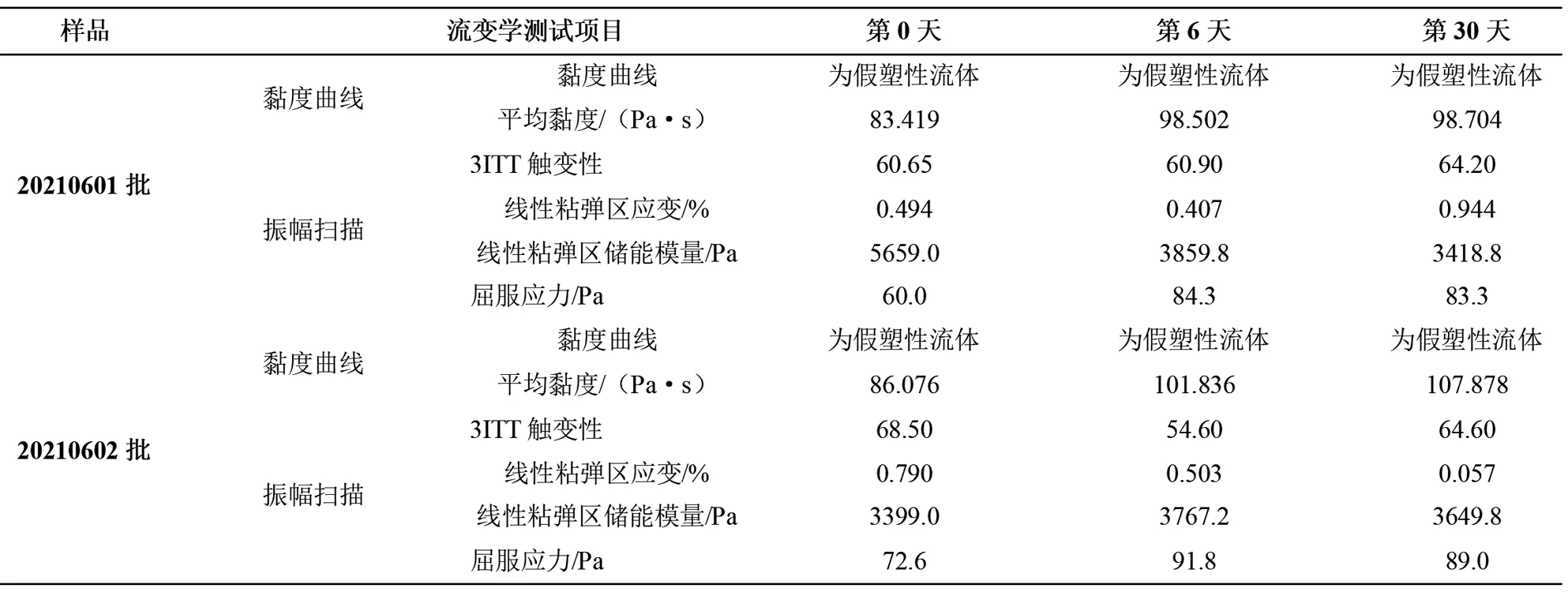
表8 克霉唑阴道乳膏流变学特性测定结果
2.9 体外释放
采用Franz扩散池法测定制剂的体外释放情况,使用中稳定性样品的释放度与参比制剂的0 d进行平行比较。释放透皮介质:30%聚乙二醇400-磷酸二氢钾溶液,体外释放扩散体积:1.5 cm2,转速:600 r/min,扩散池温度:37 ℃。色谱柱(Agilent HPH-C82.7 μm 4.6 mm×100 mm),柱温:30 ℃,流速:1.0 mL/min,进样体积:10 L,检测波长220 nm,试剂为磷酸二氢钾、四丁基硫酸氢铵、乙腈。结果如表9所示,两批样品的体外透皮释放速率与0 d相比均无明显变化,与参比制剂GP01Z3H批0 d释放速率的置信区间在75%~133.33%范围内,说明开封前后制剂的体外释放稳定。

表9 克霉唑阴道乳膏体外释放测定结果(对照样品/参比制剂GP01Z3H批0 d)
3 讨论
对国内使用中稳定性研究的文献进行检索,发现我国目前对药物制剂使用中的稳定性研究较少,仅10余篇报道,且多集中于注射剂和粉剂溶解后的使用中稳定性研究,缺少对多剂量包装的半固体制剂的研究[2]。在临床使用过程中,对于多剂量包装制剂,在初次使用后会接触到环境中的氧气、水分、光线和微生物等,可能会影响制剂的外观色泽、含量、有关物质和微生物等,从而对药物的安全性和有效性产生影响。为此,合理设计药物使用中稳定性的研究方案,开展使用中稳定性研究,指导临床用药安全,保证使用中药物的有效性。
1%克霉唑阴道乳膏(30 g/支)作为多剂量包装的药物制剂,本研究对两批经过12月留样的中试规模样品,满足了国内申报稳定性样品及EMA和FDA指导原则的要求。此外,WHO、EMA和ICH等均推荐货架期末的样品进行试验,但在实际注册申报中无法得到货架期末的数据,也推荐提供12月或注册申报时长期稳定性的最后一个时间点的稳定性数据,该情况建议对稳定性数据进行分析有无下降趋势,视情况是否补充货架期末的使用中稳定性数据[3]。依据产品说明书模拟临床实际使用过程在实际使用条件下每次取样,试验放置条件为室温环境,试验时间区间设置为30 d,共9个取样点,覆盖了说明书中“阴道内给药,连续治疗6 d”和“阴道外给药,连续治疗不超过7 d”的时间。考察项目根据乳膏剂型进行设计,限度参考产品的质量标准,从而保证药物使用中的安全性和有效性,包含了最能反映使用过程中稳定性变化的项目,如有关物质、外观性状;乳膏剂型的质量特征的项目,如均匀性、分层现象、乳滴、黏度、酸碱度、流变学特性;药品有效性的项目,如克霉唑含量、体外释放;药品安全性的项目,如微生物;还有使用期间抑菌剂苯甲醇含量的变化。
4 结论
本研究结果显示,1%克霉唑阴道乳膏(30 g/支)2批样品在开封后30 d内不同时间点的质量考察项目,制剂的外观性状、均匀性、分层现象、乳滴、含量、有关物质、黏度、酸碱度、微生物均符合标准要求,6 d和30 d的流变学特性与0 d相比无明显变化趋势,6 d和30 d的体外释放速率与0 d和参比制剂0 d相比无明显变化。使用中稳定性数据表明在临床实际使用过程中,克霉唑阴道乳膏在开封后30 d内质量稳定,药物具有良好的安全性和有效性。
