多药共递送纳米胶束用于协同抗肿瘤
2023-12-06李梦雅李秀娜宁倩
李梦雅,李秀娜,宁倩
(湖南医药学院 药学院,新型抗体药物及其智能运输系统湖南省重点实验室,湖南 怀化 418000)
癌症严重威胁人类生命健康。根据最新癌症统计数据报告显示,2020年全球范围内新增癌症病例1 930万,死亡人数近1 000万[1]。但现有的多数药物并不能使癌症患者完全康复[2]。一方面,由于部分抗癌药物自身水溶性低,以及血液稳定性差极易被降解导致药物的生物利用不足。同时,多数化疗药物自身不具有肿瘤靶向性导致全身毒性的产生。此外,肿瘤多药耐药(Multidrug Resistance,MDR)的普遍发生,加之MDR拮抗剂自身溶解度低毒副作用大最终导致治疗失败[3]。另一方面,癌症发病机制复杂,导致单一的药物治疗不足以抑制癌细胞的增殖、生长和迁移[3]。可喜的是,临床研究结果表明,多药联合治疗不但能减少副作用还能克服单一药物治疗的缺陷,因此,构建一种高效、可行、生物相容性好的多药联合治疗的递送系统尤为重要。
随着纳米技术的发展和纳米药物载体在多药共传递中的应用,研究者发现,纳米胶束具有良好的组织相容性、可控的粒径大小(10~200 nm)、易于结构修饰改性及药物控释等特点,使其相对于其他类型的纳米药物载体更合适于药物传递[4]。纳米胶束通常是由两亲性共聚物,自组装形成具有亲水外壳和疏水内核的纳米级颗粒(图1)[5-6]。并且在以往的研究中,纳米胶束被设计用于化疗药物、核酸或是其他抗癌药物的单载给药,从而改善被载药物的溶解性同时通过增强通透性和滞留效应(Enhanced permeability and retention effect EPR)来提高药物的被动靶向性,使抗癌药物能够很好地传递到肿瘤组织中,减少抗癌药物的毒副作用[7-10]。但单载抗癌的方案依然面临着重大的挑战,如MDR以及肿瘤复发等问题。因此,研究者基于纳米胶束易于结构修饰改性的特点,通过结构重建与修饰合成出多种新型的具有多药共负荷能力的多功能胶束,使其在具备单载胶束优点的同时还具有多药共负荷的能力[11]。而近年来,共载胶束在多药协同抗肿瘤研究中的应用最主要集中在传统化疗药物之间、化疗药物与核酸类药物之间的应用(表1)。

表1 纳米胶束在多药协同抗肿瘤研究中的应用
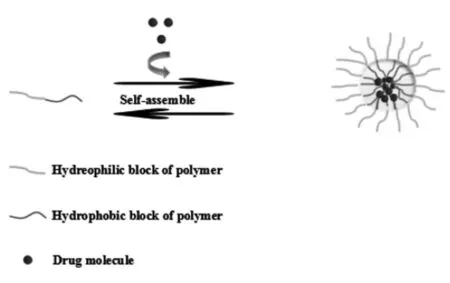
图1 聚合物胶束的结构示意图
随着近年来人们对免疫疗法的深入研究以及免疫治疗在抗肿瘤领域展现出的显著治疗效果[12-13],启发了研究者设计免疫治疗剂与化疗药物共载纳米胶束的假想,并且在实践中取得了一定的研究成果。而本文的重点也在于阐述纳米胶束在共载化疗药物、化疗药物与核酸药物以及化疗药物与免疫治疗剂中的应用,同时对纳米胶束共载体系的前景及问题作出了展望。
1 共传递纳米胶束实现化疗药物的协同抗肿瘤
1.1 传统化疗药物共载纳米胶束
共传递多种抗癌药物的纳米胶束的制备,在协同抗癌治疗中具有重大研究意义。其不但能改善化疗药物生物利用度、降低毒副作用,还能克服单一药物治疗缺陷,提高抗癌的治疗效果。而近几年来有不少新型的纳米胶束被设计并应用于一些治疗效果强、抗癌谱广的化疗药物如阿霉素、紫杉醇、顺铂等[14-15]。Li M课题组[16]以顺铂前药为交联剂,制备了盐酸阿霉素吸附的琥珀酸修饰右旋葡萄糖(Dex-SA)交联胶束(Dex-Sa-Dox-Pt(II))。该共载体系在荷瘤小鼠体内表现出的治疗效果比游离阿霉素以及顺铂前药更加显著。Han R[17]课题组研制了一种由亲水性聚多胺树突状壳和疏水聚乳酸核组成的两亲性二嵌段胶束用于共传递5-氟尿嘧啶与阿霉素(DOX)。细胞毒性结果显示(5-Fu/Dox-DNM)分别是Dox-DNM和5-Fu-DNM的11.2倍和6.1倍,而且对MDA-MB-231异种移植瘤小鼠的肿瘤生长有明显的抑制作用。在两亲性二嵌段多聚体基础上,Song W[18]课题组制备了基于聚乙二醇-聚L-谷氨酸-聚L-苯丙氨酸mPEG-b-P(Glu)-b-P(Phe)的两亲性三嵌段共聚物,用于顺铂与多西紫杉醇(PTX)的共传递。在人肺癌异种移植小鼠模型中,PTX + CDDP胶束与游离给药组以及单载胶束组相比除了表现出更显著的肿瘤抑制外,还表现出更低的毒副作用。此外,Cai L[19]课题组开发了一种三层线性树枝状端粒树状胶束(TM),用于共传递顺铂与PTX。在SKOV-3卵巢癌异种移植小鼠模型中共载纳米胶束组与游离药物组和单加载TM配方相比,具有更有效的肿瘤靶向、更低的毒副作用和更强的抗肿瘤作用。与之不同的是,Tai W课题组[20]设计了一种通过接枝共聚物的折叠而形成纳米胶束载体的接枝共聚物(Glu(CPT)-NCA),该胶束被用于共传递DOX与喜树碱。并且在异种肺癌移植小鼠模型中,该纳米胶束载体与游离药物相比表现出更强的肿瘤蓄积性和更明显的抗癌活性。进一步的研究中Ma Y[21]课题组将阿霉素经酸敏感键与Pluronic F127-壳聚糖(F127-CS)聚合物结合,形成pH值敏感的聚合物胶束(F127-CS-DOX)用于DOX与PTX的共转运。该共载胶束以酸性为触发释药条件,并且在大鼠体内PTX和DOX的药时曲线下面积(AUC0-∞)分别是游离 PTX和DOX组在大鼠体内的3.97和4.38倍,这也体现了该胶束在药物控释以及提高药物生物利用度方面的潜能。总的来说,共载纳米胶束不但能实现多种化疗药物共载、提高化疗药物的溶解性、生物利用度、降低毒副作用等,而且更重要的是共载纳米胶束能实现1+1>2的协同抗肿瘤效应。
1.2 MDR拮抗剂与化疗药物共载胶束
MDR是肿瘤细胞可能发生的主要并发症之一,而形成机制中外排介导的耐药主要是由ATP结合盒(ABC)家族引起的,包括p-糖蛋白(p-gp)和乳腺癌耐药蛋白(BCRP)[22]。因此,阻断p-gp的功能或者通过特异性药物抑制了p-gp的表达被认为是逆转MDR的有效方案。但由于绝大多数的p-gp拮抗剂(维拉帕米、西地那非、姜黄素等)与化疗药物的水溶性低或毒副作用严重,限制了其临床应用。由此,研究者设想通过利用胶束优越的特性共传递p-gp拮抗剂与化疗药物,达到在逆转肿瘤细胞的MDR的同时恢复甚至是提高化疗药物的抗肿瘤效力的目的。Guo Y等[23]制备了多西紫杉醇(DTX)共价结合的mPEG-PLGA-SS-DTX多功能胶束,负载维拉帕米。该共载纳米胶束在MCF-7 / ADR乳腺癌细胞中表现出很高的摄药量,这表明该共载纳米胶束能有效地传递维拉帕米实现p-gp显著的抑制性作用。Marques J G等[24]通过溶剂置换方法制备了PEG-PLA嵌段共聚物组成的胶束载体,共传递p-gp拮抗剂地西那非与化疗药物克列佐替尼。两种药物通过胶束载体给药后不但明显地逆转了MDR作用,同时抗肿瘤活性与游离给药组相比增加了2.7倍。Li J等[25]以mPEG-SS-C18为载体,制备了简单的氧化还原反应型胶束,用于负载PTX和达沙替尼(DAS)。与MCF-7乳腺癌细胞相比,DAS和PTX共载胶束在MCF-7 / ADR乳腺癌细胞中表现出比其他游离给药更强的细胞毒性和更高的细胞内药物浓度.Emami J[26]等将维生素A酸(RA)与Pluronic F127(PF127)通过酯键缀合。 用生育酚聚乙二醇1 000(TPGS)形成混合胶束,用于PTX和RA共同递送。该混合胶束具有较长的半衰期和更低的血浆药物浓度,此外负载PTX与RA的混合胶束与游离给药组相比具有更强的肿瘤细胞毒性。Ma W等[28]研制了一种活性肿瘤靶向共递送胶束(DoxCur)-PMS,包含两种协同药物,即DOX和p-gp抑制剂姜黄素(CUR)。在4T1荷瘤小鼠模型中(Doxcur)-PMS表现出显著的肿瘤生长抑制,而且与游离的DOX,DOX-PMS相比,(Doxcur)-PMS对心脏组织的损伤更小。Huo Q[29]等将p-gp抑制剂双硫仑(DSF)包裹于由PTX共价结合的聚乙二醇-聚赖氨酸(PEG-b-PLL)胶束的疏水核心,形成了具有电荷逆转作用的纳米胶束。该胶束在MCF-7/ADR乳腺癌细胞中的细胞摄药与细胞毒性明显增强。以上结果表明,通过纳米胶束特殊的壳核结构同时负载p-gp抑制剂与化疗药物不但能逆转MDR,同时还能降低两者的毒副作用,增加药物在肿瘤组织中的蓄积量以及化疗药物对MDR癌细胞的杀伤作用。
2 共传递纳米胶束实现化疗与基因治疗的协同抗肿瘤
2.1 肿瘤抑制性核酸与化疗药物共载纳米胶束
核酸与化疗药物的联合治疗是提高肿瘤治疗效果的有效方法,但是裸露的核酸分子由于核酸酶的降解、网状内皮系统(RES)的快速捕获和有效的内体逃逸等障碍很难到达作用位点[30-31]。为了克服这些障碍,研究者巧妙地利用了胶束的特性在加载化疗药物的同时通过静电相互作用吸附带负电荷的核酸,实现核酸与化疗药物的共传递,达到核酸与化疗药物的联合治疗提高肿瘤治疗效果的目的。Lin J等[32]基于聚N-ε-苄氧羰基-L-赖氨酸(PZLL)和树枝状聚酰胺胺(PAMAM)嵌段共聚物(PZLL-D3)制备用于化学治疗药物和治疗性基因共递送的阳离子胶束纳米颗粒。研究表明该阳离子胶束能保护pDNA免受核酸酶的降解以及在293T和HeLa细胞中表现出高效的基因转染效率。Cheng Q等[33]通过mPEG-PCL-graft-PDMAEMA (PECD)胶束也探讨了其共传递DOX和siRNA的可行性,经过荧光标记与流式细胞术分析显示DOX和siRNA能成功共转染进入细胞并且阳性细胞比例分别为94.6%和99.5%。这表明该胶束在共传递DOX和siRNA用于癌症治疗方面具有很大的潜能。Chen L等[28]合成了一种两亲性双功能普鲁兰糖苷衍生物(PDP),PDP能自组装形成阳离子核-壳纳米胶束,用于负载DOX与肿瘤抑制基因p50,研究表明该胶束不但可以有效地运输基因p53进入MCF-7细胞,而且与游离DOX或p53递送相比PDP胶束共传递组显示出更高的细胞毒性,诱导肿瘤细胞更高的凋亡率以及更有效地阻断癌细胞迁移。Gong C[34]等设计具有多肽靶向的(ATG7)siRNA与DOX交联的纳米胶束,用于乳腺癌的治疗。研究结果表明DTX和siATG7交联胶束比单独DTX处理的细胞毒性和细胞凋亡高2.5倍和1.7倍,这证明了该交联胶束能很好的实现共传递并增强对癌细胞的杀伤作用。Chen M[35]等为实现喜树碱(CPT)和与肿瘤坏死因子-α(TNF-α)质粒共传递,合成了以四臂聚乙二醇和聚天冬氨酸(PAsp)为多臂性两亲共聚物的响应性胶束。该胶束除了显示出良好的还原刺激响应性释药外,还能增强pDNA在低N / P值下的基因转染率同时还表现出更强的协同细胞毒性和更大的肿瘤抑制率。这体现出该多功能胶束对基因与化疗药物共传递具有较好的应用前景。Yin T[36]等以透明质酸为基础构建了一种新型的氧化还原敏感胶束体系 (HA-ss-(OA-g-bPEI),HSOP),用于紫杉醇和siRNA (si-AURKA)的肿瘤靶向共转运。HSOP胶束对于PTX和siRNA均表现出优异的负载能力并能在还原条件下响应性释放,同时扩大了药物之间的协同作用导致了更大的抗肿瘤效力。综上所述,纳米胶束作为基因与化疗药物的共传载体不但能很大程度上保护基因免受降解外,还能提高基因的转染率实现肿瘤组织靶向和响应性释药,最终达到提高对肿瘤抑制与杀伤的目的。
2.2 耐药蛋白siRNA与化疗药物共载纳米胶束
siRNA是一种被广泛研究的核酸类药物,能介导基因沉默阻止耐药蛋白在癌细胞中的过表达从而达到逆转多药耐药的效果。由此研究者设计并合成了不少共传递耐药蛋白siRNA与化疗药物的纳米胶束,用于逆转MDR提高化疗药物在治疗中的敏感性。例如,Suo A等[37]成功合成了梳状两亲性共聚物甲氧基聚乙二醇接枝聚L-赖氨酸-嵌段-聚L-苯丙氨酸-9(mPEG-g-PLL-b-Phe),用于共传递DOX 与 (p-gp) siRNA。并且在体外细胞毒性测定中DOX /p-gp siRNA纳米胶束显示出比单载DOX的纳米胶束更高的细胞毒性。Wu Y[38]采用了一种高效的多功能肿瘤靶向纳米胶束(PECL3)作为阿霉素与(p-gp) siRNA的共载体,此种纳米胶束不但能有效地将p-gp siRNA传递到乳腺癌耐药细胞(MCF-7/ADR),还能显著地抑制p-gp表达水平和MCF-7/ADR肿瘤的生长。Zhang C G[39]设计了基于正丁二酰基壳聚糖-聚-L-赖氨酸-棕榈酸(NSC-PLL-PA)聚合物制备三嵌段共聚物胶束以共同递送阿霉素和(p-gp) siRNA。此胶束由于下调了p-gp 在HepG2/ADM细胞中的表达加上阿霉素的作用导致其抗肿瘤效果显著地增强。此外,Yang S D等[40]开发了一种新型的含有紫杉醇的胶束和载有MDR1 siRNA的低密度脂蛋白(LDL)纳米颗粒。这种“二元聚合物”是pH值和还原双敏核心交联胶束。在保护siRNA免受巨噬细胞吞噬作用的降解下,还能明显下调MDR1 siRNA水平以及p-gp的表达。类似的Zhu W 等[41]合成了具有双重PH/氧化还原敏感性和靶向作用的新型“二元聚合物”低密度脂蛋白-N-琥酰壳聚糖-胱胺-咪唑丙烯酸 (LDL-NSC-SS-UA)用于乳腺癌耐药蛋白siRNA和紫杉醇的递送。该胶束除了表现出较高靶向与响应性释药外,在MCF-7/Taxol细胞中还表现出优异的抗肿瘤活性并显著下调乳腺癌耐药蛋白质和mRNA表达水平。综上所述,纳米胶束的特殊结构不但能够有效地保护siRNA与化疗药物,同时能也有效地下调耐药蛋白逆转MDR并与化疗药物共同作用产生显著的协同抗肿瘤效果。
3 共传递纳米胶束实现化疗与免疫治疗的协同抗肿瘤
人类的免疫系统具有高度的特异性,能正确地识别肿瘤细胞中“非自我”改变,清除肿瘤细胞。这意味着,能通过一些免疫治疗剂(如疫苗、检查点抑制剂、核酸等)激活患者抗肿瘤免疫细胞,达到精准而又高效的抗肿瘤[42-43]。研究表明当免疫治疗剂与化疗药物联合应用的时候,能显著地 增强对肿瘤的治疗效应,但往往需要一个安全有效的递送系统[44]。因此,研究者设想将纳米胶束作为免疫治疗剂与化疗药物的共传递载体用于抗肿瘤的治疗。例如,Roy A等[45]将有较强免疫刺激活性的聚合物SP-LPS(LPS为巨噬细胞的一种强有力的刺激因子)与紫杉醇结合,制成化学免疫治疗结合胶束。该胶束表现出的高抗癌活性、低毒性与易输送等优点体现了该胶束在共载方面的潜力。此外Sun J J[46]等合成了以POEG为亲水性嵌段和PNLG(NLG919,IDO 1-选择性抑制剂)为疏水性嵌段的前药胶束载体PSSN10用于共传递免疫检查点抑制剂NLG919与阿霉素(DOX)。该胶束通过抑制调节T细胞增殖促进效应T细胞增殖,恢复了抗肿瘤免疫细胞对肿瘤的杀伤效应。此外共载胶束与单载NLG919或DOX胶束相比具有更强的细胞毒性和显著的肿瘤抑制效应。Mei L等[47]通过DSPE-PEG-N3和DSPE-PEG-ALK的混合,构建了具有不同粒径的胶束,用于阿霉素和单磷酰脂质A(TLR4的拮抗剂)传递。 该混合胶束与单载胶束相比不但增加了细胞摄药和细胞毒性,同时还引起显著的免疫原性细胞死亡(ICD)以及诱导DCs吞噬,加工和呈递。从而产生了强效的免疫治疗效果,实现了实质性的抗肿瘤和转移抑制效果。种种研究表明纳米胶束不但能实现共载并降低毒性,同时能激活抗肿瘤免疫细胞引起强效的免疫治疗效果,实现化疗与免疫治疗的协同抗肿瘤。因此纳米胶束在共传递免疫治疗剂与化疗药领域有着巨大的潜力。
4 总结与展望
使用纳米胶束实现化疗药物与化疗药物、化疗药物与核酸以及化疗药物与免疫治疗剂等之间的共递送联合治疗相对单一治疗具有更显著的抗肿瘤效果。然而,在共传递方法方面仍存在许多挑战,包括药物的有效载药量跟包封率、纳米胶束的稳定性、精准的肿瘤靶向效应等。因此,对新型纳米胶束的开发以及对优势胶束在具体应用领域的优化依然刻不容缓。此外,对于经胶束共传递的治疗药物之间的相互作用或胶束与治疗药物之间的相互作用的认识与研究依然不足,这也许将是未来该领域的一个重点研究方向。 综合考虑,共传递纳米胶束在改善抗癌药物缺陷同时克服单一药物治疗的不足的问题上具有很大的发展前景。
