TFAP2A对肾小球硬化相关基因NPHS2的转录调控作用观察
2023-12-01张小田周国平
张小田,周国平
1 南京医科大学附属逸夫医院儿科,南京211112;2 南京医科大学第一附属医院儿科
局灶节段性肾小球硬化(FSGS)是肾病综合征的常见病理类型,占儿童肾病综合征的20%,是最常见的导致终末期肾病的原发性肾小球疾病[1]。目前FSGS检出率迅速上升[2]。研究表明,FSGS是导致肾功能衰竭的主要原因[3],肾移植后的复发率高达40%。原发性FSGS的发病机制仍不明确,而且能够使严重肾病综合征和快速进展患者受益的治疗手段比较有限[4]。研究认为,除了遗传因素、病毒相关疾病和药物因素,多种足细胞骨架蛋白损伤也可能导致FSGS,如NPHS1、NPHS2、ACTN4、TRPC6及INF2等[5]。30% ~ 80%的原发性FSGS患者肾移植后疾病会复发[6],但基因治疗的FSGS患者复发率低,且遗传性FSGS患者基因治疗后可缩短免疫抑制疗程并减轻不良反应[7]。NPHS2位于染色体1q25.2,编码一种在调节肾小球通透性中发挥作用的蛋白质。该基因突变会导致类固醇耐受性肾病综合征。激活蛋白2(AP-2)转录因子于1987年首次从HeLa细胞中纯化出来,转录因子AP-2α(TFAP2A)是肾脏发育过程中肾单位分化的新型分子[8],TFAP2A表达抑制可促进细胞凋亡[9],抑制TFAP2A活性可调节肾单位节段发育[10],TFAP2A在远曲小管分化中也起关键作用[11],但目前TFAP2A调控足细胞相关基因的报道较少。2020年5月—2021年12月,本研究观察了TFAP2A对肾小球硬化相关基因NPHS2的转录调控作用,为基因治疗提供理论依据。
1 材料与方法
1.1 细胞与主要实验材料 人胚肾293T细胞(HEK-293T)、萤光素酶报告基因质粒pGL3-Basic、内参照报告基因质粒pRL-TK、TFAP2A过表达质粒、pENTER均为本实验室保存;载有NPHS2启动子-519 bp ~ +20 bp的pGL3-Basic购自上海捷瑞工程有限公司;感受态大肠杆菌DH5α购自北京天根生化科技有限公司。实时定量PCR试剂盒购自美国Bimake公司;LipofectamineTM3000转染试剂购自美国Invitrogen公司;DMEM培养基购自美国Thermo-Scientific公司;胎牛血清购自美国Gibco公司;青—链霉素双抗购自上海碧云天生物技术有限公司;双萤光素酶报告基因检测试剂盒购自美国Promega公司;总蛋白提取试剂盒购自南京凯基生物技术股份有限公司;GAPDH抗体购自美国Proteintech公司;Total RNA Kit Ⅰ购于ABI美国公司;RNA反转录试剂盒购于TaKaRa公司;TFAP2A抗体购自美国Abcam公司,NPHS2抗体购自Proteintech公司;辣根过氧化物酶标记山羊抗兔IgG购自上海碧云天生物技术有限公司。TFAP2A siRNA(上游序列5′-CCUGCUCACAUCACUAGUATT-3′,下游序列5′-UACUAGUGAUGUGAGCAGGTT-3′)、control siRNA(序列5′-UUCUCCGAACGUGUCACGU-3′)及空白对照(序列5′-ACGUGACACGUUCGGAGAATT-3′)由上海吉玛制药技术有限公司合成及纯化;基因引物由上海捷瑞生物工程有限公司合成。
1.2 肾脏疾病与正常肾组织中NPHS2、TFAP2A表达差异分析 基于GEO数据库及GEO Profiles数据集,分析肾透明细胞癌组织与正常肾组织中NPHS2、TFAP2A的表达差异。GEO Profiles数据集调取肾透明细胞癌组织NPHS2、TFAP2A的表达量,GraphPad prism6.0统计软件分析NPHS2、TFAP2A表达量改变。
1.3 含NPHS2基因5′侧翼区域重组报告质粒的构建 NCBI数据库寻找NPHS2基因启动子序列,扩增-519 bp ~ +20 bp区域片段,载体质粒与扩增片段重组纯化,切胶回收。重组质粒为经MluⅠ及XhoⅠ限制性内切酶双酶切消化的产物,在1%琼脂糖凝胶电泳时出现两条特异性条带,大小分别约4.8、500 bp。
1.4 TFAP2A结合位点预测 通过在线生物信息学软件NCBI数据库查找NPHS2基因启动子序列,转录起始位点定义为+1,寻找NPHS2转录起始点上游的启动子区,JASPAR软件预测NPHS2基因-519 bp ~ +20 bp启动子区的TFAP2A转录因子结合位点。
1.5 TFAP2A对NPHS2启动子水平的调控作用观察 将HEK-293T细胞接种于含10%胎牛血清的DMEM高糖培养基,置于37 ℃、5% CO2培养箱培养,2 ~ 3 d传代1次。取对数生长期细胞接种于96孔板,培养24 h,当细胞增长达70% ~ 80%融合度时进行转染。验证pGL3-519 bp ~ +20 bp启动子活性实验中,pGL3-519 bp/+20 bp及对照pGL3-Basic质粒转染HEK-293T细胞,培养24 h后测定萤光素酶的活性。干扰实验中,对照siRNA组细胞转染control siRNA,实验组细胞转染TFAP2A siRNA(浓度分别为5、10、15 pmol/μL)。过表达实验中,对照siRNA组细胞转染pENTER,实验组细胞转染TFAP2A过表达质粒(质量浓度分别为50、100、300 ng/mL)。按LipofectamineTM3000使用说明书操作。转染24 h后按照双萤光素酶报告基因检测试剂盒说明书进行萤光素酶活性分析。
1.6 TFAP2A对NPHS2 mRNA及蛋白的调控作用观察 将对数生长期的HEK-293T细胞接种于12孔板,培养24 h,待70% ~ 80%融合度时进行转染。将细胞分为对照组、干扰组及过表达组,分别转染control siRNA、TFAP2A siRNA及TFAP2A过表达质粒,按LipofectamineTM3000使用说明书操作。
1.6.1 TFAP2A、NPHS2 mRNA检测 培养24 h后提取细胞总RNA,放置冰上,测RNA浓度,-80 ℃保存。采用实时荧光定量PCR检测TFAP2A、NPHS2 mRNA。TFAP2A基因上游引物序列为5′-ATTGACCTACAGTGCCCAGC-3′,下游引物序列为5′-TCCATGAAAATGCTTTGGAA-3′;NPHS2基因上游引物序列为5′-ACCTTTTCATGAGGTTGCCTTGG-3′,下游引物序列为5′-TTCTGCAGCAATCATCCGCA-3′;内参GAPDH基因上游引物序列为5′-ATGACATCAAGAAGGTGGTG-3′,下游引物序列为5′-CATACCAGGAAATGAGCTTG-3′。反应条件为95 °C预变性10 min,95 °C 15 s,60 °C 30 min,72 ℃ 30 s,共40次循环;95 °C 15 s,60 °C 1 min,95 °C 15 s。以2-ΔΔCt表示目的基因相对表达量。实验重复3次,求均值。
1.6.2 NPHS2蛋白检测 采用Western blotting法。培养48 h抽提各组总蛋白,加入5×loading buffer,震荡离心,电泳分离,快速转膜。5%奶粉封闭2 h,取出膜,加入一抗,4 ℃摇床过夜。取出PVDF膜迅速置入TBST中,37 ℃摇床30 min,每10 min换TBST,共洗涤3次。加入适量辣根过氧化物酶标记山羊抗兔IgG后封膜,37 ℃摇床2 h。将PVDF膜取出迅速置入TBST中,37 ℃摇床30 min,每10 min换TBST,共洗涤3次。用滤纸吸干后置于塑料膜上,加入曝光液,曝光。Image Lab软件分析蛋白表达量数据,GraphPad prism6.0软件分析蛋白相对定量。
1.7 统计学方法 采用GraphPad prism6.0软件。计量资料以表示,两两比较采用t检验;多组间比较采用单因素方差分析,组间多重比较行LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 基因表达改变 聚类分析图中,红色代表高表达基因,绿色代表低表达基因;基因表达火山图红色表示表达量上升,蓝色表示表达量下降。肾透明细胞癌组织与正常组织相比NPHS29(分别为1 270 ± 530.9、5 650 ± 761.8)、TFAP2A(分别为6.93 ± 0.17、7.56 ± 0.11)相对转录水平降低。详见OSID码图1。
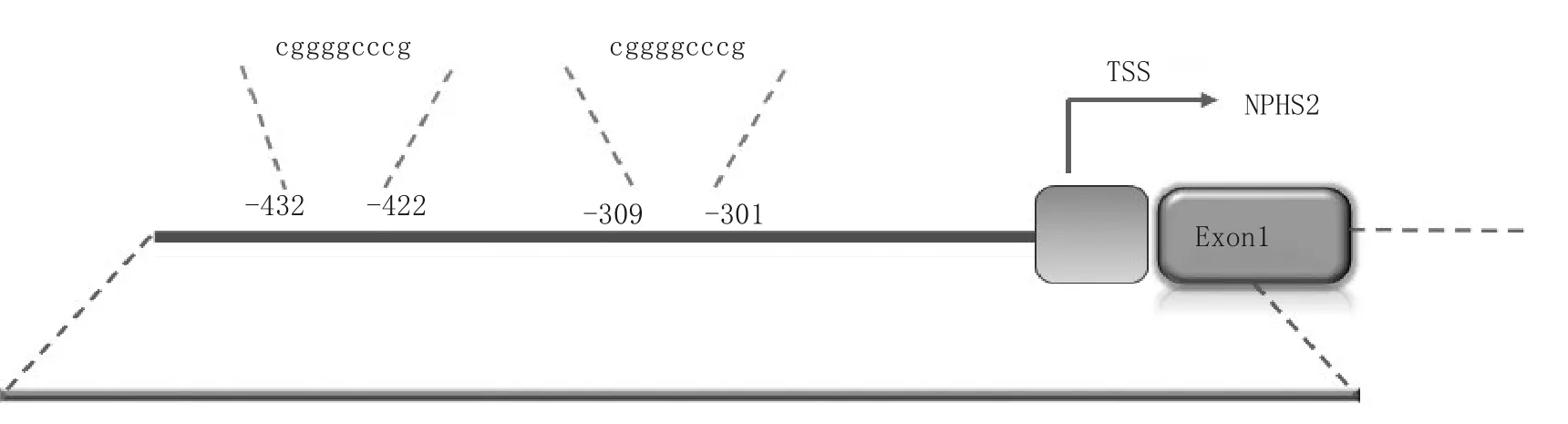
图1 TFAP2A转录因子在NPHS2基因转录起始位点上游-519 bp ~ +20 bp区域的结合位点
2.2 重组质粒构建及TFAP2A结合位点预测情况 重组质粒经MluI及XhoI限制性内切酶双酶切,在1%琼脂糖凝胶电泳时出现两条特异性条带,大小分别为4.8、500 bp,提示片段已成功插入载体,含NPHS2基因5′侧翼区域的重组报告质粒构建成功。NPHS2基因转录起始位点上游-519 bp ~ +20 bp区域包含两个了TFAP2A转录因子结合位点,第一个结合位点位于-301 bp ~ -309 bp,第二个结合位点位于-422 bp ~ -432 bp。见图1。
2.3 TFAP2A对NPHS2启动子水平的调控作用对照siRNA组及转染5、10、15 pmol/μL TFAP2A siRNA的实验组荧光素酶活性分别为1.00 ± 0.23、6.78 ± 0.83、7.55 ± 0.68、6.63 ± 1.29;对照siRNA组及转染50、100、300 ng/mL TFAP2A过表达质粒的实验组荧光素酶活性分别为1.00 ± 0.16、0.94 ±0.14、1.05 ± 0.12、0.53 ± 0.03。与对照siRNA组相比,转染5、10、15 pmol/μL TFAP2A siRNA的细胞NPHS2启动子荧光素酶活性均增强,转染300 ng/mL TFAP2A过表达质粒的细胞NPHS2启动子荧光素酶活性降低(P均<0.05)。
2.4 TFAP2A对NPHS2 mRNA及蛋白表达的调控作用 干扰组TFAP2A mRNA表达低于对照组,NPHS2 mRNA及蛋白表达高于对照组;过表达组TFAP2A mRNA表达高于对照组,NPHS2 mRNA及蛋白表达低于对照组(P均<0.05)。见表1 ~ 2。
表1 干扰组与对照组TFAP2A mRNA、NPHS2 mRNA、NPHS2蛋白表达比较()

表1 干扰组与对照组TFAP2A mRNA、NPHS2 mRNA、NPHS2蛋白表达比较()
注:与对照组相比,*P<0.05。
组别干扰组对照组NPHS2蛋白2.02 ± 0.20*1.00 ± 0.18 TFAP2A mRNA 0.52 ± 0.11*1.00 ± 0.06 NPHS2 mRNA 2.87 ± 0.43*1.01 ± 0.11
表2 过表达组与对照组TFAP2A mRNA、NPHS2 mRNA、NPHS2蛋白表达比较()

表2 过表达组与对照组TFAP2A mRNA、NPHS2 mRNA、NPHS2蛋白表达比较()
注:与对照组相比,*P<0.05。
组别过表达组对照组0.33 ± 0.08*1.00 ± 0.01 2.40 ± 0.24*1.00 ± 0.06 0.58 ± 0.04*1.01 ± 0.11 NPHS2蛋白TFAP2A mRNANPHS2 mRNA
3 讨论
引起FSGS的原因包括遗传因素、病毒相关性疾病和药物等,但关于原发性FSGS发病机制充分有力的研究仍然很少,基因编辑及转录调控机制研究甚少,有待进一步研究。TFAP2A是AP-2转录因子家族成员之一。AP-2蛋白可以正向或负向调节参与生理病理过程的许多关键基因的启动子活性,在肾脏发育生物学功能方面起重要作用。AP-2转录因子目前正在肾脏发育中得到广泛研究,并且它们可能对某些肾脏疾病具有诊断价值,还可能与病因有关,因此有可能作为肾脏疾病治疗的新靶点。
启动子是转录起始位点附近的DNA区域,其中整合了转录调控信号以触发大分子组装体的形成并确定转录起始。在启动子周围,DNA序列、染色质重构、启动前复合物、介质复合物、组蛋白变体、核小体占据和翻译后组蛋白修饰是已知独立和协同运作的调节元件。DNA结合蛋白(如转录因子)在维持增强子—启动子接触方面具有重要作用[12]。复杂生物体的发育很大程度上取决于基因组DNA包含的遗传信息[10]。受调控的基因表达对于所有真核细胞和生物体的完整性至关重要,在细胞分化和代谢中的核心作用被破坏会导致多种疾病的发生。在真核生物中,染色质的可及性、基因定位和mRNA转录物生成是由复杂的分子机制控制的。控制转录的调节信号可以在基因(编码)、启动子(接近/邻近编码)和增强子(远端)区域内单独或组合出现[13]。增强子、启动子和CCCTC结合因子位点之间存在高度点状接触,转录因子在维持增强子和启动子之间的接触方面发挥了重要作用[14]。
本研究通过生物信息学预测发现,TFAP2A、NPHS2在肾透明细胞癌组织中表达量有改变,且两者之间存在相关性,为进一步研究两者的调控关系提供了理论依据。本研究构建了NPHS2启动子荧光素酶基因报告重组质粒,通过瞬时转染、荧光素酶活性检测,证实pGL3-519 bp ~ +20 bp具有启动子活性。通过JASPAR软件预测NPHS2启动子区含有2个TFAP2A转录因子结合位点,第一个结合位点位于-301 bp ~ -309 bp,第二个结合位点位于-422 bp~ -432 bp。本研究观察了TFAP2A对NPHS2在启动子和基因蛋白表达水平的调控作用,结果显示,与对照siRNA组相比,转染5、10、15 pmol/μL TFAP2A siRNA的细胞NPHS2启动子荧光素酶活性均增强,转染300 ng/mL TFAP2A过表达质粒的细胞NPHS2启动子荧光素酶活性降低,表明在TFAP2A对NPHS2基因启动子水平具有调控作用;干扰组TFAP2A mRNA表达低于对照组,NPHS2 mRNA及蛋白表达高于对照组;过表达组TFAP2A mRNA表达高于对照组,NPHS2 mRNA及蛋白表达低于对照组,提示TFAP2A可下调NPHS2 mRNA及NPHS2蛋白的表达,与相关研究结果一致[15-16]。
本研究证明转录因子TFAP2A可以调控足细胞相关基因NPHS2表达,增加了调控足细胞重要基因的转录因子成员。也有文献报道其他转录因子也可以调控足细胞相关基因,如FOXO3a积累和激活可加速氧化应激诱导的足细胞损伤。NPHS2启动子区的确定有利于有关疾病的基因治疗。大部分基因突变或变异位点位于非编码区,全基因组测序发现的突变可能在致病基因的非编码调控区,包括启动子区的转录因子结合位点处,也可能在另一条染色体上看似无关的另一基因区域。已有文献报道,局部注射单导核糖核酸指引的CRISPR相关蛋白9融合腺嘌呤剪辑编辑器CjABE的腺病毒相关病毒,可抑制TRET启动子突变的神经胶质瘤的生长[17]。还有研究表明,CRISPR介导的启动子或增强子激活可治疗由单倍体不足引起的肥胖[18]。
综上所述,NPHS2启动子-519 bp ~ +20 bp区域存在潜在的TFAP2A转录因子结合位点,TFAP2A可下调NPHS2的启动子活性、mRNA及蛋白表达。本实验为揭示NPHS2基因转录调控的分子机制奠定了基础,同时也为FSGS治疗相关研究提供了新的思路。
