不同载体粒径的催化剂对甲烷氧化还原NOx特性及机理
2023-11-25安东海宋佳霖程星星
陈 晨,安东海,宋佳霖,程星星
(1.山东大学 能源与动力工程学院,山东 济南 250061;2.昌吉学院,新疆维吾尔自治区 昌吉 831100)
0 引 言
氮氧化物对人体有较大危害,吸入氮氧化物气体会刺激人体肺部,使人难以抵抗感冒等呼吸类疾病[1-2]。氮氧化物还会与空气中的碳氢化合物在太阳紫外线照射下生成有毒的光化学烟雾。这些光化学烟雾会导致眼睛红肿酸痛、胸痛等,严重时甚至会危及生命[3-5]。氮氧化物会与大气中的臭氧分子发生反应,打破臭氧平衡,破坏地球的臭氧层,造成臭氧空洞,导致温室效应[6-8]。目前NH3-SCR在运输应用过程中存在氨逃逸、泄漏等一系列问题[9-12],而甲烷相比于NH3更清洁,并且在自然界中分布广、储量丰富、价格便宜、易获得,使甲烷成为氮氧化物治理领域的研究热点。
甲烷催化还原氮氧化物催化剂主要包括贵金属和非贵金属两类[13-14]。贵金属中,铂催化剂因其活性较高得到广泛关注,但在高温下,铂催化剂的活性位点会大幅减少、活性降低[15]。因此研究者们将载体氧化锆和氧化铝引入催化剂中,使催化剂在高温下仍具备较高的活性[16-17]。
除载体外,催化剂的制备方式及制备条件也是影响催化剂催化效果的因素之一[18]。研究显示,催化剂的负载量和负载金属的性质都会影响催化剂的活性。银是常见的贵金属催化剂,其掺杂量会直接影响催化剂活性,因此需要通过试验确定最佳掺杂比例。由此可知,贵金属催化剂(Pt、Pd等)因其高活性而得到关注,但其温度区间窄、失活后难以再生,价格高昂,会大幅增加投资和运行的成本[19]。相比之下,非贵金属催化剂的价格更加便宜,于是对其展开研究。
过渡金属铁、钴、镍、铝和铜是常用的非贵金属活性成分,因价格便宜,是非贵金属催化剂研究的热点。其中,具有高比表面积的铜基催化剂体系中,铜物种以块状CuO晶体的形式存在,降低了NO解吸峰的温度。钴基和镍基催化剂对N2O的分解具有很高的催化能力[20]。Co3O4可以有效提高催化剂的抗水性、抗硫性和抗氧化性,提高催化剂和CH4的吸附效果。超微孔纳米Cu/Al2O3催化剂具有窄的孔径分布、高的热稳定性、大的比表面积和良好的活性铜分散性,活性明显高于常规Cu/Al2O3催化剂。
Cu/Al2O3催化剂成本低廉但是其催化效率有待进一步提升,同时可以发现对于载体粒径、活性组分协同以及纳米级活性组分等研究较少。故笔者以载体为研究对象,制备Cu/Al2O3催化剂并采用表征手段对其反应机理进行研究,以期进一步提升Cu/Al2O3催化剂的催化效率。
1 试验材料和方法
1.1 材料制备方法
将相应计算量的Cu(NO3)2放入烧杯,向烧杯中加入适量去离子水,搅拌30 min使Cu(NO3)2完全溶解;向溶液分别加入不同粒径的Al2O3(0.1~1.0 μm、10 nm、20 nm、30 nm)粉末,磁力搅拌24 h;之后在80 ℃真空干燥箱中干燥处理30 h;样品研磨筛选为380~250 μm(40~60目)的颗粒;将筛选好的样品放置到马弗炉中在N2氛围中500 ℃煅烧4 h;将煅烧后的样品进行压片并筛选出粒径在380~250 μm(40~60目)的颗粒样品,在固定床反应器中进行性能测试。根据氧化铝载体粒径,将样品分别命名为Cu/Al2O3、Cu/SMA(10)、Cu/SMA(20)和Cu/SMA(30)。
1.2 催化剂活性测试方法
催化剂的甲烷催化氧化及催化还原NO反应活性测试在固定床反应器中进行,装置如图1所示,包含气体控制系统、反应系统以及气体分析测试系统。将筛选出的380~250 μm(40~60目)催化剂置于管式反应器中,每个温度点状态下停留30 min确保工况稳定后开始测试读数,反应器一端设置气体旁路,测试记录初始工况。
反应过程中的NOx和CH4转化率以及N2选择性nsele计算方式如下:
η(NO)=(C(NO)in-C(NO)out)/C(NO)in×100%,
(1)
η(CH4)=(C(CH4)in-C(CH4)out)/C(CH4)in×100%,
(2)

(3)
式中,C(NO)in为流入管式反应器的NO浓度;C(NO)out为反应稳定后流出管式反应器的NOx浓度;C(CH4)in为流入管式反应器的甲烷浓度C(CH4)out为反应稳定后流出管式反应器的甲烷浓度;C(NOx)out为反应稳定后流出管式反应器的NOx浓度;C(NO2)out为反应稳定后流出管式反应器的NO2浓度;C(N2O)out为反应稳定后流出管式反应器的N2O浓度。
1.3 分析测试仪器
通过扫描电镜(SEM:DESK V)对样品的表面形貌进行了表征,样品用PerkinElmer FTIR 2000进行官能团的分析。用VG Multilab 2000 X-射线光电子谱仪分析样品X-射线光电子能谱(XPS),试验数据采用Casa XPS软件中的Gaussian-Lorentzian函数进行拟合。BET测定吸附剂的比表面积,并通过Barrettg-Jioner-Halenda(BJH)法计算孔隙体积和孔径。使用NH3程序升温脱附(NH3-TPD)测试催化剂样品的酸性,用H2程序升温还原(H2-TPR)测试催化剂样品的氧化还原能力。
NH3-TPD测试是先用He气在573 K下吹扫50 min,然后在303 K温度条件下通NH3吸附1 h,之后通He气吹扫1 h,再以10 K/min速率升温至1 073 K,通过质谱仪记录分析升温过程中的NH3脱附情况。
H2-TPR测试是用He气在573 K温度条件下吹扫50 min 以去除样品表面可能吸附的杂质,待反应器冷却后,通入5% H2/He并以10 K/min升温速率升温至1 073 K,通过TCD检测器记录升温过程中的H2消耗量。
2 试验结果与讨论
2.1 载体粒径对催化剂效率的影响
甲烷催化还原NO试验是通入1 000×10-6NO、1% CH4和5% O2,并用N2作为平衡气;甲烷催化氧化试验是通入1% CH4和5% O2,N2为平衡气。在固定床反应器中,将制备好的催化剂在不同温度氛围下进行了催化剂活性测试。
测试结果如图2(a)所示,使用纳米级氧化铝作为载体的Cu/SMA(a)(a=10,20,30)催化剂催化效果均优于使用普通氧化铝作为载体的Cu/Al2O3催化剂。几种催化剂在350 ℃时均表现出较低的催化活性,当温度升至400 ℃时,效率最高的为Cu/SMA(20)催化剂,Cu/SMA(20)、Cu/SMA(10)、Cu/SMA(30)和Cu/Al2O3催化剂的NO脱除效率分别为32.5%、28.7%、27.2%和23.5%。随温度升高,几种催化剂效率随之提升。Cu/Al2O3催化剂在450、500和550 ℃时的效率分别为40.5%、71.7%和90.2%。Cu/SMA(10)催化剂在450、500和550 ℃的效率分别为63.1%、85.0%和97.0%。Cu/SMA(20)与Cu/SMA(30)催化剂在450 ℃时的效率分别为70.2%及57.3%,在550 ℃时效率达100%。综合分析催化剂的甲烷催化还原NO效率从高到低为Cu/SMA(20)>Cu/SMA(10)>Cu/SMA(30)>Cu/Al2O3。催化剂的氮气选择性曲线如图2(c)所示,4种催化剂的氮气选择性皆在97%以上,可见其N2转化率都较高。
催化剂的甲烷转化效率如图2(b)所示。4种催化剂在450 ℃时效率均在40%以下。500 ℃时在Cu/SMA(20)、Cu/SMA(10)、Cu/SMA(30)催化剂的作用下,其甲烷转化率依次为71.7%、65.8%以及57.2%,550 ℃时则达到了90.1%、81.9%和72.7%。对比发现随着氧化铝载体颗粒度减小,其催化效率先升高后降低。小颗粒氧化铝作为载体的Cu/SMA催化剂效率优于传统氧化铝载体的Cu/Al2O3催化剂,这是由于Cu/SMA催化剂具有更大的比表面积,可为甲烷脱硝反应提供更多的酸性位点及氧空位活性位点,而随着催化剂颗粒度变小,催化剂效率降低的原因可能是孔道过小,在活性组分负载的过程中孔道口发生了一定程度的堵塞,使暴露位点变少。
2.2 催化剂的结构分析
图3为吸附脱附等温线,可知催化剂及其载体的曲线走向相似,根据IUPAC分类可知,所选催化剂及载体的N2吸附脱附等温线均属于IV型等温曲线。催化剂及其载体均出现了H3型回滞环结构,这表明多孔样品发生了毛细凝聚现象[19]。相关文献研究表明,IV型等温曲线的回滞环大小与其孔结构相关[20],其回滞环由大到小为Cu/SMA(20)>Cu/SMA(10)>Cu/SMA(30)>Cu/Al2O3,这表明Cu/SMA(a)(a=10、20、30)催化剂相对Cu/Al2O3催化剂拥有更多的孔结构,其中Cu/SMA(20)催化剂拥有最多的孔结构,这为甲烷在催化剂作用下发生的氧化还原反应提供了更多的接触位点,增强了催化剂脱硝效率。
不同催化剂的孔隙结构参数见表1,以普通氧化铝作为载体的Cu/Al2O3催化剂比表面积最小,仅73.30 m2/g。使用更小颗粒度(10、20、30 nm)氧化铝作为载体的Cu/SMA(a)(a=10、20、30)催化剂比表面积均大于Cu/Al2O3催化剂,分别为170.8、183.6以及153.7 m2/g,大的比表面积可为催化反应提供较多的活性反应位点,并且有效分散了催化剂表面的活性组分,增强了催化剂的催化效率。随着氧化铝载体颗粒度变小,催化剂的比表面积先增大后减小。在不负载活性组分时,SMA(10)、SMA(20)、SMA(30)氧化铝载体的比表面积分别为245.2、227.6及190.4 m2/g。对比负载活性组分前后的比表面积,发现Cu/SMA(10)催化剂负载活性组分后比表面积降低幅度更大,结合图3(b)几种催化剂的孔径分布分析,这可能是10 nm的氧化铝载体颗粒度过小,虽然提供了更大的比表面积,但是由于其载体孔径过小,在负载活性组分后发生了一定程度的堵塞,导致Cu/SMA(10)催化剂比表面积降低,是造成其催化效率降低的原因之一。

表1 不同催化剂的孔隙结构参数Table 1 Structure parameters of catalysts
2.3 催化剂表面形貌分析
对Cu/Al2O3催化剂以及催化效果最好的Cu/SMA(20)催化剂进行了TEM电镜及EDS面扫测试,得到其表面形貌及元素分布情况如图4所示。由图4(a)和4(f)可知,普通氧化铝载体铜基催化剂发生了较明显的团聚现象,并且间杂出现部分较大颗粒的团聚,Cu/SMA(20)催化剂则表现出了较好的分散性,这对催化剂载体上的活性组分分布有重要影响,直接影响催化剂的催化活性。由图4(b)~4(g)的元素分布情况可知,Cu/SMA(20)催化剂上元素分布更加均匀分散,由图4(d)和4(i)铝元素分布情况可知Cu/SMA(20)催化剂上作为载体的氧化铝分布更分散,进而诱导作为活性组分的铜元素更加分散,这有利于增强催化剂的催化活性。由图4(c)和4(h)可知,在初始混合物中添加的铜物种最终被更多引入到制备反应的最终产物中,使作为活性组分的铜物种与作为载体的铝物种在原子水平上分布更加均匀,这也进一步提升了催化剂的甲烷催化还原NO及催化氧化效率。
2.4 催化剂表面原子价态分析
不同粒径氧化铝载体铜基催化剂的Cu 2p轨道的双峰拟合XPS图谱如图5所示,Cu 2p峰具有比较明显的Cu 2p1/2光谱和Cu 2p3/2光谱的自旋轨道分裂峰,Cu/Al2O3催化剂中结合能为933.1与952.61 eV 处的峰代表催化剂中的Cu+物种,结合能为934.56与953.51 eV处的峰代表Cu2+物种。Cu/SMA(10)催化剂中结合能为933.01与952.79 eV处的峰代表催化剂中的Cu+物种,结合能为934.57与953.89 eV处的峰代表Cu2+物种。Cu/SMA(20)催化剂中的Cu+物种以及Cu2+物种的结合能峰分别位于932.99、952.39 eV以及934.69、954.13 eV。而Cu/SMA(30)催化剂中的Cu+物种以及Cu2+物种的结合能峰则分别位于932.87、952.41 eV以及934.51、953.77 eV。

图5 催化剂的Cu 2p XPS图谱Fig.5 XPS spectra of catalysis
结合图5图谱中的相对峰强度及峰面积可知,4种催化剂中的Cu物种包含Cu+和Cu2+,其中Cu2+物种含量较多;对比几种催化剂可知,以小颗粒纳米级氧化铝作为载体的Cu/SMA(a)(a=10、20、30)催化剂相比较普通氧化铝载体的Cu/Al2O3催化剂具有更多的还原态Cu+,这对甲烷催化还原NO反应起到了一定协同作用,增强了催化剂的脱硝效率。结合能向高场区域发生偏移表示反应物原子周围的电子云密度降低,反应物失电子使其得电子能力得到增强,这种电子的偏移现象可以给出原子之间电子相互作用的关系[21]。对比几种催化剂的Cu 2p的XPS图谱可知,Cu/SMA(a)(a=10、20、30)催化剂相比Cu/Al2O3催化剂中的Cu2+均发生了一定程度的高场偏移,增强了其得电子能力。且Cu/SMA(a)(a=10、20、30)催化剂的Cu+和Cu2+处的结合能之差均高于Cu/Al2O3催化剂,这有助于促进Cu2+和Cu+之间的转换,对甲烷的氧化还原反应起到了协同作用,一定程度上提高了催化剂的催化效率[20]。同时由图5可知Cu/SMA(20)催化剂相比较Cu/SMA(10)催化剂的Cu2+发生了更大的高场偏移且其结合能之差高于Cu/SMA(10)催化剂,这也是导致Cu/SMA(20)催化剂效率高于Cu/SMA(10)催化剂的原因之一。
图6为不同粒径氧化铝铜基催化剂的O 1s轨道的XPS图谱,XPS图谱中的O 1s分为3个峰[22],分别对应催化剂中由金属阳离子结合而形成的晶格氧Oα,由晶格氧获得能量后发生活化形成的空位氧Oβ以及催化剂表面吸附的氧气、含氧酸根、甲酸根等构成的吸附氧Oγ。空位氧是在催化反应发生过程中丢失氧原子形成的重要反应位点,这些活性位点是催化反应发生的重要场所。

图6 催化剂的O 1s XPS图谱Fig.6 XPS spectra of O 1s of catalysis

2.5 催化剂酸性测试
由甲烷脱硝反应机理可知,催化剂上的酸性位点是NO吸附及其与O2反应生成NO2的重要场所,同时酸性位点的存在是催化剂保持其上阳离子高度分散的一个重要支撑,对于催化反应的加速起重要作用[23]。由图7中NH3-TPD曲线可知,Cu/SMA(a)(a=10、20、30)催化剂的解析峰面积大于Cu/Al2O3催化剂,这表明Cu/SMA(a)(a=10、20、30)催化剂比Cu/Al2O3催化剂有更多的酸性位点,可为甲烷催化反应提供更多的反应场所,加速了NO向NO2的转化过程,这也是Cu/SMA(a)(a=10、20、30)具有更强催化活性的原因之一。
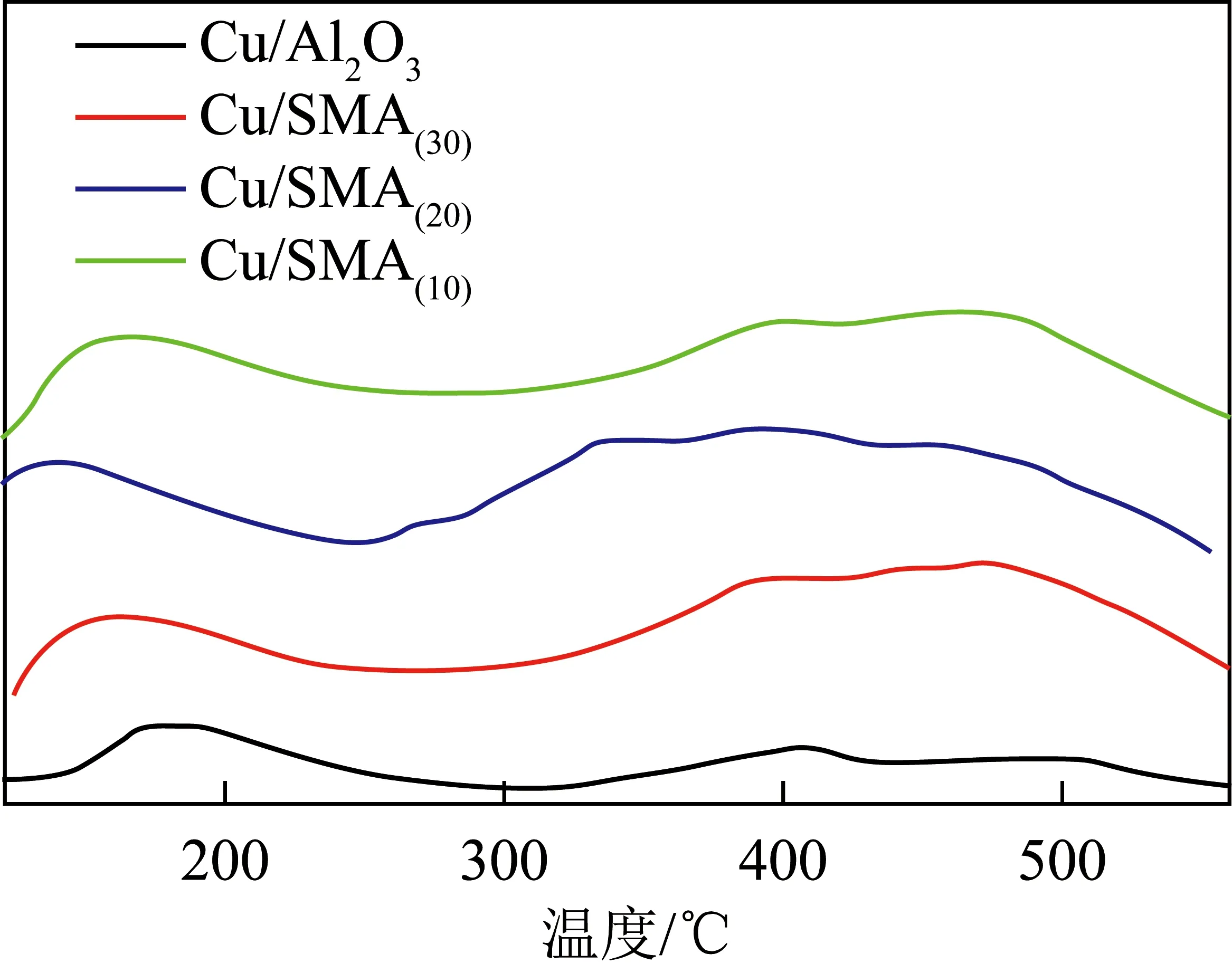
图7 催化剂的NH3-TPD图谱Fig.7 NH3-TPD spectra catalysis
2.6 催化剂还原性测试
催化剂的氧化还原性与其催化活性相关联[24],影响着甲烷与氮氧化物的氧化还原反应。图8分别为Cu/Al2O3、Cu/SMA(10)、Cu/SMA(20)以及Cu/SMA(30)催化剂的H2-TPR图谱,可知催化剂均存在2个还原峰,Cu/Al2O3催化剂的2个还原峰分别出现在318.7与363.2 ℃附近,Cu/SMA(10)、Cu/SMA(20)、Cu/SMA(30)催化剂的低温还原峰分别出现在293.1、295.7以及302.7 ℃附近,高温还原峰则分别位于342.5、339.2及338.7 ℃附近。随着氧化铝载体粒径变小,其低温还原峰温度呈下降趋势,而其高温还原峰温度线先升高后降低。
分析几种催化剂样品的H2-TPR特征曲线,发现Cu/SMA(a)(a=10、20、30)催化剂的2个还原峰的出现温度低于Cu/Al2O3催化剂,在反应过程中,Cu/SMA(a)(a=10、20、30)催化剂中的Cu2+物种更容易被还原性气体还原为Cu+物种,进而在接下来的脱硝催化反应中表现出更强的还原性,进而协同将氮氧化物还原为N2,在这一过程中,Cu+物种又被氮氧化物氧化为Cu2+物种[25],实现反应的循环进行,对甲烷催化还原NO反应起促进作用。
2.7 Cu/Al2O3及Cu/SMA(20)催化剂表面官能团变化


2.8 Cu/Al2O3催化剂的甲烷催化还原NO反应机理
铜基氧化铝催化剂在甲烷条件下的脱硝反应机理如图11所示,与其他SCR及SNCR反应不同,甲烷不能直接与NO反应。在甲烷还原NO反应中,NO会先与氧气反应生成NO2吸附在催化剂表面,这一过程会在催化剂表面的酸性位点上得到加速;催化剂表面吸附的NO2会在甲烷作用下生成硝酸盐;催化剂表面的晶格氧在获得能量后会转化为空位氧。并在催化反应中丢失氧原子形成氧空位,催化剂表面吸附的NO2与甲烷在氧空位位置上反应加速,并进一步反应生成重要反应中间体甲酸盐;甲酸盐在硝酸盐、甲烷、氧气的共同作用下生成含氮中间体NCO,并进一步反应为最终产物氮气、二氧化碳、水等。

图11 Cu/Al2O3催化剂表面CH4脱硝机理Fig.11 Mechanism of CH4 denitration on Cu/Al2O3 catalyst
3 结 论
1)催化剂的甲烷催化还原NO及甲烷催化氧化效率为Cu/SMA(20)>Cu/SMA(10)>Cu/SMA(30)>Cu/Al2O3催化剂。
2)BET结果表明Cu/SMA(a)(a=10、20、30)催化剂的比表面积大于Cu/Al2O3催化剂,这是其催化效率更高的原因之一,虽然10 nm氧化铝载体拥有更大的比表面积,但由于其孔径过小,负载活性组分氧化铜后,孔道口易堵塞,使其效率降低。
3)TEM电镜测试结果显示小颗粒纳米级氧化铝作为催化剂载体可以更好地分散作为活性组分的氧化铜。
4)XPS及NH3-TPD测试表明Cu/SMA(a)(a=10、20、30)催化剂相比于Cu/Al2O3催化剂拥有更多氧空位及酸性位点。
5)H2-TPR结果显示催化剂中的Cu2+物种在反应中更易被还原为Cu+物种,Cu+在脱硝反应中起协同作用而对甲烷催化还原NO起促进作用。原位漫反射傅里叶变换红外光谱测试说明NO先与O2发生反应生成了中间态物质,接着与CH4发生氧化还原反应生成N2,这与之前试验结果相印证。
