红心曲来源Thermoascus aurantiacus QH-1 的生长代谢特征
2023-11-20唐艺婧来欢欢崔美林张秀红
唐艺婧,来欢欢,赵 微,崔美林,张秀红,
(1.山西师范大学生命科学学院,山西太原 030000;2.山西师范大学食品科学学院,山西太原 030000)
嗜热子囊菌(Thermoascus)属于真菌门,子囊菌亚门,散囊菌目,耐热囊菌科(Thermoascaceae),是一类嗜热真菌,即最低生长温度为20 或20 ℃以上,最高生长温度为50 ℃或50 ℃以上的特殊真菌类群[1]。嗜热子囊菌属具有橙黄或红棕的闭囊壳,含有6~8个子囊孢子,不同菌种的无性时代区较大,可以没有,也可以是拟青霉状或者多拟青霉状[2]。自1907 年首次被分离出来,目前的菌种并不多,只有六个种(T.aegyptiacus,T.aurantiacus,T.crustaceus,T.isatschenkoi,T.taitungiacus和T.thermophilus)和两个变种(T.crustaceusvar.verrucosus和T.aurantiacusvar.levisporus)[3]。嗜热真菌多存在于堆肥、草堆、植物种子堆、沙漠、温泉等温度较高的自然环境中,能产生多种耐热的生物大分子水解酶类,尤其是纤维素酶、半纤维素酶和木质素酶等。如广西土壤分离的黄嗜热子囊菌T.aurantiacusQS7-2-4 木聚糖酶最佳的合成温度是50 ℃,木聚糖酶的最适温度高达70~80 ℃[4];T.crustaceusJCM12803 的双功能木聚糖/纤维素酶对榉木木聚糖、小麦阿拉伯木聚糖、羧甲基纤维素钠和地衣多糖均有降解活性,最适pH 和最适温度分别为5.0 和65~70 ℃[5];黄嗜热子囊菌几丁质酶的最适反应温度为60 ℃,最适反应pH 值为8.0,70 ℃处理30 min 仍有45%的相对酶活,具有较好的热稳定性及工业应用价值[6]。
近年来,在中国白酒酿造的大曲和酒醅中也发现大量嗜热子囊菌,如在浓香型中温大曲制曲过程中发现,嗜热子囊菌属为优势菌,在第10 d 时比例高达77.1%,之后一直保持在40%以上[7];在生产酱香白酒的高温大曲真菌群落结构中,红曲和白曲中嗜热子囊菌属竟占到真菌的84%和65%,黑曲和黄曲中略少,分别为18%和13%[8];河北酱酒大曲制曲过程中,发酵10 d 时嗜热子囊菌属也占到真菌的64.4%[9];湖北襄阳高温大曲中,嗜热子囊菌属在白曲、黑曲和黄曲都是绝对优势真菌,比例高达34.76%[10];同时,在其他的大曲中也发现大量嗜热子囊菌存在[11-15]。不仅在大曲中,在浓香白酒酒醅中也发现大量嗜热子囊菌。Zhang 等[16]将四川绵竹浓香白酒厂的酒醅置于玻璃瓶中30 ℃发酵70 d,嗜热子囊菌属和曲霉属在整个发酵期平均丰度大于10%而成为核心真菌。郭敏等[17]对酱香型白酒微生态多样性的研究中发现,嗜热子囊菌是酱香型白酒发酵过程真菌微生物中的绝对优势菌,它可以产生多种具有高活力及热稳定性的水解酶,有利于酿酒原料被其他微生物利用,起到促进微生物繁殖生长以及产酒生香的作用;黄嗜热子囊菌能产生α-淀粉酶,与玉米、玉米芯、稻草和大豆相比,在麸皮培养基上α-淀粉酶活性最高,而且其α-淀粉酶在10%的酒精浓度下酶活性还能保留90%以上[18]。嗜热子囊菌有可能是中国白酒酿造的功能菌,但对于纯菌株的生长特性尚不清楚。本课题组发现嗜热子囊菌属是清香大曲红心曲红心部分的关键微生物,并且从清香大曲中的红心曲中分离到的一株可以产红色色素的黄嗜热子囊菌(Thermoascus aurantiacusQH-1),所以本文从培养基、起始pH、装液量、接种量、制曲原料、乙醇含量及致死温度等方面探讨其生物学特性,并将其进行固态发酵,测量其理化指标,为该菌株后续开发利用提供理论依据。
1 材料与方法
1.1 材料与仪器
黄嗜热子囊菌(Thermoascus aurantiacusQH-1)分离自红心曲,保藏于本实验室;小麦、豌豆 山东菏泽;大麦 河南信阳;高粱米 四川成都;蛋白胨 北京奥博星生物技术有限责任公司;发酵专用麦芽浸粉、琼脂粉 北京索莱宝科技有限公司;蔗糖、KH2PO4、CuSO4·5H2O 分析纯,天津市光复科技发展有限公司;葡萄糖 分析纯,天津市北辰方正试剂厂;KCl 分析纯,天津市风船化学试剂科技有限公司;NaNO3、FeSO4·7H2O、MgSO4分析纯,天津市科密欧化学试剂开发中心;ZnSO4·7H2O、三氯乙酸 分析纯,天津市大茂化学试剂厂;Yeast Extract Powder 酵母粉 优级纯,赛默飞世尔科技公司;VB1生物试剂,广州硕谱生物科技有限公司;NaOH分析纯,洛阳市化学试剂厂;马铃薯葡萄糖水、PDA 培养基 青岛高科技工业园海博生物技术有限公司;无水乙醇 分析纯,天津市北辰方正试剂厂;甘油 分析纯,天津市凯通化学试剂有限公司;MEA培养基 北京酷来搏科技有限公司。
GI80DS 立式压力蒸汽灭菌锅 致微(厦门)仪器有限公司;PHS-3C 型pH 计 上海雷磁仪器厂;ZHJH-C1112B 智城超净工作台、ZXMP-R1230 恒温恒湿培养箱 上海智城分析仪器制造有限公司;D-37520 低速冷冻离心机 赛默飞世尔科技(中国)有限公司;BSA124S 分析天平(感量0.0001 g)瑞士METTLER TOLEDO 公司;电热鼓风干燥箱 上海一恒科学仪器有限公司;V-1800PC 型可见分光光度计 上海美谱达仪器有限公司。
1.2 实验方法
1.2.1 培养基的配制 SDA 培养基;察氏培养基;25%甘油硝酸盐琼脂培养基(G25N);种子培养基:在马铃薯葡萄糖培养基中,加入的蛋白胨18 g/L,KH2PO43 g/L,MgSO41.5 g/L,VB10.05 g/L;发酵培养基:麦芽浸出粉2 g/L,酵母浸出粉18 g/L,KH2PO43 g/L,MgSO41.5 g/L,VB10.05 g/L;小麦浸出液:200 g 小麦,加入800 mL 水,蒸煮30 min,3 层纱布过滤;小麦、大麦浸出液:小麦与大麦共称取200 g,其配比为85:15,加入800 mL 水,蒸煮30 min,3 层纱布过滤;大麦、豌豆浸出液:大麦与豌豆共称取200 g,其配比为65:35,加入800 mL 水,蒸煮30 min,3 层纱布过滤;高粱米浸出液:200 g 高粱米,加入800 mL 水,蒸煮30 min,3 层纱布过滤[19-20]。大麦豌豆培养基:大麦与豌豆粉碎过筛按照65:35 的比例混匀,粗粉与细粉的比例为6:4(粗粉为过60 目筛,细粉为过30 目筛),加水量为原料的38%,随后用玻璃棒搅拌均匀[21]。
1.2.2 黄嗜热子囊菌的培养 将黄嗜热子囊菌接种在PDA 培养基上活化5~7 d,铲出1 cm×1 cm 的菌饼,采用“三点”接种法,分别将菌饼接种于在PDA、MEA、SDA、察氏培养基和G25N 培养基中,各菌饼相隔约40 mm,每种培养基设置3 个重复,于45 ℃的培养箱中培养5 d,每天观察黄嗜热子囊菌菌株在不同培养基上的菌丝长势、菌落形态、菌丝和菌落颜色变化[22]。
1.2.3 种子液的制备 将储存于斜面的黄嗜热子囊菌接种在PDA 培养基上活化5~7 d,使用接种铲取出1 cm×1 cm 的菌饼7~8 块,放置于种子培养基中,在温度为45 ℃,转速为180 r/min 的摇床中培养3 d,将一代种子液按10%的接种量转接于种子培养基中,在相同培养条件下培养1 d,即得种子液[23-24]。
1.2.4 培养条件对黄嗜热子囊菌生长的影响
1.2.4.1 温度“三基点”的确定 将直径为1 cm 的菌饼置于PDA 培养基中,分别培养在温度为30、35、45、55、60 ℃的培养箱中,培养5 d,观察菌丝生长,确定最低生长温度及致死温度的范围,再按1 ℃温度梯度进行上述处理确定最终的菌株最低生长温度及致死温度[25]。
1.2.4.2 pH 对黄嗜热子囊菌生长的影响 参照郭淑清[26]的方法,使用0.1 mol/L HCl 和0.1 mol/L NaOH将发酵培养基的pH 调成 3、4、5、6、7。按照5%的接种量将种子液接种于发酵培养基中。培养一定时间后,把发酵液取出,按照菌丝干重的测定方法,对生长在不同pH 发酵培养基中的菌丝干重进行测定。
1.2.4.3 接种量对黄嗜热子囊菌生长的影响 分别按照3%、5%、7%、9%、11%的接种量将种子液接种于发酵培养基中。培养一定时间后,把发酵液取出,按照菌丝干重的测定方法,对菌丝干重进行测定。
1.2.4.4 装液量对黄嗜热子囊菌生长的影响 将发酵培养基按照80、100、120、140、160、180 mL 装入250 mL 的锥形瓶中。以接种量为5%的种子液接入发酵培养基中。培养一定时间后,把发酵液取出,按照菌丝干重的测定方法,对生长在不同装液量发酵培养基中的菌丝干重进行测定。
1.2.4.5 制曲酿酒原料对黄嗜热子囊菌生长的影响把种子液按5%的量接种于小麦、小麦和大麦、大麦和豌豆、高粱米浸出液培养基。培养一定时间后,把发酵液取出,按照菌丝干重的测定方法,对菌丝干重进行测定。
1.2.4.6 黄嗜热子囊菌乙醇耐受性分析 将种子液按5%的接种量接种于含有0、3%、6%、9%、12%、15%乙醇的发酵培养基中,培养一定时间后,把发酵液取出,按照菌丝干重的测定方法,对菌丝干重进行测定。
1.2.4.7 黄嗜热子囊菌的生长曲线及代谢分析 把种子液按5%的量接种于大麦和豌豆固体培养基中(培养温度45 ℃),于培养天数为2、4、6、8、10 d 时取出固态培养物,对固态培养物的生物量、pH、酸度、糖化力及液化力进行测定。pH、酸度、糖化力及液化力的测定方法参考QB/T 4257-2011。黄嗜热子囊菌固态培养物生物量的测定:称取0.05、0.1、0.15、0.2、0.25 g 的液体培养所得纯菌体,分别加入25 mL 5%的三氯乙酸溶液,80 ℃水浴25 min,随即冰浴冷却,于8000 r/min,4 ℃离心15 min,以5%三氯乙酸作空白对照,于260 nm 处测OD 值,绘制标准曲线。随后取0.25 g 固态培养物,适当研磨,按照纯菌体中核酸的提取方法进行提取,未经发酵的固态基质采用同样的方法处理作为空白对照,在260 nm处测定提取液的OD 值,由所测OD 值对照纯菌体标准曲线关系换算成菌体量[27]。以纯菌体质量为横坐标,OD 值为纵坐标绘制标准曲线。本实验所得黄嗜热子囊生物量的标准曲线方程为y=26.17x+0.1011,R2=0.9988。
1.3 数据处理
试验测得的所有数据均利用Microsoft Excel 2010 进行处理,运用Origin 2021 软件完成相关图的绘制,其显著性用SPSS 20.0 软件处理分析。
2 结果与分析
2.1 培养基对黄嗜热子囊菌QH-1 生长的影响
将活化的黄嗜热子囊菌QH-1 接种在PDA、MEA、SDA、察氏培养基和G25N 培养基上,5 d 后菌落形态如图1 所示。从图1 中可以看出,PDA、MEA 和SDA 三种培养基营养丰富,在PDA、MEA 和SDA培养基上的生长速度较快,3 d 基本长满整个平板,而且菌丝致密呈辐射状生长,在PDA、MEA 上有明显褶皱形成,并且还有色素的产生,在PDA 和SDA 上色素呈橙色,在MEA 上则为暗红色;察氏培养基为合成培养基菌株,菌丝非常稀疏,生长较慢,也没有色素合成;G25N 培养基在察氏培养基的基础上添加了酵母浸出粉和大量甘油,在此培养基上黄嗜热子囊菌QH-1 生长速度最慢,在45 ℃培养5 d 后,菌落直径仅1.2 cm,几乎没有色素合成,说明甘油不是该菌株适宜的碳源。

图1 培养基对黄嗜热子囊菌QH-1 生长的影响Fig.1 Effect of culture medium on Thermoascus aurantiacus QH-1growth
2.2 黄嗜热子囊菌QH-1 生长温度三基点的测定
温度是影响微生物生长的重要因素。将活化好的黄嗜热子囊菌QH-1 接种到PDA 培养基上,在不同温度下生长5 d,其菌落直径如图2。从图2 中可以看出,黄嗜热子囊菌QH-1 在不同温度下菌落直径相差较大,45 ℃生长最快,菌落直径高达9 cm,而且在3 d 时就铺满整个平板;其次是55 ℃,直径为3.7 cm,35 ℃生长比较弱,仅1.4 cm,在30 和60 ℃几乎没有生长。可见最适生长温度为45 ℃。为进一步确定其最低和最高生长温度,从26~30 ℃和56~60 ℃范围内,每相差1 ℃考察其生长情况,结果见表1。从表1 可以看出,黄嗜热子囊菌QH-1 在26 和60 ℃不能生长,因此26 和60 ℃就是该菌株的最低和最高生长温度,满足20 ℃以下不能生长,最高生长温度大于50 ℃,是典型的嗜热真菌。

表1 黄嗜热子囊菌QH-1 的最低及最高生长温度Table 1 The maximum and minimum growth temperature of Thermoascus aurantiacus QH-1
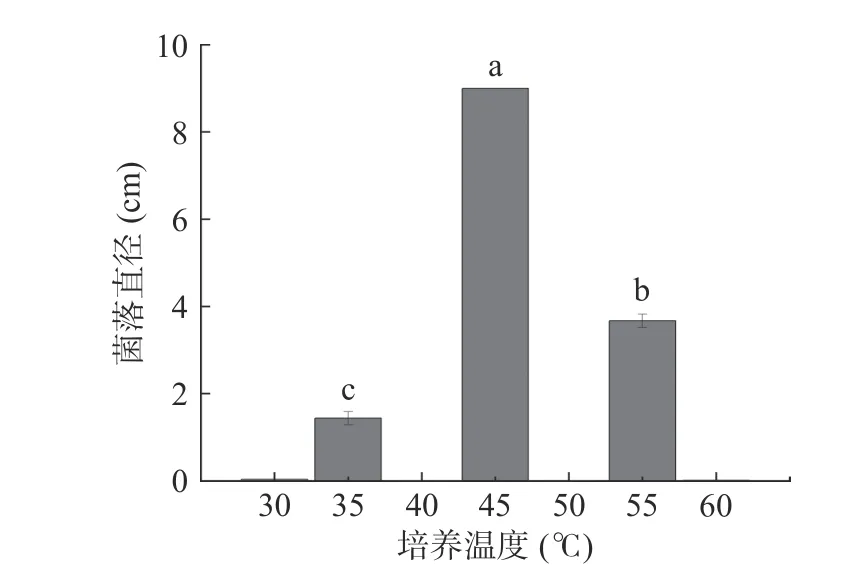
图2 温度对黄嗜热子囊菌QH-1 生长的影响Fig.2 Growth of Thermoascus aurantiacus QH-1 on different temperature
2.3 pH 对黄嗜热子囊菌QH-1 生长的影响
pH 也是影响微生物的生长繁殖及产物合成的关键因素[28]。pH 对黄嗜热子囊菌QH-1 生长的影响结果如图3 所示。从图3 中可以看出,随着pH 的不断升高,菌株的生物量不断增高。在pH4 时,黄嗜热子囊菌QH-1 的生物量最高,其干重可达2.09 g,菌株在pH4~6 范围内无显著性区别;而在pH7 时,黄嗜热子囊菌QH-1 的干重显著性降低,只有1.09 g。整体看来,黄嗜热子囊菌QH-1 适宜在pH<7 的弱酸性环境生长。

图3 pH 对黄嗜热子囊菌QH-1 生长的影响Fig.3 Effect of pH on the growth of Thermoascus aurantiacus QH-1
2.4 接种量对黄嗜热子囊菌QH-1 生长的影响
接种量是影响菌株生长的重要因素。一般接种量过高,培养基营养物质有限,菌体密度过高,使得菌体营养供给不足;接种量过低,菌种密度低,繁殖速度较慢[29]。黄嗜热子囊菌QH-1 在不同接种量培养基中的生长情况如图4 所示。从图中可以看出,黄嗜热子囊菌的接种量为3%时,菌株的生物量最高,为2.59 g;而随着接种量的升高,生物量呈现降低的趋势,推测是由于接种量过高,菌种繁殖速度较快从而导致培养基的营养物质消耗过快,使后期生长受到影响导致最终生物量降低。
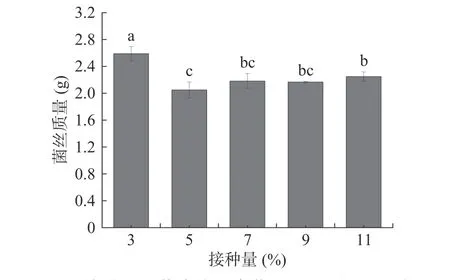
图4 接种量对黄嗜热子囊菌QH-1 生长的影响Fig.4 Effect of inoculum on the growth of Thermoascus aurantiacus QH-1
2.5 装液量对黄嗜热子囊菌QH-1 生长的影响
装液量会影响培养基中的溶解氧而影响微生物的生长。一般装液量越少,传氧系数越大。由于黄嗜热子囊菌QH-1 培养温度稍高,在液体培养过程中发酵液的蒸发不容忽视[30]。所以在液态培养时,需要对摇瓶装液量进行研究,找出适合的装液量。黄嗜热子囊菌QH-1 在不同装液量培养基中生长情况如图5所示。从图中可以看出,随着装液量的不断增加,微生物的生物量也在增加。在装液量达到160 mL 时,黄嗜热子囊菌QH-1 的生物量最高,为3.31 g;而在装液量为180 mL 时,生物量出现了下降,为2.99 g,推测由于装液量过高,使得锥形瓶内氧气含量降低,导致菌体死亡。因此160 mL 为黄嗜热子囊菌QH-1 液态培养的最佳装液量。

图5 装液量对黄嗜热子囊菌QH-1 生长的影响Fig.5 Effect of liquid volume on the growth of Thermoascus aurantiacus QH-1
2.6 制曲原料对黄嗜热子囊菌QH-1 生长的影响
黄嗜热子囊菌在多种大曲中发现,有可能是酿酒功能菌[31-34]。不同的酿酒原料由于营养成分及比例不同,会影响黄嗜热子囊菌QH-1 的生长。将黄嗜热子囊菌QH-1 接种在不同酿酒原料制成的液态培养基,其生长情况如图6 所示。从图中可以看出,黄嗜热子囊菌QH-1 在高粱米液态培养基中的生物量最高,为0.57 g;而在小麦和大麦制成的混合培养基中的生物量最低,仅0.24 g/100 mL。此外,从图6中可以看出,黄嗜热子囊菌QH-1 在3 d 内的生长状况没有在以发酵培养基为营养成分培养的效果好,其原因是微生物在短期生长时间内,不能直接利用制曲原料中复杂的营养成分,例如多糖、纤维素等,而相对于制曲原料来说,发酵培养基的成分比较简单,黄嗜热子囊菌QH-1 可以直接利用。因此,黄嗜热子囊菌QH-1 在合成培养基中的生长速度高于在天然培养基中培养,而在天然培养基中,高粱米是最佳培养原料。

图6 不同制曲原料对黄嗜热子囊菌QH-1 生物量的影响Fig.6 Effects of different materials on the biomass of Thermoascus aurantiacus QH-1
2.7 黄嗜热子囊菌QH-1 乙醇耐受性分析
在白酒的酿造过程中,随着发酵时间的推移,乙醇是最主要的代谢产物,会影响很多酒醅微生物的生长代谢,乙醇耐受性是酿酒微生物必备的重要特性[35]。黄嗜热子囊菌QH-1 在不同乙醇浓度培养基中的生长情况如图7 所示。从图中可以看出,黄嗜热子囊菌QH-1 在0~6%乙醇含量的培养基中生长3 d 后的生物量没有显著性差异,为1.16~1.26 g,也就是说6%的乙醇对黄嗜热子囊菌QH-1 的生长没有任何影响;当乙醇含量增长为9%时生物量出现了显著下降为0.77 g,并且随着乙醇含量的不断增加,生物量明显下降。因此低浓度乙醇含量不会影响黄嗜热子囊菌QH-1 的生长,但随着乙醇含量的不断增加,其生长会受到影响。
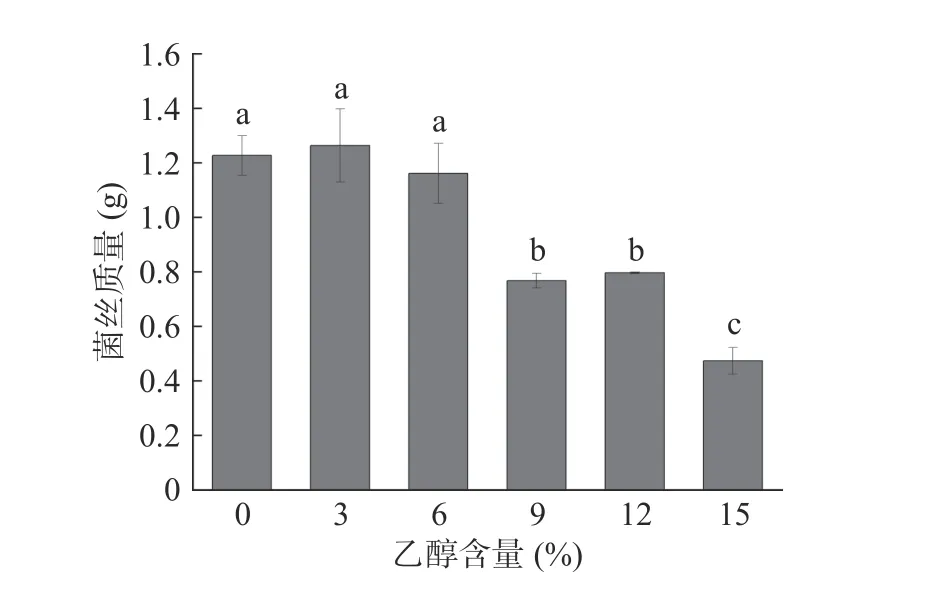
图7 乙醇浓度对黄嗜热子囊菌QH-1 生长的影响Fig.7 Effects of different ethanol content on the biomass of Thermoascus aurantiacus QH-1
2.8 黄嗜热子囊菌QH-1 的生长曲线及产酸能力
为了进一步考察黄嗜热子囊菌QH-1 在清香大曲制曲过程中的生长代谢,为该菌的开发利用提供信息,将黄嗜热子囊菌QH-1 以5%的接种量接种于大麦和豌豆组成的固态培养基中,培养不同时间后测定其生长量以及培养物的pH 和酸度,结果如图8 所示。从图8 中可以看出,黄嗜热子囊菌QH-1 在清香大曲原料中可以生长,前期生长较为缓慢,6~8 d 生长较快,之后趋于平稳,第10 d 达到0.45 g/g。黄嗜热子囊菌QH-1 在大麦豌豆培养基中生长时,能产生少量的酸,在第10 d 固态培养物中酸度达到2.1 mmol/10 g,pH 则从7.44 降到6.86。酿酒过程中,大曲糖化酶将高粱淀粉降解为还原糖后,经酵母菌转化为酒精,如果其他微生物将还原糖代谢为酸等其他代谢产物将会降低产酒率。酒醅中往往有大量乳酸菌,把还原糖转化为乳酸,形成白酒主要风味物质,但是如果乳酸过多,除了降低酒精产量外,乳酸与乙醇酯化为乳酸乙酯,改变酒醅中乙酸乙酯与乳酸乙酯的比例,改变清香白酒的口感,进而影响新产酒的质量[36]。另外,丝状真菌也在酒醅中出现,如黑曲霉、红曲霉和米根霉等均可代谢产生有机酸,也会影响产酒率[37-43]。黄嗜热子嚢菌QH-1 在45 ℃产酸较少,pH 仅下降0.58,在正常酿酒的条件下,产酸可能会更少些,不会影响产酒率。

图8 黄嗜热子囊菌QH-1 的生长曲线及产酸变化Fig.8 Growth curve and changes in acid production of Thermoascus aurantiacus QH-1
2.9 黄嗜热子囊菌QH-1 糖化力和液化力分析
大麦和豌豆主要成分是淀粉,黄嗜热子囊菌QH-1 纯菌株能在大麦豌豆固态培养基中生长,说明其能产生一定的淀粉酶。因此,考察了其糖化力和液化力,结果如图9 所示。从图9 可知,在培养前4 d几乎没有糖化酶,第6 d 开始检测到糖化酶,之后糖化酶活性逐渐增强,第10 d 时达到349 U,糖化力的变化趋势与其生长曲线较为相似,说明黄嗜热子囊菌QH-1 产生糖化力降解淀粉产生葡萄糖,提供碳源在黄嗜热子囊菌QH-1 生长中起到重要作用。液化力直到第10 d 才检测到,为0.73 U。本课题组在跟踪大曲制作过程中液化力变化时,发现液化力也是在制曲后期出现,推测液化酶可能需要特殊的物质诱导才能合成。从图8 的生长曲线可知,第10 d 时黄嗜热子囊菌QH-1 处于稳定期,会有大量次生代谢物出现,因而诱导液化酶合成并表现出活性。

图9 黄嗜热子囊菌QH-1 固态发酵过程中的糖化力与液化力Fig.9 Saccharification and liquefaction power of solid-state fermentation of Thermoascus aurantiacus QH-1
3 结论
本研究对红心曲来源黄嗜热子囊菌QH-1 的生物学特性进行了分析。黄嗜热子囊菌QH-1 在营养丰富的PDA、SDA、MEA 培养基上生长速率较快,菌丝呈放射性生长,呈现深浅不等色素;在察氏培养基及G25N 培养基上生长速率较慢,且菌丝稀疏透明。黄嗜热子囊菌QH-1 的最适生长条件为:45 ℃,pH4.0,接种量为3%,装液量为160 mL,6%的乙醇,以高粱米浸出液为培养基。在清香大曲原料大麦豌豆中,前期糖化力较低,生长较慢,6~8 d 时糖化力最高,生长也最快,第10 d 检出有液化力,在大麦豌豆中的生长曲线与糖化酶合成曲线较为相似,生长过程中产生少量的酸。本研究结果丰富了大曲的功能微生物,为黄嗜热子囊菌QH-1 的进一步开发利用提供必要信息。但是,红心曲的重要特征是红心,黄嗜热子囊菌QH-1 产生红色色素的条件还不确定,在制曲酿酒中真正起作用的是色素,还是与色素相平行的其他代谢产物尚不清楚,都需要进一步的考察研究。
