EGCG 和异鼠李素的细胞抗氧化协同作用
2023-11-20潘俊坤焦中高
潘俊坤,焦中高,张 强
(中国农业科学院郑州果树研究所,河南郑州 450009)
表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)广泛存在于茶叶中,是一种儿茶素类物质,占茶多酚含量的30%~50%[1]。EGCG 结构富含多个羟基基团,具有良好的抗氧化、抗癌、抗炎、降血糖等功能活性[2-4]。异鼠李素(isorhamnetin)广泛存在于银杏、沙棘等植物中,是一种黄酮醇类化合物[5-6]。异鼠李素结构也富含多个羟基基团,具有抗炎、抗氧化、抗癌、降血脂等生物活性[7-10]。
在探寻天然高效抗氧化活性资源的过程中,单一活性成分的抗氧化活性研究备受关注,而复配组分研究尚有不足。有研究发现,单一天然活性成分的抗氧化效果有弱于复配组分的现象发生[11-13]。王娜等[14]利用中效定理分析发现,白藜芦醇与维生素E 在体积比为1:1~7:1 之间具有良好的协同效果(联合作用指数(Combination Idex,CI)<0.95),且当体积比为3:1 时,CI 值最小,其清除DPPH·的半抑制浓度IC50值为0.011 mg/mL,因此当体积比为3:1 时该复配组分具有最佳的协同抗氧化作用。
近年来,已有报道化合物组合对细胞模型相关活性影响的研究。Liu 等[15]研究槲皮素(5 μmol/L)和EGCG(5 μmol/L)联合处理对HepG2 细胞胰岛素抵抗模型糖代谢的影响,首次报道miR-27a-3p 和miR-96-5p 通过抑制FOXO1 表达参与槲皮素和EGCG联合作用棕榈酸诱导的胰岛素抵抗的协同保护作用。Pan 等[16]研究酚酸和胡萝卜素对H2O2诱导的H9c2 细胞的协同抗氧化作用发现,酚酸增加了细胞对胡萝卜素的摄取及其膜转运蛋白的表达。酚酸含量较高的组合具有协同作用,其中β-胡萝卜素:咖啡酸=1:2 时,显著抑制了细胞内ROS,Synergistic rate(SR)>1 表现出协同作用,并增加了细胞核Nrf2 的表达。关惠[17]的研究发现槲皮素和儿茶素(12.5+12.5 μmol/L)通过靶向FOXO3协同抑制CHUK基因转录增强细胞抗氧化应激的分子机制可能是:槲皮素和儿茶素通过共同作用于CHUK转录因子FOXO3的DNA 结合域,干扰靶基因DNA 的结合,并破坏蛋白-DNA 复合物的稳定性,进而协同抑制FOXO3与CHUK启动子序列的结合,抑制CHUK的转录表达,影响CHUK下游基因表达,从而协同增强细胞抗氧化应激作用。因此研究具有协同增效的细胞抗氧化活性植物天然成分,为食源性类黄酮功能性食品的开发提供理论依据。
本研究通过2,2'-偶氮二异丁基脒二盐酸盐[2,2-Azobis(2-amidinopropane)dihydrochloride solution,AAPH]诱导构建了HepG2 细胞抗氧化模型,设置EGCG 和异鼠李素组合质量浓度比为7:4、6:4 和6:5,通过此模型验证了不同比例EGCG 和异鼠李素组合对HepG2 细胞抗氧化作用,采用Chou-Talalay中效分析法评价不同比例的EGCG 和异鼠李素细胞抗氧化协同效应,并进一步探究联合指数(Combinaion Index,CI)最优组合对HepG2 细胞内抗氧化相关酶的影响。研究结果为揭示EGCG 和异鼠李素抗氧化应激的协同增效机制提供了理论依据,同时为明确膳食中抗氧化成分的生物学功能提供了理论参考。
1 材料与方法
1.1 材料与仪器
EGCG 标准品(98%)、异鼠李素标准品(98%)、最小必需培养基(Minimum Essential Medium,MEM)、PBS 缓冲液(phosphate buffer solution)、胰蛋白酶、CCK-8 试剂盒 北京索莱宝科技有限公司;2,2'-偶氮二异丁基脒二盐酸盐[2,2-Azobis(2-amidinopropane)dihydrochloride solution,AAPH]、2',7'-二氯荧光素二乙酸酯(2',7'-Dichlorfluorescin diacetate,DCFH-DA)、胎牛血清(Fetal bovine serum,FBS)Gibco 公司;Western、IP 裂解液、苯甲基磺酰氟(PMSF)、BCA 蛋白浓度测定试剂盒 碧云天科技公司;总超氧化物歧化酶(SOD)活性检测试剂盒、过氧化氢酶(CAT)检测试剂盒、总谷胱甘肽过氧化物酶(GSH-Px)检测试剂盒 南京建成生物工程研究所;HepG2细胞 中科院昆明动物所。
CO2培养箱 Thermo Fisher 公司;SpectraMax i3X 酶标仪 Molecular Devices 公司;XDS-1 系列倒置生物显微镜 重庆重光实业有限公司;SW-CJ-2FD 超净工作台 苏州净化设备有限公司;Centrifuge 5427R 离心机 德国Eppendorf 公司;-80 ℃冰箱 青岛海尔特种电冰柜有限公司;LDZX-50KBS立式压力蒸汽灭菌锅 上海申安医疗器械厂;GL224i-1SCN 分析天平 赛多利斯科学仪器(北京)有限公司。
1.2 实验方法
1.2.1 联合指数法 采用CompuSyn 分析软件计算EGCG 和异鼠李素组合细胞抗氧化活性的联合指数CI[18]。联合指数公式为:CI=(D)1/(DX)1+(D)2/(DX)2,其中(D)1、(D)2分别为复配处理时,活性达到x%,两种植物化学各自浓度,DX 为单一物质活性达到x%所需的物质浓度[19]。当CI<1 时,表示协同作用;CI=1 时,表示相加作用;CI>1 时,表示拮抗作用。
1.2.2 细胞培养 HepG2 细胞为贴壁细胞生长,该细胞培养在10%胎牛血清、1%双抗(100×)的MEM培养基中,在37 ℃、5% CO2、95%湿度培养箱中孵育,每1~2 d 更换培养基。当细胞在培养瓶中生长到80%~90%后,移除培养基,常温下PBS 清洗1~2 次,加入1~2 mL 含EDTA 的胰蛋白酶消化液于25 cm2培养瓶中,消化2~3 min,待细胞消化完成后加入2 mL完全培养基,1000 r/min 下离心5 min,弃去上清液后用完全培养基重悬细胞,按照后续实验需要的细胞数量进行传代。
1.2.3 细胞毒性实验 采用CCK-8 法检测细胞毒性活性,参照Liang 等[18]方法,将密度为5.0×104个/孔的HepG2 细胞接种于96 孔板各孔中,每孔接种100 μL,每组设置6 个重复,培养24 h。实验组每孔加入100 μL MEM 培养基(包含不同浓度比的EGCG+异鼠李素组合,EGCG 或异鼠李素),并设置6 个重复,正常对照组加入相同体积的完全培养基,继续培养24 h 后,每孔加入10 μL 的CCK-8 溶液培养1~2 h 后,96 孔板放于酶标仪450 nm 处测定OD 值,计算细胞存活率。
1.2.4 细胞抗氧化实验(CAA)参照Tu 等[20]方法取对数生长期的HepG2 细胞,在96 孔板中加入100 μL培养基其细胞密度达到5×104个/孔;培养24 h 后除去培养基,并用PBS 清洗1~2 次;分别加入包含EGCG、异鼠李素,不同质量浓度比的EGCG+异鼠李素组合的DCFH-DA 探针培养基,其中DCFH-DA探针终浓度为25 μmol/mL,继续孵育1 h;1 h 后,去除培养基,每孔加入100 μL 的PBS 清洗3 次;然后加入100 μL 的浓度为600 μmol/mL 的AAPH(Hanks溶液稀释),将96 孔板放入多功能酶标仪检测,恒温37 ℃。酶标仪测定条件为:激发波长485 nm,发射波长538 nm,振荡5 s,然后每5 min 测定一次,测定60 min。计算公式如下:CAA(unit)=1-(∫SA/∫CA),∫SA:样品时间-荧光值曲线下的积分面积;∫CA:对照时间-荧光值曲线下的积分面积;EC50根据lg(fa/fu)/lg(dose)的中效原理计算;fa:CAA unit;fu:1-CAA unit。实验中每个样品做四个重复,实验空白组即加入探针DCFH-DA 但不加AAPH 及抗氧化剂的荧光衰减组;实验阳性对照为加自由基激发剂AAPH 和探针DCFH-DA 的荧光衰减组,样品实验剂量对细胞生长的抑制率在10%以下进行。
1.2.5 细胞内抗氧化酶活性实验 参照Zhang 等[21]和Shi 等[22]取对数生长期的HepG2 细胞浓度为106个/mL,均匀铺于6 孔板内,培养24 h 后待其贴壁生长后清除培养基;加入含EGCG+异鼠李素组合的基础培养基,1 h 后,用PBS 清洗1~2 次;加入1.5 mL 600 μmol/mL AAPH 在37 ℃,5% CO2培养箱里孵育1.5~2 h;阳性对照组加入AAPH 不加抗氧化剂(NC),阴性对照组不加AAPH 和抗氧化剂(PC);然后用PBS 清洗一次,用细胞刮刀刮下细胞,1000 r/min离心10 min 后收集细胞,弃上清;再加1 mL PBS 离心10 min,弃上清;加入IP 裂解液(加PMSF,100:1,v/v)30~40 min(冰上操作),4 ℃下18495 r/min离心10 min,取上清分装,-80 ℃下保存。按试剂盒说明书进行操作,取适量先进行蛋白含量测定,然后检测总SOD、CAT 和GSH-Px 的活性。
1.3 数据处理
所有结果均以平均值±标准差(mean±SD)表示。通过SPSS 软件对实验数据进行统计分析,采用ANOVA 单因素进行统计学分析,并采用Duncan模块结合事后多重比较进行显著性分析,以P<0.05表示具有统计学显著差异,采用Sigmaplot 10.0 软件进行绘图。
2 结果与分析
2.1 EGCG、异鼠李素以及EGCG 和异鼠李素组合的细胞抗氧化活性
CAA 法是一种从细胞水平反映抗氧化剂的吸收和代谢的变化情况,更真实地模拟机体的正常生理状态[23]。CAA 法中荧光探针DCFH-DA 本身没有荧光,但可以自由穿过细胞膜,进入细胞内后会被细胞内相应的蛋白酯酶水解生成DCFH,此时细胞内的活性氧通过氧化无荧光的DCFH 从而能变成有荧光的DCF,因此检测荧光值就能反映细胞内活性氧的水平[24-25]。
采用HepG2 细胞抗氧化评价模型评价不同浓度梯度下样品的细胞抗氧化活性。如图1 所示,EGCG 和异鼠李素的EC50值分别为6.2±0.2 和3.8±0.1 μg/mL,两者细胞抗氧化活性具有显著性差异(P<0.05)。在联合作用实验中,为了每个单体化合物具有相似的活性,确定每个单体化合物的(EC50)1/(EC50)2为组合物的质量浓度比。并以(EC50)1/(EC50)2比例为参照,调整各个单体化合物质量浓度比例,确定组合物的质量浓度比分别为6:4、6:5、7:4。因此,以EGCG 组(7 μg/mL)、异鼠李素组(5 μg/mL)、组合1(6+4 μg/mL)、组合2(6+5 μg/mL)和组合3(7+4 μg/mL)为各样品细胞抗氧化实验作用浓度。结果显示,EGCG 和异鼠李素组合的EC50值分别为5.0±0.2、5.25±0.2 和5.50±0.2 μg/mL,组合1 的活性优于其他组合活性。EGCG+异鼠李素组合的EC50值分别是EGCG 组的0.81 倍、0.85 倍和0.89 倍,表明EGCG+异鼠李素组合抗氧化活性显著高于EGCG 组(P<0.05)。然而,EGCG+异鼠李素组合的EC50值均高于异鼠李素组,表明组合物的抗氧化活性显著弱于异鼠李素组(P<0.05)。
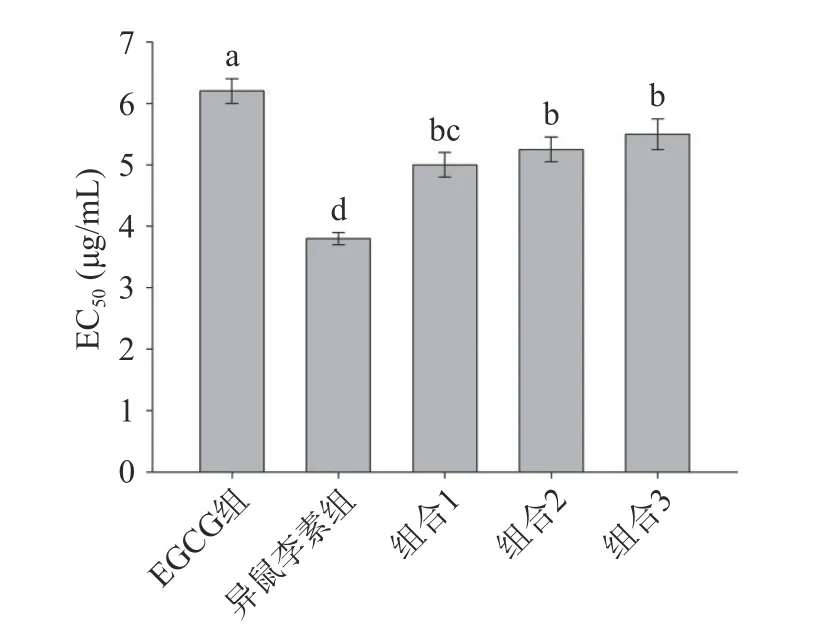
图1 EGCG 组、异鼠李素组、EGCG+异鼠李素组合的EC50 值Fig.1 EC50 of EGCG,isorhamnetin,and EGCG+isorhamnetin combinations
综上所述,EGCG 和异鼠李素组合可保护HepG2细胞免受AAPH 诱导的氧化损伤。其中,组合1 的细胞抗氧化活性较强。目前,依据不同活性成分相互作用效果的不同将其相互作用关系分为:协同增效作用、拮抗作用和简单加和作用。从生物学角度来看,细胞摄取量对活性成分的生物可及性和生物利用度造成一定影响,并影响其最终在体内抗氧化作用的发挥。Chen 等[26]研究表明,黄酮类化合物(槲皮素、木犀草素)和类胡萝卜素(番茄红素、叶黄素)在总浓度为8 μmol/mL 的不同比例下结合,番茄红素:槲皮素=1:5 复配组作用后,促进了番茄红素的细胞从而增强了其细胞抗氧化活性。Phan 等[27]研究发现,花青素和β-类胡萝卜素联合作用Caco2 细胞时,增加了β-类胡萝卜素的细胞吸收,但对其细胞抗氧化活性产生了拮抗作用,可能与β-类胡萝卜素和花青素共同作用时,β-类胡萝卜素细胞浓度达到一定水平时表现出促氧化作用有关。因此,活性成分的摄取量可能是影响其细胞抗氧化活性的关键因素,也是未来研究方向中需要特别关注的内容。
2.2 EGCG 和异鼠李素组合对HepG2 细胞存活率的影响
利用CCK-8 法,对EGCG、异鼠李素以及EGCG和异鼠李素组合在不同浓度梯度处理HepG2 细胞24 h,进行细胞毒性分析。由2.1 中可知EGCG 和异鼠李素的EC50分别为6.2±0.2 和3.8±0.1 μg/mL,在联合作用实验中,以单体化合物的(EC50)1/(EC50)2为组合的质量浓度比参照,并上下调整质量浓度比例,确定组合物的质量浓度比分别为6:4、6:4、7:4。因此,以EGCG 组(7 μg/mL)、异鼠李素组(5 μg/mL)、组合1(6+4 μg/mL)、组合2(6+5 μg/mL)和组合3(7+4 μg/mL)为各样品CCK-8 实验作用浓度。结果如图2 所示,经不同质量浓度的EGCG、异鼠李素以及不同质量浓度比的EGCG 和异鼠李素组合处理24 h 后,细胞存活率均在90%以上,该浓度下各样品符合后续细胞抗氧化实验细胞毒性要求。EGCG和异鼠李素在不同浓度下,其细胞存活率存在显著性差异(P<0.05);而EGCG 和异鼠李素组合(6:4,6:5,7:4,c/c)三者之间的细胞存活率无明显差异(P>0.05)。结果表明,本实验中各处理组所使用样品浓度,对HepG2 细胞无明显毒副作用。
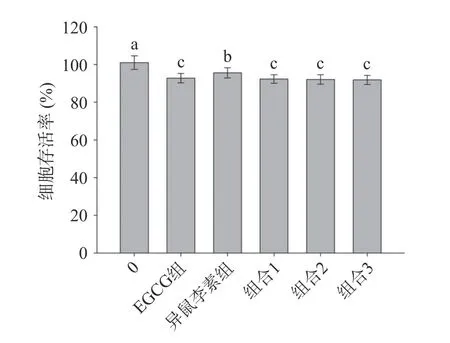
图2 EGCG 组、异鼠李素组、EGCG+异鼠李素组合对HepG2 细胞存活率的影响Fig.2 Effects of EGCG group,isorhamnetin group,and EGCG+isorhamnetin groups on the surviral rates of HepG2 cells
2.3 EGCG 和异鼠李素组合联合指数CI
Chou 和Talalay 引入了联合指数(CI)方法,将药物联合效应定量描述为协同效应(CI<1)、加和效应(CI=1)或拮抗效应(CI>1)。随着Chou-Talalay 理论的发展,CompuSyn 软件被开发出来,用于剂量效应分析、CI 计算和Fa-CI 图模拟[28]。本研究采用Chou-Talalay 联合指数法,考察EGCG 与异鼠李素联合作用是否具有协同作用。在联合作用试验中,以EGCG 和异鼠李素的EC50值为指导选择单个浓度。CI 值由CompuSyn 软件计算。EGCG 和异鼠李素在50%、75%和90%抗氧化效果下(GI50、GI75和GI90)的CI 值见表1。
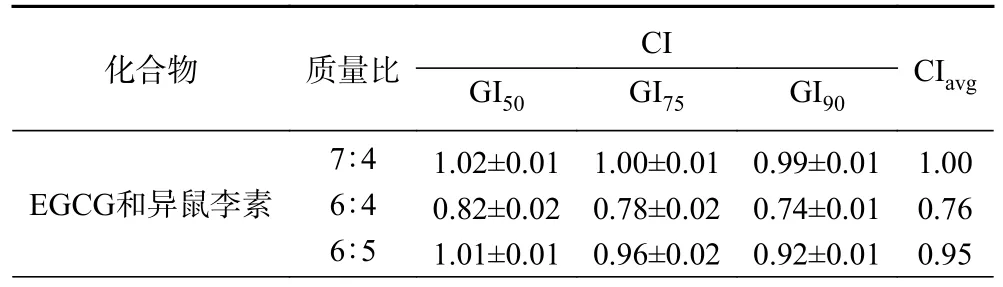
表1 EGCG 和异鼠李素组合的CI 值Table 1 CI value of EGCG+isorhamnetin
如图3 所示,随着浓度的增加各单体及EGCG和异鼠李素组合细胞抗氧化活性也随之增加,呈剂量-效应关系。图3A~图3C 中,浓度在0~5 μg/mL时,异鼠李素组的CAA 值最高,为53.5%±2.7%,与EGCG 组和组合的CAA 值具有显著性差异(P<0.05);浓度在10 μg/mL 时,组合的CAA 值此时最高,分别为65.6%±2.3%、70.1±2.5%和68.2±2.2%,且与浓度为5 μg/mL 时的EGCG 组(51.6%±1.7%)和异鼠李素组(53.5%±2.7%)的活性存在显著性差异(P<0.05)。结果表明,EGCG+异鼠李素组合可能具有协同作用。

图3 EGCG(7 μg/mL)、异鼠李素(5 μg/mL)、EGCG+异鼠李素组合的CAA 值Fig.3 CAA of EGCG (7 μg/mL),isorhamnetin (5 μg/mL)and EGCG+isorhamnetin
依据图3 中各单体及组合在相应浓度下的CAA值,经过CompuSyn 软件计算,得到EGCG 和异鼠李素组合的CI 值,结果如表1 所示。表1 是利用联合指数法计算出各不同浓度EGCG 和异鼠李素组合联用时的平均CI 值,从表1 可以看出EGCG 和异鼠李素联合作用时,在浓度比为6:4 和6:5 时,具有协同作用。EGCG 和异鼠李素的联合使用,在两者的浓度为7:4 时,其联合用药系数CI 约为1,联合用药指数均值(CIavg)为1.00,表现出了叠加作用。在两者的浓度比为6:4 时,其中,GI75和GI90均小于0.80,说明两者在浓度为6:4 时表现出了较强的协同作用,联合用药指数均值(CIavg)为0.76。在两者的浓度比为6:5 时,GI50约为1,GI75和GI90小于1,说明两者在浓度为6:5 时表现出了较弱的协同作用,联合用药指数均值(CIavg)为0.95。图4 为EGCG和异鼠李素组合(6:4)在CIavg最小时的Fa-CI 趋势图,随着Fa 值的增加,CI 值呈降低趋势,即表明随着细胞抗氧化活性的增加,EGCG 和异鼠李素组合的协同增效作用更佳。结果表明,在一定的浓度范围内,EGCG 和异鼠李素组合对HepG2 细胞具有协同抗氧化保护作用。EGCG+异鼠李素(6:4)的CI 值为最佳组合,因此选用EGCG+异鼠李素(6:4)进行后续实验。
于佳成[29]发现,槲皮素与儿茶素(12.5 μmol/L+12.5 μmol/L)的浓度组合对H2O2诱导HepG2 细胞氧化损伤具有协同保护作用,其联合指数CI 值为0.374,表明组合协同效果较好;进一步细胞内抗氧化酶实验发现,二者联合处理后,SOD、CAT、GPx 活性和MDA 含量比单药处理显著性降低,说明槲皮素和儿茶素组合在消除ABAP 诱导的HepG2 细胞氧化应激酶活方面具有一定的协同增效作用。Saw等[30]也研究发现,低浓度下的槲皮素和山奈酚,槲皮素和紫檀芪以及山奈酚和紫檀芪组合通过上调Nrf2通路上的mRNA 和蛋白的表达,增加了其清除自由基(ROS)等能力,对H2O2诱导HepG2-C8 细胞氧化损伤达到协同抗氧化保护效果。研究结果与本文结果趋势一致,组合物对细胞都起到了协同保护作用。然而,这些结果表明,每个组合的协同作用水平与单个化合物的抗氧化作用无关,剂量效应关系并不能说明其机制,它只显示了质量作用律参数[31]。基于以上结果,EGCG 与异鼠李素联用潜在的协同作用机制有待进一步探讨。
2.4 细胞内抗氧化相关酶活性
ROS 的过量产生导致细胞内氧化应激失衡,从而可能导致细胞损伤,是导致慢性疾病的主要因素,包括衰老、心血管病、高血压和神经退行性疾病[32]。AAPH 诱导ROS 生成可引起细胞内抗氧化防御系统失衡,SOD、CAT 和GSH-Px 是清除自由基的主要酶。抗氧化酶系统对氧化应激损伤起着重要的防御作用。为了评估抗氧化酶系统是否在HepG2 细胞中发挥作用,检测了抗氧化酶(SOD、CAT 和GSH-Px)的活性,这些酶在人体氧化应激平衡中起着重要作用[33]。因此,细胞内抗氧化酶活性的变化可以反映HepG2 细胞抑制活性氧(ROS)的能力。
为了进一步阐明EGCG 与异鼠李素(6:4)联合抗氧化的作用机制,对SOD、GSH-Px 和CAT 的活性进行了测定。结果如表2 所示,与PC 细胞相比,NC 细胞在600 μmol/mL AAPH 作用1 h 后,SOD、CAT 和GSH-Px 活性分别显著降低51.2%、53.5%和57.1%,表明AAPH 对HepG2 细胞产生了氧化损伤。而当EGCG 和异鼠李素组合提前孵育1 h 后,结果发现HepG2 细胞内SOD、CAT 和GSH-Px 相比于NC 均有上升且随剂量增加而增强加。如表2结果,与NC 细胞相比,EGCG 和异鼠李素组合在浓度1.5+1 μg/mL 作用细胞时,SOD 无显著性差异(P>0.05),然而在3+2 μg/mL 和6+4 μg/mL 时,具有显著性差异(P<0.05),且CAT 和GSH-Px 的活性与SOD 相似。相比于NC 细胞,EGCG 和异鼠李素组合作用与HepG2 细胞,其SOD 活性分别增加了5.2%、21.1%和49.1%;GSH-Px 的活性分别增加了7.6%、27.8%和57.6%;CAT 活性分别增加了5.6%、24.6%和42.1%。结果与CAA 测定结果一致。组合具有较好的细胞抗氧化活性,抗氧化酶活性也较高。

表2 EGCG 和异鼠李素组合(6:4)对HepG2 细胞抗氧化相关酶的活性的影响Table 2 Effects of EGCG+isorhamnetin (6:4) on activities of antioxidant enzymes in HepG2 cells
综上所述,EGCG 与异鼠李素(6:4)组合可通过调节抗氧化酶活性抑制AAPH 诱导的HepG2 细胞氧化应激。同时,高浓度组合在样品组中SOD、CAT 和GSH-Px 的活性最好。结果表明,适当浓度的组合表现出更好的抗氧化酶活性,说明较高的酶活性是细胞抗氧化协同作用的机制。Wen 等[34]发现荔枝叶肉桂素B1 通过上调SOD、CAT 和GSH-Px 活性,可抑制较强的细胞内抗氧化活性。Jiang 等[35]报道Jiupei 肽具有良好的细胞抗氧化活性,SOD、CAT和GSH-Px 活性呈剂量依赖性增加。Zhou 等[36]研究发现,马氏螯虾肉中的抗氧化肽可显著提高HepG2细胞谷胱甘肽(GSH)和过氧化氢酶(CAT)的产生,以及Nrf2 信号通路相关基因的表达。同样,Huo 等[37]也报道了白酒中的抗氧化肽通过清除活性氧(ROS)和上调细胞抗氧化酶(SOD、CAT 和GSH-Px)活性发挥保护作用。如图5 所示,EGCG 和异鼠李素组合可以穿过细胞膜,增加SOD、CAT 和GSH-Px 的活性,共同清除活性氧(reactive oxidative species,ROS)。结果表明,EGCG 和异鼠李素联合作用主要提高了HepG2 细胞的抗氧化酶活性。因此,EGCG与异鼠李素联用的协同机制为:上调较高的SOD、CAT 和GSH-Px 活性,来抑制ROS 的产生,从而达到平衡机体氧化应激反应的效果,为食源性类黄酮功能性食品的开发提供理论依据。

图5 EGCG 和异鼠李素组合在HepG2 细胞内协同抗氧化作用机制示意图Fig.5 Possible mechanisms of EGCG+isorhamnetin combination antioxidant activities in HepG2 cells
3 结论
综上所述,EGCG 和异鼠李素组合联合应用对HepG2 细胞的协同增效保护作用,与单独使用EGCG或异鼠李素相比,联合作用通过上调细胞内抗氧化相关酶活性更大程度地清除HepG2 细胞内的ROS。但本研究仍有许多不足之处:本研究仅限于体外单一细胞系,在后续的研究中可在多种细胞系中进行验证,在条件允许下可进一步在动物实验或临床实践中进一步验证;EGCG 和异鼠李素联合应用在体内的毒性研究需要进一步验证;后续研究中可在分子水平上进一步阐释EGCG 和异鼠李素的细胞抗氧化协同作用的分子机制。本研究虽存在这些局限,但初步结果表明,EGCG 和异鼠李素联合应用可能是一种潜在的抗氧化剂的候选组合,并为其后续功能性产品的开发奠定了理论基础。
