苁蓉散对晚发型阿尔茨海默病模型小鼠认知障碍的影响*
2023-11-13刘鹏飞
刘鹏飞,李 炎,2
(1.扬州大学医学院中西医结合老年病防治重点实验室,江苏 扬州 225009;2.扬州大学附属医院,江苏 扬州 225009)
阿尔茨海默病(Alzheimer's disease,AD)是一种常见的神经退行性疾病,其病理特征包括突触和神经元的丢失、神经纤维缠结和老年斑的形成[1]。该病的临床表现以记忆和其他认知功能的逐渐丧失为特征[2]。AD在组织病理学上与其他痴呆症的区别在于大量淀粉样β蛋白(Amyloid β,Aβ)在神经元外沉积,而Aβ在AD的发生和发展中起着重要作用[3-5]。Aβ及其沉积物具有广泛的神经毒性[6-8],包括抑制神经元突触可塑性和诱导神经元死亡[9-11]。年龄的增长是晚发型AD的最大危险因素,这表明衰老过程可以启动或促成AD发病。衰老与下丘脑-垂体-性腺(hypothalamic- pituitary-gonadal,HPG)轴的变化和性腺功能的逐渐下降密切相关[12-15]。研究表明,雄激素或雌激素可通过减少Aβ的产生、改善突触信号传导[16]及对抗神经元凋亡发挥神经保护作用[17-18],因此性激素的缺乏参与了晚发型AD的发生发展。
苁蓉散“久服至老不忘”,出自《证治准绳》。苁蓉散临床常用于防治老年期认知障碍性疾病,但其作用机制还未见报道。本研究基于晚发型AD患者的主要病理和生理特征,通过单侧性腺(睾丸)切除和双侧海马齿状回注射Aβ建立雄性晚发型AD小鼠模型并以苁蓉散加以干预,观察苁蓉散的改善作用并探究其作用机制,以期为苁蓉散“久服至老不忘”提供实验基础。
1 材料与方法
1.1 实验动物 8周龄SPF级雄性ICR小鼠50只,体质量(25.32±3.76)g,由扬州大学比较中心提供,生产许可证号:SCXK(苏)2022-0009;使用许可证号:SYXK(苏)2022-0044。动物饲料均由扬州大学比较中心提供,饲养环境:温度20~25 ℃,12 h光照/12 h黑暗周期,相对湿度50%~65%。小鼠适应性喂养1周后开展实验。本研究对动物的各种处理均遵守扬州大学有关动物使用及伦理学规定,所有动物实验获得扬州大学医学伦理委员会批准,批准编号:YXYLL-2022-132。
1.2 药物与试剂 苁蓉散方药组成(成人剂量):肉苁蓉15 g,续断15 g,远志10 g,石菖蒲10 g,茯苓10 g。总生药量为60 g,中药材均由扬州市中医院中药房提供,经鉴定均为正品。药材鉴定人:扬州大学苏佩清教授。苁蓉散水煎液制备:以药物8倍质量的水浸泡2 h,煎煮30 min后,取出药汁。再向药物中加入同体积的水,同样方法煎煮40 min,两次煎煮的药汁混合,60 ℃挥发浓缩至相当于生药质量浓度为1.6 g/mL,4 ℃储存备用。
氟他胺(雄激素受体拮抗剂,0.25g/片,上海复旦复华药业有限公司,批号:210803);青霉素钠(联迈生物公司,批号:LM1026);4%多聚甲醛固定液(批号:P0099)、苏木素-伊红(HE)染色试剂盒(批号:C0105S)、Aβ1~42(批号:P9001)、二甲亚砜(DMSO)(批号:ST038)、磷酸盐缓冲盐水(PBS)(批号:C0221A)均购自上海碧云天生物技术公司;小鼠促性腺激素释放激素(GnRH)ELISA试剂盒(酶免生物公司,批号:MM-0506M2);小鼠雄激素(T)ELISA试剂盒(研谨生物公司,批号:F07944)。
Aβ寡聚体准备:将Aβ1~42单体用DMSO溶解,制成3 mmol/mL的原溶液,并在PBS中稀释10倍(300 μmol/mL Aβ1~42,90%PBS,10% DMSO)。将Aβ1~42单体溶液在37 ℃下孵育24 h以促进Aβ1~42寡聚体的形成,然后分装并在-80 ℃下冷冻备用。
1.3 主要仪器 Morris水迷宫视频分析系统(上海欣软科技有限公司,型号:SuperMaze V2.0);小鼠脑立体定位仪(成都仪器厂,型号:STW-3);微量进样器(上海高鸽工贸有限公司,规格:10 μL);RM2235型轮转式组织切片机(德国徕卡公司);生物显微镜(日本Nikon公司,型号:E100);ELISA酶标仪(美国伯腾仪器有限公司,商品号:800TS,序列号:180106A)。
1.4 造模与分组
1.4.1 小鼠晚发型AD模型制作 (1)单侧性腺(睾丸)摘除:1%戊巴比妥钠(50 mg/kg)麻醉小鼠。碘伏消毒阴囊后,用眼科剪刀在一个阴囊的最下部剪出一个约5 mm的切口。按压小鼠的腹部,使睾丸从阴囊切口处突出来。用镊子夹住睾丸腹膜,将其撕开,并将睾丸拉出。用镊子夹住精索,用“切刀型”电烙铁进行切割和烧灼。在切口处撒上青霉素钠粉。将精索推入阴囊。闭合阴囊切口,不缝合。若小鼠术后出现活动量减少,体质量减轻,饮水及进食量减少,体毛无光泽、发黄及稀疏,喜扎堆蜷缩拱背等现象,即证明造模成功[19]。(2)双侧海马齿状回Aβ1~42寡聚体注射:单侧性腺切除术7 d后,将小鼠麻醉,剪掉小鼠头部的毛发并固定在脑立体仪的耳杆上。向双眼滴无菌PBS,以防止角膜干燥。用碘伏消毒头部皮肤,用眼科剪刀在头部中间切开一个1 cm的切口。眼睑开口器撑开切口,定位前囟,在前囟门后方2.0 mm、侧方1.4 mm处做标记。用7号针头缓慢钻孔。用双侧微量注射器吸取Aβ1~42寡聚体后固定在脑立体仪上,从钻孔处插入2.5 mm,到达海马齿状回。以0.2 μL/min的速度,将Aβ1~42同时注入两侧海马,每侧脑海马齿状回内注射300 μmol/mL的Aβ1~42寡聚体1 μL,持续5 min,然后将针留在原位5 min,以帮助Aβ1~42的扩散。退出注射针,缝合切口[20]。造模后进行6 d的水迷宫行为学检测,然后取材,脑组织石蜡切片行HE染色,若出现小鼠学习能力明显受损[21],且脑组织海马齿状回HE染色表现为海马锥体细胞带排列紊乱、变稀、中断,许多细胞体积缩小,胞核固缩,染色加深等[22],即证明造模成功。本实验已通过多次预实验,确定模型的可靠性,然后固定相关实验条件,造模给药后,应用水迷宫检测行为学差异。
1.4.2 动物分组 将50只ICR小鼠随机分为假手术组、晚发型AD模型组、苁蓉散低剂量组、苁蓉散高剂量组及氟他胺组,每组10只。实验周期为15 d,小鼠在实验周期第1天实施性腺摘除术。除假手术组小鼠外,其他各组均进行单侧性腺(睾丸)摘除。假手术组小鼠只在阴囊做切口。在实验周期第8天进行海马齿状回内注射,假手术组小鼠注射无菌生理盐水,其余各组均注射Aβ1~42寡聚体,各实验组小鼠注射溶液体积相等。在实验第10~15天各组小鼠进行Morris水迷宫实验。小鼠在实验期间,每天均给予灌胃处理,苁蓉散低、高剂量组小鼠分别灌胃低、高剂量的苁蓉散溶液,氟他胺组小鼠同时灌胃高剂量苁蓉散溶液和氟他胺溶液;假手术组、晚发型AD模型组灌胃等体积的生理盐水。
1.5 实验给药 预实验中设置了3个剂量组,即等效剂量、2倍等效剂量、4倍等效剂量,但在实验过程中发现4倍等效剂量组小鼠死亡率较高,死亡的小鼠腹部胀大,经解剖发现小鼠肠道蠕动障碍均出现显著膨胀。可能原因是高剂量远志产生肠毒性[23-24]。因此将4倍等效剂量组剔除。除4倍等效剂量组外,其余组间小鼠死亡率比较,差异无统计学意义(P>0.05)。
苁蓉散及氟他胺的给药剂量按照《药理实验方法学》[25]中人和动物间体表面积折算的等效剂量比值,小鼠给药剂量=人的临床剂量×0.002 6,换算得出的小鼠给药剂量作为低剂量组小鼠给药量,其2倍剂量作为高剂量组小鼠的给药量。苁蓉散低、高剂量组小鼠灌胃剂量分别为5.2、10.4 g/(kg·d),氟他胺组灌胃剂量为65 mg/(kg·d)。假手术组和晚发型AD模型组小鼠给予等体积生理盐水,1次/d,连续给药15 d。
1.6 观察指标
1.6.1 小鼠认知功能 采用Morris水迷宫实验评估小鼠海马体依赖性空间学习记忆能力。Morris水迷宫包括一个黑色的圆形水池(直径120 cm,高40 cm),注入一定量的水,水温设置26 ℃,水池被分为4个象限(第一象限、第二象限、第三象限和第四象限)。(1)定位航行实验:在迷宫第一象限中放置一个平台(直径10 cm),并将平台浸没在水面下1 cm。实验连续5 d,平台位置不变,每天训练4次,每次从4个固定位置下水,每次训练60 s,如果在60 s内没有找到平台,则引导小鼠到平台上停留15 s。记录并分析每天找到平台的逃离潜伏期,以评估小鼠的学习能力。(2)空间搜索实验:定位航行实验结束后移除平台,进行60 s的搜索实验,各组小鼠下水位置相同。记录并分析小鼠穿越平台区域的次数和在每个象限的游泳时间,以评价小鼠的记忆能力。
1.6.2 血清和脑组织收集 在完成Morris水迷宫实验后对小鼠进行深度麻醉(1%戊巴比妥钠,150 mg/kg),然后收集左心室血液和脑组织。将血液在室温下静置30 min,并在4 ℃下以3 500 r/min离心15 min(离心半径为48 mm)。取血清进行性腺轴相关激素含量测试。将取出的小鼠大脑切成左右两半,在4 ℃的4%多聚甲醛(PFA)PBS溶液中浸泡24 h。
1.6.3 小鼠海马区组织形态 将多聚甲醛固定的脑组织按常规方法经流水冲洗、梯度乙醇脱水、二甲苯透明、石蜡包埋后制成蜡块。将蜡块切至Aβ1~42注射的位置,即距大脑中线1.4 mm处,保留切片,切片厚度为5 μm。切片经烘烤干燥后,经二甲苯、梯度乙醇脱蜡至水,苏木精、伊红染色,再经乙醇脱水、二甲苯透明、中性树胶封片后,在光镜下观察并拍照。以切片中海马齿状回(DG)区颗粒细胞层损伤长度为直径,计算出Aβ对颗粒细胞层的损伤面积。
1.6.4 血清雄激素、促性腺激素释放激素(GnRH)水平 将性腺轴相关激素ELISA试剂盒从冰箱中取出,在室温下平衡20 min。严格按照试剂盒说明书的步骤,测定标准品和血清样品中雄激素及GnRH的光密度(OD)值。以标准品的浓度为横坐标,以相应的OD值为纵坐标,绘制标准品的线性回归曲线,并根据曲线方程计算血清雄激素、GnRH水平。
1.7 统计学方法 应用IBM SPSS 27.0软件,计量资料以“均数±标准差”(±s)表示。多组数据差异性检验用单因素方差分析,组间两两比较应用LSD-t检验,以P<0.05为差异有统计学意义。本研究将实验过程中死亡、在行为学实验中游泳状态不佳及未表现出逃离欲望的小鼠剔除,在各项实验结果中不纳入统计范围。
2 结 果
2.1 各组小鼠学习记忆能力比较 定位航行实验中,在训练的第5天,晚发型AD模型组小鼠逃离潜伏期长于假手术组(P<0.01);苁蓉散低、高剂量组小鼠逃离潜伏期短于晚发型AD模型组(P<0.05或P<0.01);氟他胺组小鼠逃离潜伏期长于苁蓉散高剂量组(P<0.05)。(见表1)
表1 各组小鼠Morris 水迷宫实验结果比较 (±s)
注:与假手术组比较,aP<0.01;与晚发型AD模型组比较,bP<0.05,cP<0.01;与苁蓉散高剂量组比较,dP<0.05。
定位航行实验 空间搜索实验逃离潜伏期/s 穿越平台区次数/次 第一象限游泳时间百分比/%假手术组 8 21.70±5.38 6.86±1.51 35.15±10.42晚发型AD模型组 7 39.62±5.37a 1.74±1.25a 22.78±6.99a苁蓉散低剂量组 7 27.10±4.36b 3.86±1.35 29.76±7.32苁蓉散高剂量组 7 23.90±5.97c 4.86±2.36c 36.54±7.65c氟他胺组 7 31.98±6.84d 2.63±1.72d 27.42±7.22d F 5.291 4.805 3.638 P 0.002 0.004 0.015组别 n
空间搜索实验中,晚发型AD模型组小鼠穿越平台区次数及在第一象限游泳时间百分比低于假手术组(P<0.01);苁蓉散高剂量组小鼠的穿越平台区次数及在第一象限游泳时间百分比高于晚发型AD模型组(P<0.01);氟他胺组小鼠的穿越平台区次数及在第一象限游泳时间百分比低于苁蓉散高剂量组(P<0.05);苁蓉散低剂量组小鼠穿越平台区次数及在第一象限游泳时间百分比与晚发型AD组比较,差异无统计学意义(P>0.05)。(见表1)提示苁蓉散的干预作用具有剂量依赖性。
2.2 各组小鼠脑损伤比较 假手术组小鼠DG区神经元(颗粒细胞)结构形态正常;晚发型AD模型组小鼠DG区颗粒细胞层断裂,大量神经元丢失;苁蓉散低、高剂量组小鼠DG区可见颗粒细胞层断裂程度减轻,且呈剂量依赖性;氟他胺组小鼠颗粒细胞层损伤程度较苁蓉散高剂量组严重。(见图1)

图1 各组小鼠DG 区颗粒细胞层损伤情况 (HE,×100)
与假手术组比较,晚发型AD模型组小鼠DG区注射位置颗粒细胞层断裂、大量颗粒细胞丢失,且损伤面积大于假手术组(P<0.01);苁蓉散低、高剂量组颗粒细胞层损伤面积明显小于晚发型AD模型组(P<0.01);氟他胺组小鼠颗粒细胞层损伤面积明显大于苁蓉散高剂量组(P<0.01)。(见表2)
表2 各组小鼠DG 区颗粒细胞层损伤面积比较 (±s)

表2 各组小鼠DG 区颗粒细胞层损伤面积比较 (±s)
注:与假手术组比较,aP<0.01;与晚发型AD模型组比较,bP<0.01;与苁蓉散高剂量组比较,cP<0.01。
组别 n 脑海马齿状回区颗粒细胞层损伤面积/μm2假手术组 8 0.00±0.00晚发型AD模型组 7 91 245.05±14 138.70a苁蓉散低剂量组 7 71 744.35±11 389.86b苁蓉散高剂量组 7 59 814.32±11 428.98b氟他胺组 7 78 231.14±10 052.59c F 89.398 P 0.000
2.3 各组小鼠血清雄激素、GnRH水平比较 晚发型AD模型组小鼠血清雄激素、GnRH水平低于假手术组(P<0.01);苁蓉散低、高剂量组小鼠血清雄激素、GnRH水平高于晚发型AD模型组,差异均有统计学意义(P<0.01);氟他胺组小鼠血清雄激素、GnRH水平与苁蓉散高剂量比较,差异无统计学意义(P>0.05)。(见表3)
表3 各组小鼠血清雄激素、GnRH 水平比较 (±s)
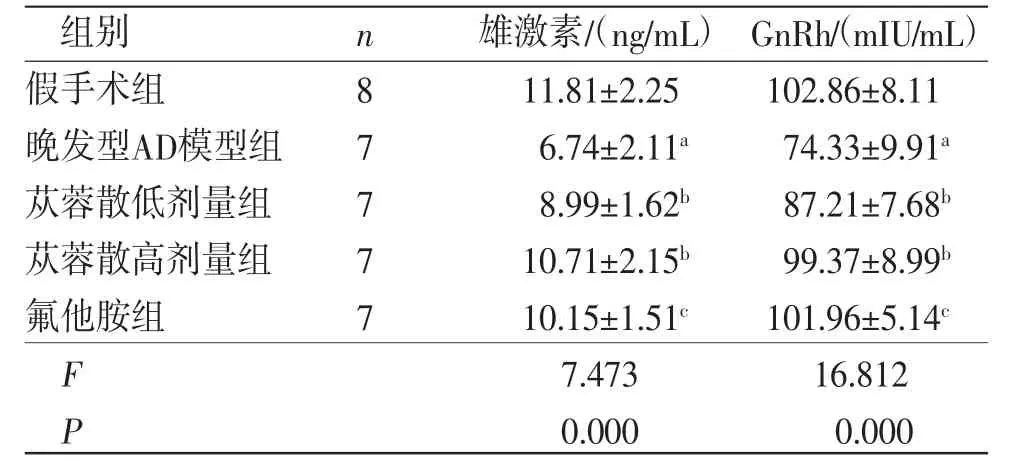
表3 各组小鼠血清雄激素、GnRH 水平比较 (±s)
注:与假手术组比较,aP<0.01;与晚发型AD模型组比较,bP<0.01;与苁蓉散高剂量组比较,cP>0.05。
组别 n 雄激素/(ng/mL) GnRh/(mIU/mL)假手术组 8 11.81±2.25 102.86±8.11晚发型AD模型组 7 6.74±2.11a 74.33±9.91a苁蓉散低剂量组 7 8.99±1.62b 87.21±7.68b苁蓉散高剂量组 7 10.71±2.15b 99.37±8.99b氟他胺组 7 10.15±1.51c 101.96±5.14c F 7.473 16.812 P 0.000 0.000
3 讨 论
复制接近晚发型AD行为学及病理生理学特点(性腺轴完整、性激素下降、Aβ代谢障碍及神经元丢失等)的动物模型对AD的早期预防和治疗等研究具有重要价值。在以往的AD模型中,多数研究忽略了老年AD性激素缺乏的生理特征。因此,在性激素水平正常的AD模型动物中研究神经元再生、抗神经元凋亡和抗炎作用,可能会因为自身性激素的神经保护作用而出现假阳性。此外,海马齿状回-CA3系统在记忆的编码、储存和检索中起着核心作用[15]。齿状回是哺乳动物大脑中仅有的两个存在神经元再生的区域之一[16],动物海马齿状回内的Aβ1~42浸润是模拟AD快速而有效的方法。因此本研究通过雄性小鼠单侧睾丸切除术结合双侧海马齿状回Aβ1~42注射建立晚发型AD小鼠模型。结果发现小鼠经单侧睾丸摘除、齿状回注射Aβ1~42后,性激素水平下降,海马区颗粒细胞大量丢失,同时学习和记忆能力显著下降,说明小鼠的行为学变化、组织形态学变化及HPGA功能变化符合晚发型AD的特点。
中医学认为晚发型AD属“健忘”“痴呆”“呆病”等范畴。其发病与“痰”密切相关,如《石室秘录》曰“治呆无奇法,治痰即治呆也。然而痰势最盛,呆气最深”。年老体虚,脾肾功能不足。脾失健运,肾虚不能主水,导致水湿内停,湿聚成痰,随气机升降蒙蔽清窍。“痰迷心窍,则遇事多忘”(《名医指掌》),即出现健忘、痴呆等神明失用表现。再者肾藏志,主骨生髓通于脑。肾虚则脑髓失养、失聪,亦可导致健忘、痴呆。老年期认知障碍的致病因素主要为痰,且与脾、肾、心功能失调密切相关,因此治疗原则需包括补肾、健脾、开心窍及祛痰以标本兼治。苁蓉散中肉苁蓉、续断温补肾阳,充养脑髓;茯苓健脾渗湿,宁心安神;石菖蒲、远志祛痰开窍,交通心肾。诸药合用,共奏温肾助阳、宁心安神、豁痰开窍之功。苁蓉散的功用与老年期认知障碍的治法一致。
本研究中在苁蓉散干预后,晚发AD模型小鼠血清GnRH及雄激素水平明显升高,海马区颗粒细胞损伤面积缩小,学习和记忆能力改善,并且干预作用呈现剂量依赖性。苁蓉散能改善晚发型AD模型小鼠的学习和记忆能力,同时具有增强HPG轴功能及神经保护作用。该结果为“苁蓉散,久服至老不忘”的论述提供了实验基础。为进一步探究苁蓉散的作用机制,本研究应用雄激素受体拮抗剂氟他胺干预。结果发现氟他胺能在一定程度上阻断苁蓉散对晚发型AD模型小鼠认知功能、海马区组织形态的改善作用。说明雄激素是苁蓉散脑保护及改善认知功能作用的重要执行者。由此推断苁蓉散可通过增强HPG轴功能,提高血清雄激素浓度,从而抵抗Aβ1~42的神经毒性作用。
4 结 论
单侧性腺切除术结合双侧海马齿状回Aβ1~42注射能有效复制晚发型AD认知功能下降、海马神经元丢失及HPG轴功能下降的行为学及病理生理学特点。苁蓉散改善晚发型AD认知障碍的作用机制可能为增强HPG轴功能,提高血清雄激素水平,进而减少Aβ1~42诱导的神经元丢失。
