通过CD20单抗打破小鼠HBV免疫耐受研究Bregs细胞在慢性乙型肝炎中的作用
2023-11-03刘中天张嘉静林涛发舒丹王少扬
刘中天 张嘉静 林涛发 舒丹 王少扬
在感染、炎症和自身免疫性疾病中B细胞可以通过呈递抗原和分泌细胞因子来调节免疫反应,即便抗原低浓度下仍能精准识别并呈递[1]。HBcAg特异性B细胞能在慢性乙型肝炎(CHB)患者体内持续产生抗-HBc,而抗-HBc的存在又能破坏肝脏细胞活性和影响HBV的清除,说明同样是特异性B细胞产生抗体,却能出现不同的结果[2]。接种疫苗的人群可在体内产生保护性抗体,抗体能阻断HBV的感染和复制,推断当B细胞功能障碍会引起体内HBsAg的持续存在和复制。临床治疗中发现使用针对B细胞增生为主的利妥昔单克隆抗体治疗淋巴瘤时,如果不同时采取抗病毒措施将会引起HBV再激活甚至引起暴发性肝炎,极易进展为肝功能衰竭[3]。
调节性B细胞(regulatory B cell,Bregs)可以通过产生IL-10细胞因子,负性调控其他免疫细胞同时对效应B细胞也产生抑制作用,能下调炎症级联反应。Bregs细胞主要产生IL-10、IL-35和转化生长因子-β(TGF-β),被认为是先于Tregs细胞发挥免疫作用的细胞[4]。Bregs细胞在系统性红斑狼疮、类风湿性关节炎、多发性硬化症、艾滋病和丙型肝炎中的作用已有较多研究,但对乙型肝炎的作用鲜见报道。本研究探讨Bregs细胞在CHB发病机制中的作用。
材料与方法
一、实验材料
实验动物为6~8周雄性C57BL/6小鼠20只,饲养于联勤保障部队第900医院动物实验中心,符合清洁级饲养条件。入组前均排除相关病毒感染、艾滋病、先天性免疫缺陷障碍等。研究方案经过联勤保障部队第900医院医学伦理委员会批准。
目前已知小鼠和人类都高表达CD1d+和CD19,在另外一种超敏模型中发现表面标志物为CD1d+CD5的B细胞能产生IL-10,抑制超敏反应过程[5, 6]。多种标志物组合检测能提高检测成功率,因此拟用anti-mouse CD1d+、CD5、CD19标志物作为检测指标。
二、实验方法
将p AAV/HBV 1.2质粒溶于无菌生理盐水中,通过尾静脉注射含质粒的盐水,注射体积为小鼠质量的8%~10%,构建小鼠HBV感染模型。
将20只小鼠随机分为实验组和对照组各10只。实验组小鼠尾静脉注射CD20利妥昔单抗(Rituximab),对照组小鼠给予同剂量盐水。比较两组小鼠的肝功能、凝血功能、HBV DNA、Bregs细胞和IL-10。
Bregs细胞及IL-10分子水平检测:分离脾脏、外周血、肝脏淋巴细胞,按说明书加入 anti-mouse CD1d+、CD5、CD19进行细胞表面及胞内因子染色,流式细胞仪检测2组Bregs细胞比例。以前向散射角和侧向散射角为坐标设门识别肝脏、脾脏以及外周血淋巴细胞,对CD1d+细胞进行设门,分析CD5+和CD19+Bregs细胞在脏器的分布比例。
三、统计学分析
采用SPSS 26.0 软件进行统计学分析。偏态分布的计量资料以M(P25,P75)表示,比较采用Mann-WhitneyU检验,双变量相关分析采用Spearman相关系数检验。P<0.05为差异有统计学意义。
结 果
一、实验组与对照组小鼠血清学比较
实验组和对照组小鼠HBV DNA比较差异无统计学意义(P>0.05)。实验组小鼠的ALT和AST均高于对照组,而血清IL-10水平低于对照组,差异有统计学意义(P<0.05)。见表1。打破免疫耐受后,实验组小鼠体内IL-10水平和ALT、AST水平呈负相关(r=-0.66、-0.65,均P<0.05)。

表1 实验组与对照组ALT、AST以及IL-10水平比较[M(P25, P75)]
二、实验组与对照组小鼠凝血功能比较
实验组凝血酶原时间(PT)低于对照组,而纤维蛋白原(FIB)水平高于对照组,差异有统计学意义(P<0.05);活化部分凝血酶原时间、凝血酶时间差异无统计学意义(均P>0.05),见表2。
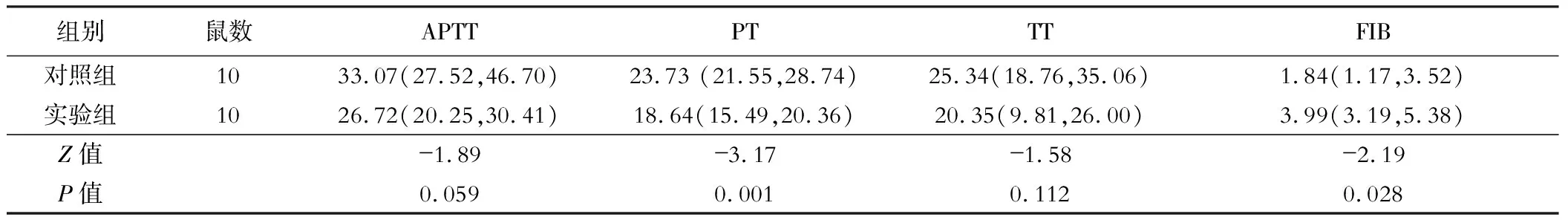
表2 两组小鼠凝血功能比较[M(P25, P75)]
三、实验组与对照组小鼠Bregs细胞在不同器官中的分布
实验组肝脏脾脏、外周血Bregs细胞比例均低于对照组,差异有统计学意义(P<0.05);见表3。实验组肝脏、脾脏、外周血Bregs细胞和IL-10因子行相关性分析,发现Bregs细胞与IL-10呈正相关(r=0.73、0.74、0.71,均P<0.05)。

表3 实验组与对照组小鼠Bregs细胞在不同器官中的比例[%,M(P25,P75)]
讨 论
本研究发现,随着小鼠HBV感染免疫耐受的破坏,在第7天时出现了肝功能破坏,实验组小鼠肝脏、脾脏、外周血Bregs细胞与对照组相比有明显的下降,与IL-10存在明显相关性,随着Bregs细胞的破坏,IL-10的水平也降低。Bregs细胞的功能和数量的下降,伴随着肝脏炎症活动的增加。
通过研究打破HBV感染免疫耐受小鼠模型,充分证明在慢性乙型肝炎免疫状态的激活过程中存在Bregs细胞的数量以及功能的变化,提示Bregs细胞对慢性乙型肝炎的炎症活动和控制以及病情的进展有主要作用。而在打破免疫耐受过程中没有发现HBV DNA的变化,提示乙型肝炎通过免疫途径清除病毒是多方面的,可能包括T细胞、B细胞、NK细胞的参与,以及与γ-IFN、IL-2等多个细胞因子网络控制。
Bregs细胞在自身免疫性疾病、感染性疾病、预防肿瘤相关生长、抑制免疫移植耐受中能通过分泌细胞因子抑制体内过度的炎症反应,对Tregs细胞、CD4+、CD8+T细胞、DC细胞水平以及Th1/Th2的比例产生影响,且Bregs细胞数量的增减或功能强弱的变化都能导致疾病向不同的方向发展,尤其体现在后期的病情恢复的快慢,但Bregs细胞的表面标志物、参与激活的信号通路、细胞的分化状态和不同的作用机制在HBV感染中并不明确[7]。
Bregs细胞在体内的变化能影响炎症,可能与体内细菌和(或)病毒的负荷有关,将Bregs细胞过继转移到重症免疫缺陷的炎症性肠病的小鼠模型中后,发现能减轻炎症程度[8]。Liu等[9]建立的自身免疫性肝炎的小鼠模型发现缺乏Bregs细胞后增加了EAH严重性。Gutiérrez等[10]在对HIV患者的研究中发现,未接受治疗的新发患者Bregs(CD24hiCD38hi)或CD19+Tim-1+与Tregs呈正相关,而CD19+CD24hiCD27+或CD19+PD-L1+等Bregs亚群并没有表现出相关性,可能是由于患者之间免疫系统的不同或对Bregs细胞表型的影响。
Bregs细胞通过多种途径来发挥免疫抑制功能,除了分泌IL-10,还有IL-35和TGF-β等细胞因子,或者能通过细胞间的接触传递信号,调节Tregs细胞的分化,降低炎症因子的释放和减弱致病原T细胞的反应[11]。不同组织来源的Bregs细胞收到诱导的信号不同,如在淋巴细胞中的信号是促炎细胞因子或已被激活的CD4+T细胞,而有研究指出脂肪趋化因子和代谢组织中的特异性信号,如CXCL12和游离脂肪酸在脂肪细胞中的重要作用之一就是能促进Bregs的分泌功能[12, 13]。
本实验发现IL-10的水平与Bregs细胞的数量和功能存在明显的相关性,提示在乙型肝炎的免疫发病机制中,Bregs细胞通过分泌IL-10可能是发挥功能的重要途径。近年来对Bregs细胞分泌IL-35以及Bregs细胞是否和其他免疫细胞通过细胞间的接触而发挥作用,还需要进一步观察。
利益冲突声明:所有作者均声明不存在利益冲突。