不同产地生姜中姜酚类含量及最佳配比研究
2023-11-03董文南万敏李克招袁惠
董文南,万敏,李克招,袁惠
1.江西省药品检验检测研究院,国家药品监督管理局中成药质量评价重点实验室,江西省药品与医疗器械质量工程技术研究中心,江西 南昌 330029;2 江西省医疗器械检测中心,江西 南昌 330029
生姜(Zingiber officinaleRosc.)为姜科姜属的多年生草本植物的新鲜根茎,最早起源于春秋时期,首载于《金匮要略》,张仲景的《伤寒杂病论》记载的方剂中用到生姜的就有75 首[1]。我国是世界上生姜总产量最多的国家,地方品种繁多[2]。据统计,全世界生姜共有约80 个属,而中国就占据了其中14 个,分布于我国的中部、东南部到西南部。生姜是我国传统中药,历史悠久,应用广泛。现代研究表明,生姜具有止吐[3]、抗肿瘤[4-5]、抗糖尿病[6]、治疗心脑血管疾病[7]等药理活性。
不同产地的生姜中的功能性成分姜酚含量差异较大,不少文献将姜酚作为评价生姜的质量指标[8-9]。2020 年版《中国药典》规定生姜中6-姜辣素含量不得低于0.05%,8-姜酚和10-姜酚总量不得低于0.04%。本研究收集了30 个不同产地的生姜,用优选的姜酚制备工艺处理得到姜酚提取物,分别测定6-姜辣素、8-姜酚、10-姜酚的含量及含量配比,运用成熟的宫颈癌Hela 细胞作为体外筛选模型,根据肿瘤细胞抑制率IC50值优选姜酚提取物中各成分的比例。
1 仪器与材料
1.1 仪器
MS205DU 型电子天平(梅特勒-托利多公司);LC-20ADXR 型高效液相色谱(日本岛津公司);SW-CJ-2D 型超净工作台(上海鼎科科学仪器公司);QP-80 型二氧化碳培养箱(济南鑫贝西生物技术有限公司);SN-LSC-40S 型离心机(上海尚普仪器设备有限公司);ELI0A 型酶标仪(BIOBASE公司)等。
1.2 材料
生姜(经江西省药品检验检测研究院的万林春主任中药师鉴定为姜科植物姜Zingiber officinaleRosc.的新鲜根茎);6-姜酚对照品(批号:SLCG1228,购自Sigma 公司);Hela 细胞系[RPMI Medium 1640(含双抗),索莱宝:31800-500 mL];FBS 缓冲液(ABW:AB-FBS0500);胰蛋白酶-EDTA 消化液(0.25%)不含酚红(索莱宝:T1300);1×PBS 缓冲液(pH7.2~7.4,索莱宝:P1020);CCK-8 试剂盒(细胞增殖及毒性检测试剂盒,索莱宝:CA1210);二甲基亚砜(DMSO,细胞培养级,索莱宝:D8371);5-氟尿嘧啶(美仑:MB1273-1);96 孔细胞培养板(labselect:11512)。
2 方法与结果
2.1 姜酚的含量测定
2.1.1 色谱条件色谱柱:OSAKA SODA CAPCELL PAK C18 柱(250 mm×4.6 mm,5 μm);流动相:乙腈(A)-0.1%甲酸溶液(B),梯度洗脱(0~10 min,45% A;10~15 min,45% →48% A;15~17 min,48% →60%A;17~43 min,60% A;43~45 min,60% →67% A;45~48 min,67%→69% A;48~58 min,69%→71% A);检测波长:282 nm;流速:0.5 mL/min ;柱温:25 ℃ ;进样量:15 μL。
2.1.2 对照品溶液制备精密称取6-姜辣素对照品,加甲醇溶解,制成质量浓度为102.4 μg/mL 的对照品溶液。
2.1.3 供试品溶液制备取绞碎的生姜50 g,精密称定,加10 倍量75%乙醇浸泡0.5 h,回流提取1.0 h,滤过,备用。药渣再加5 倍量的75%乙醇,回流提取1.0 h,滤过,合并滤液,50 ℃减压回收乙醇至无醇味,加水稀释至0.5 g/mL,备用。
量取预先处理好的XAD 7HP 型大孔吸附树脂10 mL,进行湿法装柱,将上述稀释液缓慢上样,以2~3BV 的体积流量通过树脂柱;分别用水4BV(40 mL)和40%乙醇4BV(40 mL)洗涤除杂,弃去洗液;再用6BV 的75%乙醇,以2~3BV 的体积流量进行洗脱,收集洗脱液,50~60 ℃减压回收乙醇至无醇味(至5~10 mL),加水稀释至50 mL(1 g 生药/mL),并加入同等体积的乙酸乙酯进行萃取,振摇10 min,静置30 min,取有机相离心,分取澄清有机相,减压浓缩至干,用适量甲醇分次洗涤残渣,洗涤液转移至50 mL 量瓶中,用甲醇定容至刻度,摇匀,备用。精密量取上述甲醇溶液1 mL,置于10 mL 量瓶中,加甲醇定容至刻度,即得供试品溶液。不同产地的30 个批次生姜同法操作。
2.1.4 姜酚的测定方法参照2020 年版《中国药典》,吸取供试品溶液按“2.1.1”项下色谱条件测定生姜中6-姜辣素的含量,利用校正因子分别计算8-姜酚、10-姜酚含量。
2.2 抗肿瘤体外药物筛选试验
2.2.1 体外试验样品制备从“2.1.3”项下的30 个批次的甲醇定容的总姜酚溶液中分别取1 mL 母液,挥干甲醇溶剂,加入20 μL DMSO 溶解沉淀后加入对应体积的培养基至50、75、100、125、150 μM五种浓度,无菌过滤;阳性组为5-氟尿嘧啶用完全培养基配制成50 μM 浓度的溶液;对照孔为0.5%DMSO 溶液。
2.2.2 试验方法及计算(1)试验方法。CCK-8 试剂盒是MTT 法的最新的一种替代方法,用酶联免疫法在特定波长处测定其光吸收值,可间接反映其中存活的细胞数量,广泛应用于肿瘤抑制率和细胞增殖的快速高灵敏度检测。本试验使用胰酶消化Hela细胞,用完全培养基以每孔1×104个铺于96 孔板上,在二氧化碳培养箱中进行孵育,待细胞完全贴壁;弃去旧的培养基,添加含药物的培养基进行处理,培养48 h;弃上清,添加10% CCK-8 检测试剂,培养1~2 h 后用酶标仪检测。
(2)计算方法。细胞抑制率(%)=[(A 对照孔-A 实验孔)/(A 对照孔-A 空白孔)]×100%;A 空白孔:不含细胞和待测药物、只含CCK-8 的培养基的吸光度;A 对照组:含有细胞的培养基、CCK-8、没有待测药物、含0.5% DMSO 的吸光度;A 阳性实验组:含有细胞的培养基、CCK-8、5-氟尿嘧啶50 μM 浓度、含0.5% DMSO 的吸光度;A给药实验组:含有细胞的培养基、CCK-8、待测药物、含0.5% DMSO 的吸光度。
2.3 试验结果
运用优选的制备工艺(见“2.1.3”项下),分别测定不同产地30 个批次的总姜酚提取物溶液的6-姜辣素、8-姜酚、10-姜酚含量,并计算,有效成分含量配比=有效成分含量/(6-姜辣素、8-姜酚和10 姜酚含量之和)。从表1 结果可以看出,不同产地的6-姜辣素、8-姜酚、10-姜酚的含量和含量配比差异较大。
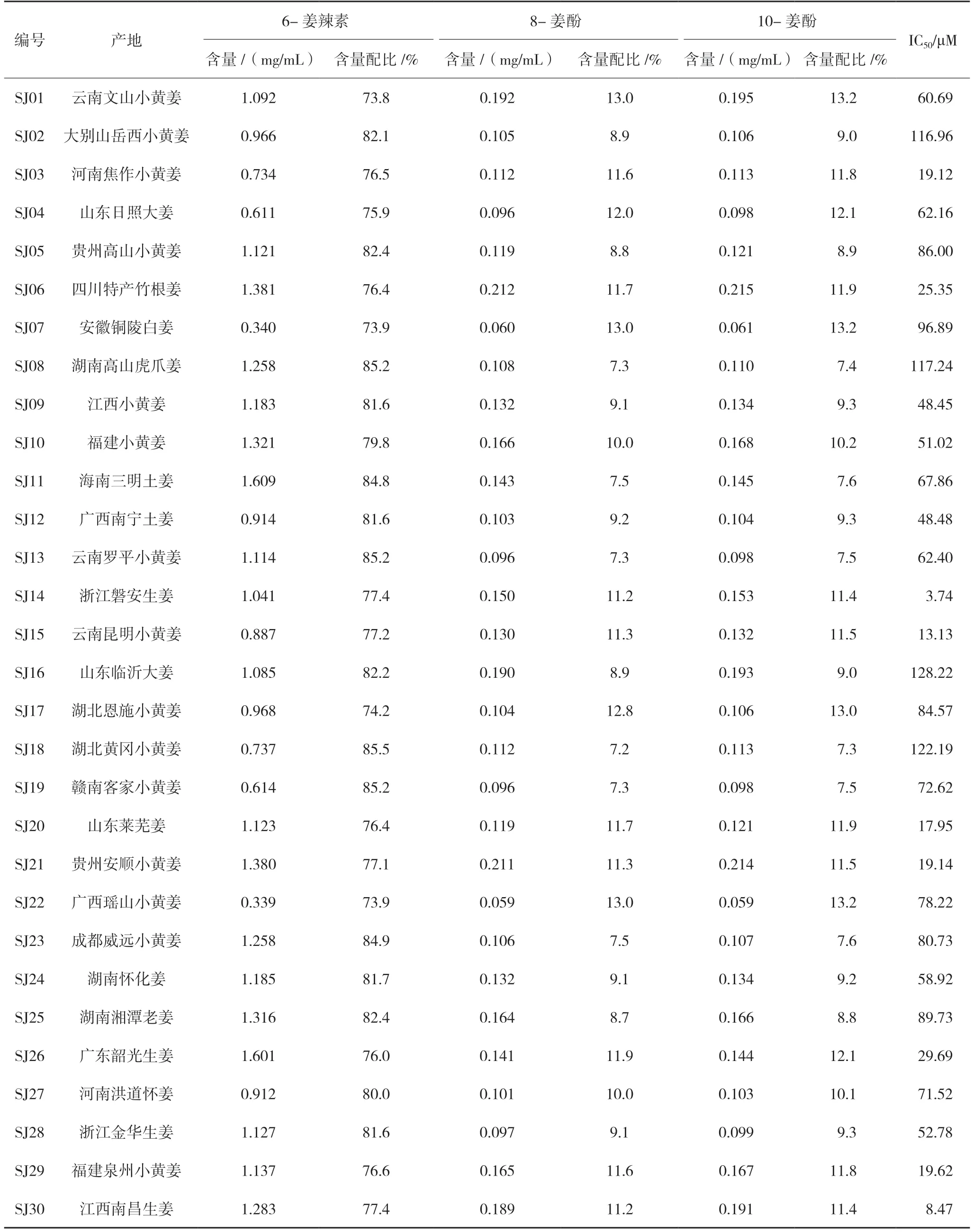
表1 不同产地生姜的6-姜辣素、8-姜酚、10-姜酚含量及对Hela细胞IC50值
运用成熟的宫颈癌Hela 细胞作为体外筛选模型,根据肿瘤细胞抑制率IC50值优选姜酚提取物中的6-姜辣素、8-姜酚、10-姜酚的比例。从表1 抑制率结果可以看出,空白组抑制率为0,对照组抑制率为-0.87%,阳性组抑制率为92.27%,实验组中三者比例6-姜辣素77%±0.5%(76.5%~77.5%),8-姜 酚11.5%±0.5%(11.0%~12.0%),10-姜 酚11.5%±0.5%(11.0%~12.0%)时,IC50小于20 μM,显示非常好的抗肿瘤活性,为最佳配比关系,为今后姜酚用于抗肿瘤研究确定提取物标准。
3 讨论
试验结果表明,不同产地的生姜经过优选的制备工艺提取后,制备所得的姜酚提取物中功能性成分6-姜辣素、8-姜酚、10-姜酚的含量差异较大,含量配比也有所不同。通过对30 个不同产地的姜酚提取物进行体外抗肿瘤细胞抑制率试验进行筛选,得到相应批次提取物的IC50值来判断抗肿瘤效果。最终发现产地浙江磐安、江西南昌的生姜IC50值最小,表明这两个产地的生姜具有较好地抑制宫颈癌Hela 细胞增殖的作用。通过研究不同产地30 个批次的总姜酚提取物中6-姜辣素、8-姜酚、10-姜酚不同量的配比及对宫颈癌Hela 细胞抑制率IC50值,确定6-姜辣素、8-姜酚、10-姜酚的比例范围为(76.5%~77.5%)∶(11.0%~12.0%)∶(11.0%~12.0%)时抗肿瘤活性最强。
近年来,越来越多的研究发现,中药发挥作用不仅仅依靠某一种单一的成分,有可能是结构相近的一组成分发挥协同增效作用[2]。6-姜辣素、8-姜酚、10-姜酚为结构相近的同系物,具有产生相同药理作用的官能团,与体内受体结合后,在体内进行吸收和转运,并产生相同药效[2]。通过体外肿瘤抑制率试验高通量快速筛选IC50值较低的所属产地的生姜,并明确6-姜辣素、8-姜酚、10-姜酚的天然配比,得到其最佳配比范围。为探讨中药中含有的一系列同系物具有相同药理作用提供了新思路,并为中药用于抗肿瘤研究确定提取物标准。
