从GEO数据库筛选结肠癌差异关键基因及验证
2023-10-31古同男孔祥照
鄢 雯,李 囡,古同男,孔祥照
首都医科大学 燕京医学院,北京 101300
结肠癌(colon cancer,CC)是消化系统常见的恶性肿瘤类型之一,占2013年所有肿瘤死亡人数的6%~8%,有高侵袭性、高转移性、高复发率的特点[1]。尽管目前CC的诊断和治疗取得了快速进展,但其临床治疗和预防仍存在局限性,其机制仍有待进一步探索。本研究利用生物信息学方法挖掘和分析结肠癌组织与癌旁组织的差异表达基因(differentially expressed genes,DEGs),筛选出参与结肠癌发展的核心基因,探究核心基因与CC患者生存率之间的关系,最后通过体外实验探讨预后相关基因对结肠癌细胞增殖的影响,预测其在肿瘤发生过程中的作用,可用于评估CC的预后风险,并提供潜在的治疗靶点。
1 材料与方法
1.1 材料
1.1.1 数据来源:从基因表达综合(gene expression omnibus,GEO)数据库(http://www.ncbi.nlm.nih.gov/geo)的GPL6104平台(Illumina humanRef-8 v2.0 expression beadchip)筛选出两套CC的基因表达数据集GSE74602和GSE10950。GSE74602数据集包含20个CC癌组织和20个正常结肠样本,GSE10950数据集包含24个癌组织和24个正常样本。
1.1.2 细胞系及试剂:人结肠癌细胞系SW480(北京泰科兰博科技有限公司);DMEM、RPMI 1640培养基、胎牛血清、CCK-8试剂、胰蛋白酶、Lipofectamine 3000 Transfection Reagent(北京索莱宝科技有限公司);利用Invitrogen BlockiT RNAi Designer软件设计针对CCNB1、CCNA2和CDC20的小干扰RNA(small interfering RNA,siRNA)(苏州吉玛基因股份有限公司);兔抗人CCNB1单克隆抗体、兔抗人CDC20单克隆抗体和兔抗人CCNA2单克隆抗体(CST公司);鼠抗人α-tubulin抗体(Santa Cruz生物科技公司);HRP标记的抗兔及抗鼠的二抗(北京中杉金桥生物科技公司);BCA 蛋白质定量试剂盒(上海碧云天生物技术有限公司)。
1.2 方法
1.2.1 差异表达基因的筛选:使用GEO2R(https://www.ncbi.nlmnih.gov/geo/geo2r/)在线分析数据集。以基因表达差异倍数(fold change,FC)的对数(|log2FC|)>1.5 和显著性P<0.05 为阈值筛选差异表达基因。利用韦恩图(http://bioinformatics.psb.ugent.be/webtools/Venn/)筛选共同的差异表达基因。
1.2.2 基于差异基因的蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络获取核心基因:PPI网络是研究细胞功能、疾病机制和药物设计的可行工具[2]。利用STRING数据库(https://string-db.org/)构建DEGs的PPI[3]。利用Cytoscape3.7.2软件构建可视化的PPI网络,PPI中的节点和边分别代表蛋白质以及蛋白质之间的相互作用。用Cytoscape的MCODE在线工具对PPI网络进行密集度分析,进一步筛选PPI网络最显著模块的中心节点基因,将其作为核心基因[4]。
1.2.3 功能富集分析:基因本体论(gene ontology,GO)从分子功能(molecular function,GO_MF)、生物过程(biological process,GO_BP)、细胞组分(cellular component,GO_CC)3个方面对基因及其产物的生物学意义进行分析[5]。用DAVID在线工具(http://david.ncifcrf.gov)对差异表达基因进行GO富集分析。通过使用京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)数据库筛选出差异基因富集的通路,分析差异基因的生物学功能[6]。
1.2.4 关键基因的生存分析:以基因表达水平中位数为界,将CC患者分为高表达组和低表达组,利用GEPIA(http://gepia.cancer-pku.cn/)绘制Kaplan-Meier生存曲线,明确核心基因对CC生存的影响,将与预后显著相关的核心基因视为关键基因[7-8]。
1.2.5 细胞的分组及处理:将SW480细胞置于含10%胎牛血清RPMI 1640培养基中培养,取对数增殖期细胞接种于6孔板,待细胞汇合度达80% 时,用干扰载体 si-CCNB1、si-CDC20、si-CCNA2转染细胞,用非特异性siRNA作阴性对照(si-NC),用空载体作空白对照(control)。
1.2.6 Western blot检测SW480细胞si-CCNB1、si-CDC20、si-CCNA2转染效率:转染48 h后,收集各组细胞,PBS清洗3次,加入含有PSMF的RIPA和蛋白酶抑制剂的细胞裂解液提取总蛋白质,用BCA法测定蛋白质含量。提取等量的蛋白质样品(40 μg),100 ℃ 变性5 min,用SDS-PAGE分离并转移至PVDF膜上。5%脱脂奶粉室温封闭2 h,加入一抗4 ℃孵育过夜;TBST洗涤后,加入二抗室温孵育1 h;TBST洗涤,加入发光液,采用凝胶成像仪曝光拍照。以GAPDH作为内参照,用Image J软件统计条带灰度值,目的蛋白质的表达水平用A目的蛋白质/AGAPDH的比值表示。
1.2.7 CCK8法检测结肠癌细胞增殖:将转染后细胞悬液浓度调整为2×107/L,接种于96孔板,每组设5个复孔,培养48 h。吸弃培养基,每孔加入10 μL CCK8检测液,37 ℃孵育4 h,置低速摇床上震荡10 min,使用酶标仪检测各孔细胞在450 nm处的吸光度值(A值)。细胞增值率=实验组A值/空白对照组A值×100%。
1.3 统计学分析
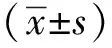
2 结果
2.1 差异表达基因分析
数据集GSE74602鉴定了606个差异表达基因(P<0.05,|logFC|>1.5)。数据集GSE10950选出2 559个差异表达基因(P<0.05,|logFC|>1.5)。使用韦恩图在线工具识别出515个共同的差异表达基因,其中292个基因表达下调和223个基因表达上调(表1,图1)。

表1 GEO数据库中2个数据集的统计
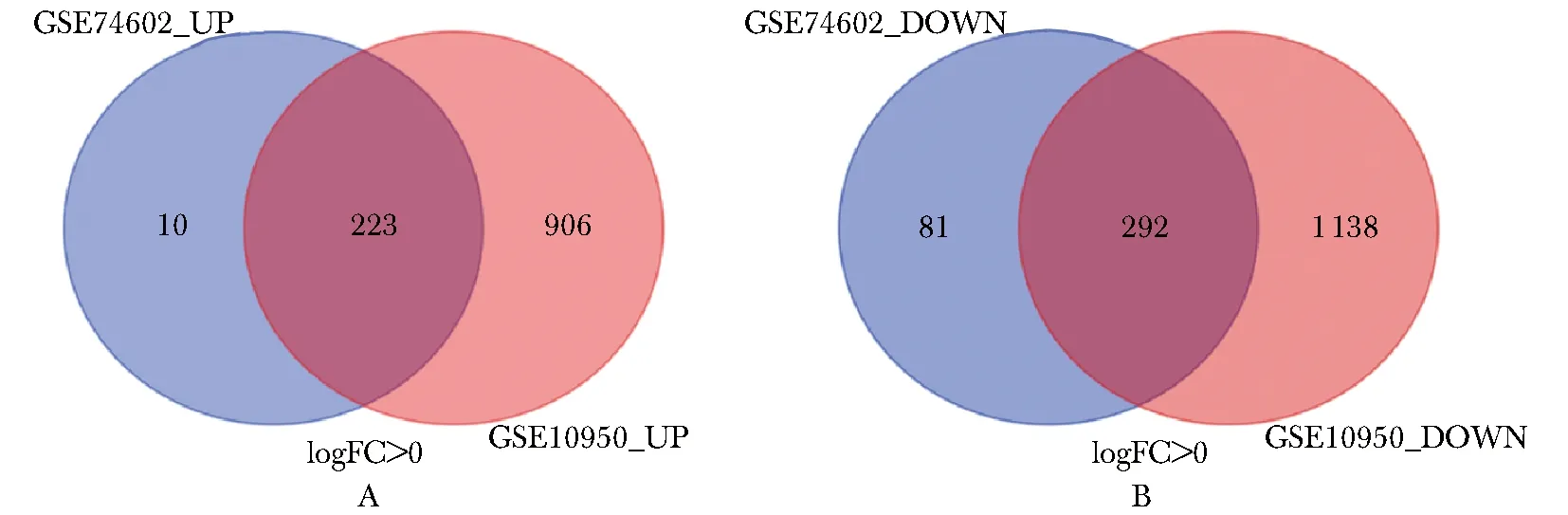
A.common up-regulated genes;B.common down-regulated genes
2.2 差异表达基因的GO富集分析及KEGG信号通路分析
在表达上调基因中,共有DEGs生物学过程主要与有丝分裂染色体凝结、凋亡过程负调控和转录正调控等有关;细胞组成主要富集于细胞质、核质和核仁中;分子功能主要富集于染色质结合、ATP结合等(表2)。

表2 差异表达基因(DEGs)的GO富集分析结果
根据KEGG途径富集分析,在表达上调基因中,有20个基因在细胞周期途径中富集,8个基因在DNA复制中富集,8个基因在孕酮介导的卵母细胞成熟中富集(表3)。
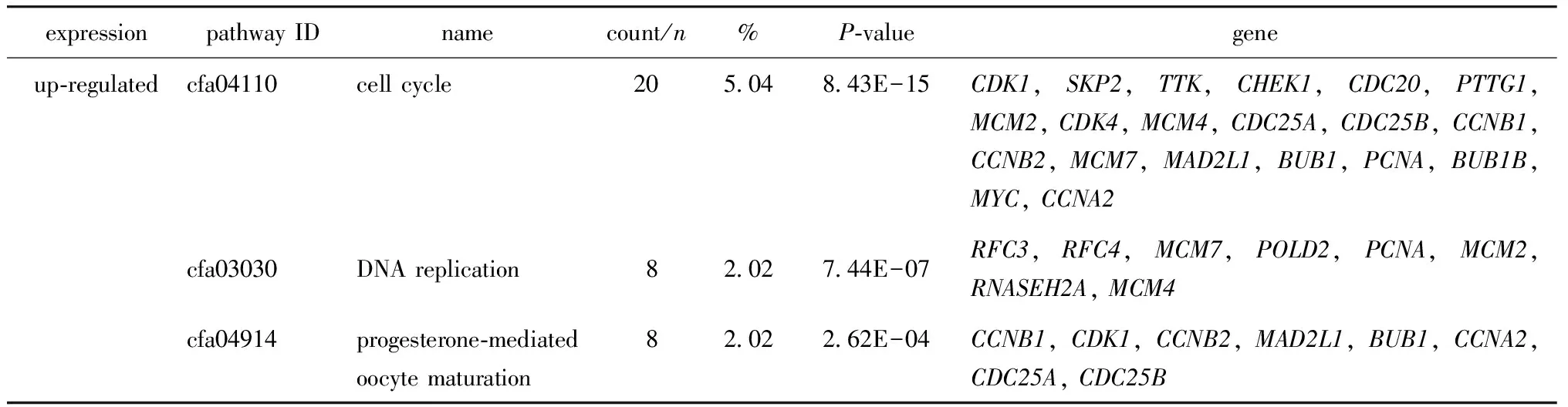
表3 差异表达基因(DEGs)的KEGG信号通路分析
2.3 PPI网络的构建和核心基因的选取
利用STRING v11.0构建了由170个基因节点和685条边组成的PPI网络,其中红色代表61个上调基因,绿色代表下调基因109个(图2A)。应用Cytotype MCODE 进行进一步分析,结果显示在170个节点中有33个关键基因均是上调基因(图2B)。

A.PPI network;B.33 hub genes.
2.4 核心基因的生存分析
33个核心基因中有7个关键基因与COAD的存活率有关(P<0.05)(图3A)。与正常对照组相比,COAD患者中7个基因的表达水平显著升高(P<0.05)(图3B)。

A.survivorship curve:B.mRNA expression of core genes between CC tumor(T) and normal control(N)people,red color means tumor tissues and grey color means normal tissues; *P<0.05 compared with control.
2.5 具有预后价值的关键基因的功能富集分析
通过David软件重新分析KEGG通路的富集,发现有3个基因(CCNB1、CDC20和CCNA2)在细胞周期通路中显著富集(P<0.001)(表4)。
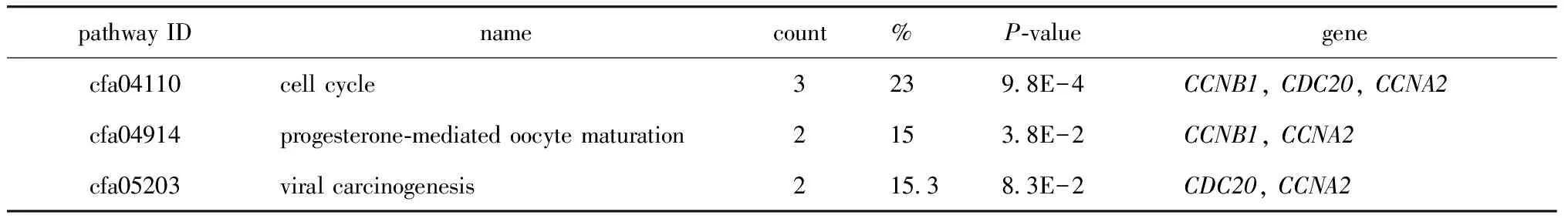
表4 7个关键基因的KEGG信号通路富集分析
2.6 转染siRNA抑制SW480细胞中CCNB1、CCNA2和CDC20的表达
Si-CCNB1组CCNB1蛋白相对表达量、si-CCNA2组CCNA2蛋白相对表达量、si-CDC20组CDC20蛋白相对表达量显著低于相应si-NC组(P<0.01)(图4)。

0.05 compared with si-NC.
与对照组和si-NC组相比,si-CCNB1,si-CCNA2和si-CDC20组72 h细胞增殖均明显降低(P<0.05)(图5)。
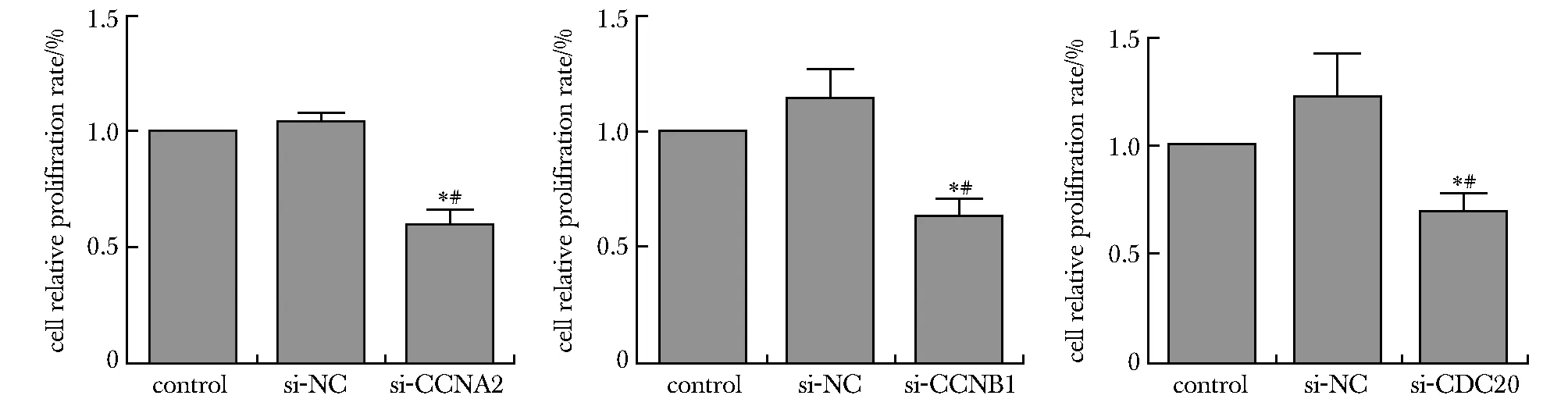
*P<0.05 compared with control; 0.05 compared with si-NC.
3 讨论
结直肠癌的发生发展是一个动态过程,在CC治疗期间,细胞周期通路的中断被认为是可以诱导凋亡细胞死亡的有利事件之一[9]。已有研究表明,细胞周期调节因子可以调节癌细胞中细胞周期的不同阶段,包括G0、G1、G2、S和M期[10]。伴随着研究的不断深入,CC的临床诊断和治疗获得明显的改善,但其预后仍然很差。因此,识别与CC相关的良好预后生物标志物是开发有效治疗方法的关键步骤。
本研究分析了来源于GEO的GSE74602和GSE10950数据集,共筛选出515个与CC有关的差异表达基因,其中表达上调223个,下调292个。进行PPI网络分析,以确定与结直肠癌临床特征相关的蛋白质-蛋白质相互作用和基因共表达模块。此外,还进行了功能和途径分析,以发现结直肠癌相关的生物过程和途径。通过对DEGs的GO分析和KEGG分析,对DEGs的PPI网络分析获取 核心(hub)基因,对核心基因进行生存分析和差异分析,得知CCNB1、CCNA2和CDC20在结肠癌中高表达,并在细胞周期通路中显著富集,对结肠癌患者的生存具有影响,利用人源结肠癌细胞系,降低肿瘤细胞内CCNB1、CCNA2和CDC20的表达,结果显示CCNB1、CCNA2和CDC20可以促进肿瘤细胞增殖、抑制凋亡,该生物信息学分析结论符合前期研究结果。前期研究显示[11-15]:CCNB1在包括胰腺癌、卵巢癌、原发性肝癌和胃癌在内的各种预后不良的癌类型中均有显著的过表达,主要表达于G2、M期,在G2、M(有丝分裂)过渡时控制细胞周期至关重要[11-12]。CCNA2通过激活参与S期调控的激酶,在控制细胞周期中发挥关键作用[13-14]。CDC20在胰腺癌、肺癌、膀胱癌和乳腺癌等多种低分化的肿瘤中高表达,并与这些肿瘤的不良预后有关[15]。这与本研究结论是一致的。
综上所述,CCNB1、CCNA2和CDC203个与信号通路有关的基因在CC组织中高表达,且表达量高者预后差,并与信号通路有关,CCNB1、CCNA2和CDC20有望成为CC的诊断分子标志物和治疗靶点。本研究结果存在一定局限性,仅从计算生物学方法的角度进行分析,但仍需更多实验研究进行验证。
