2023年诺贝尔生理学或医学奖简介
2023-10-31李静,章静波

2023年10月2日,诺贝尔奖委员会公布本年度诺贝尔生理学或医学奖授予科学家Katalin Karikó(卡塔琳·考里科)和Drew Weissman(德鲁·韦斯曼),以表彰他们在核苷碱基修饰方面的发现,使得针对新型冠状病毒感染(COVID-19)开发有效的mRNA 疫苗成为可能。两位诺贝尔奖获得者的研究对抗击在2020年初始发的COVID-19大流行(pandemic)至关重要。他们的突破性发现从根本上改变了人们对mRNA与免疫系统相互作用的理解,为以空前的速度完成疫苗的研发做出了卓越贡献。
1 COVID-19疫情前的疫苗策略
接种疫苗可以刺激机体对特定病原体形成免疫应答。这为再次接触病原时身体与疾病的斗争做好了准备。长期以来,疫苗的制备都是基于灭活或者减毒病毒的,例如脊髓灰质炎疫苗、麻疹疫苗和黄热病疫苗等。1951年 Max Theiler 因黄热病疫苗研发而获得诺贝尔生理学或医学奖。
近几十年来随着分子生物学的进展,疫苗研发可以基于单个病毒组分而不再是整个病毒。利用病毒的部分遗传密码,通常是编码病毒表面蛋白的密码,就可以产生靶向病毒的阻断性抗体,这就是蛋白类疫苗,例如针对乙型肝炎病毒的疫苗和人乳头瘤病毒的疫苗。此外,可以将部分病毒遗传密码转移到无害的运载病毒(即“载体”)中。针对埃博拉病毒的疫苗就是采用这种方法,当注射载体疫苗后,人体的细胞中会产生目的病毒蛋白,从而激发抗病毒的免疫反应。
生产基于全病毒、蛋白质和载体的疫苗需要大规模的细胞培养。这是一个资源密集型的过程,制约了疫苗快速大规模制备,限制了其在突发疫情和流行病中应用的可能性。因此,长期以来研究人员一直试图开发不依赖细胞培养的疫苗技术,事实证明这条道路并非一帆风顺。图1显示COVID-19大流行前疫苗制备的主要方法。
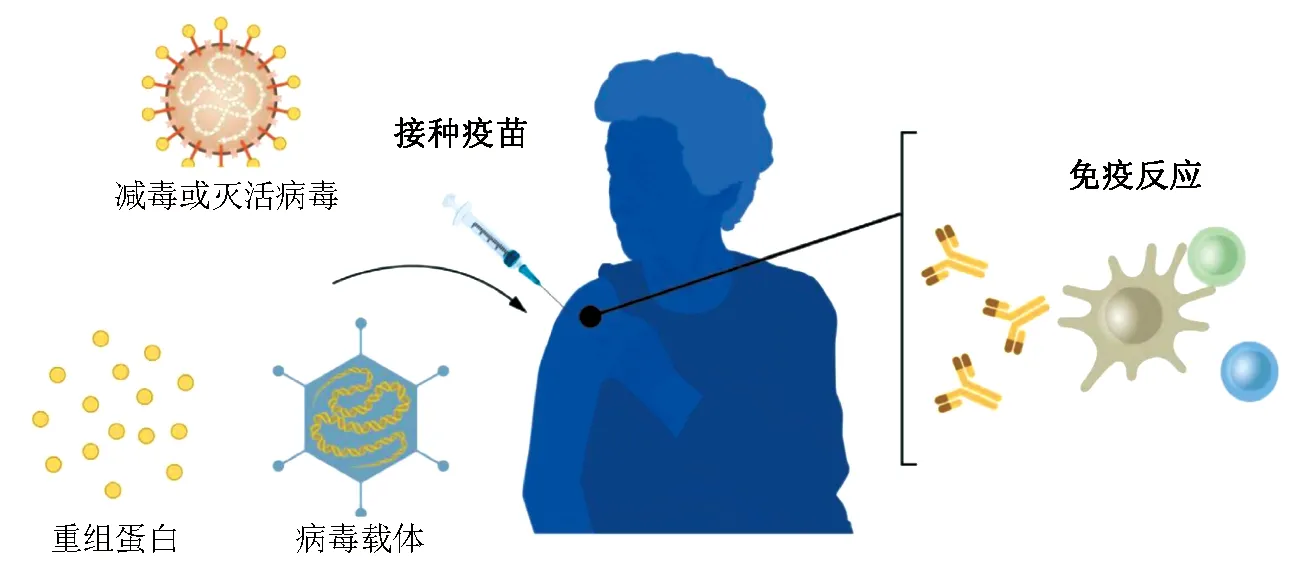
传统疫苗制备方法主要包括减毒或灭活的全病毒、重组病毒蛋白或用病毒载体递送感兴趣的抗原(载体疫苗)。疫苗接种后刺激抗原特异性免疫反应,当机体再次暴露于活病原体时疫苗可提供保护。
2 mRNA疫苗:一个有前景的想法
在人体细胞中,遗传信息储存于DNA中,随后转移到信使RNA(mRNA)中,mRNA是产生蛋白底物的模板。20世纪80年代已经具备了无细胞制备mRNA的有效方法,叫做体外转录(invitrotranscription)。这一关键步骤加速了分子生物学在多个领域的应用。虽然利用mRNA进行疫苗生产和疾病治疗的想法初现曙光,但是仍面临重重挑战。体外转录的mRNA常是不稳定的,且难以递送,必须开发复杂、精密的脂质系统来包裹mRNA。此外,体外制备的mRNA还会引起免疫细胞的炎性反应。因此,起初研究人员对mRNA技术临床应用的研发望而却步,热情不高。
但这些障碍并没有使匈牙利生物化学家Karikó感到沮丧,她坚信可以开发出mRNA治疗性应用的方法。在20世纪90年代,当她还是宾夕法尼亚大学助理教授时,尽管遭遇研究经费申请方面的连番失败,她仍坚持mRNA作为治疗性分子的理念。免疫学家Drew Weissman是她在宾夕法尼亚大学同事,对树突状细胞(dendritic cells)很感兴趣。树突状细胞在免疫监测和激活疫苗诱导的免疫反应中具有重要作用。这些新的想法令二人之间很快开始富有成果的合作,主要聚焦在不同类型的RNA如何与免疫细胞互相作用上。
3 突破
Karikó和Weissman注意到,树突状细胞会将体外转录的mRNA识别为外来异物,导致它们的激活和炎性信号分子的释放。他们想知道为什么体外转录的mRNA被识别为外来异物,而从哺乳动物细胞提取的mRNA却没有引起同样的反应。
RNA分子包含4种碱基,分别简写为A、U、G和C,与DNA分子中A、T、G和C相对应。RNA中的核苷酸碱基经常是被化学修饰过的,而体外转录的mRNA不含修饰。Karikó和 Weissman意识到这其中一定存在一些关键的特征将两者区分,从而导致了免疫细胞不同的反应。为了验证这种猜测,他们用带有不同修饰的碱基制备mRNA,分别导入树突状细胞,结果令人震惊:mRNA中加入修饰碱基后,炎性反应几乎完全消失了(图2)。这一发现为我们理解细胞是如何识别和响应不同形式的mRNA带来根本性的改变,对于mRNA治疗应用具有深远影响。这些开创性的结果发表于2005年,比COVID-19大流行早了15年。

mRNA包含四种不同的碱基,分别缩写为A、U、G、C。体外转录时用假尿嘧啶核苷(Ψ)代替尿嘧啶核苷(U),产生碱基修饰的mRNA。当将碱基修饰的mRNA递送入细胞时,与未修饰的mRNA相比,不引起炎性反应(信号分子的分泌),且蛋白质表达量增加。
在2008年和2010年发表的进一步研究中,Karikó和Weissman证明,与未修饰的mRNA相比,递送碱基修饰的mRNA显著增加了蛋白质产量。碱基修饰既能减少炎性反应,又能增加蛋白质产量,从而消除了mRNA临床应用的关键障碍。
4 mRNA疫苗大显身手
2010年,人们对mRNA疫苗的兴趣开始升温。几家公司着手进行mRNA疫苗的开发,主要针对寨卡(Zika)病毒和中东呼吸综合征冠状病毒(MERS-CoV),后者与COVID-19 的致病病原体SARS-CoV-2关系密切。COVID-19暴发后,两种编码SARS-CoV-2表面蛋白的mRNA疫苗以创纪录的速度问世,它们都是带有修饰碱基的mRNA疫苗。毫无疑问,COVID-19大流行是一个决定性事件,它推动了对mRNA疫苗技术的大规模投资、并行而非顺序进行的临床试验设计,大大缩短了临床试验所需的时间,同时仍然完成了所有必要的步骤。据报道,这两种疫苗的保护作用约为95%,为该技术未来的应用提供了坚实的基础。
mRNA疫苗的灵活性和开发速度令人赞叹,这为应用该平台研发其他传染性疾病的疫苗铺平了道路。未来,这项技术还可能用于递送治疗性蛋白质以及治疗某些肿瘤。
基于不同方法,其他几种针对SARS-CoV-2的疫苗也快速地推出了。全球共接种了130多亿剂COVID-19疫苗。这些疫苗挽救了数百万人的生命,预防了重症的发生,使社会得以开放并恢复正常。正是在应对当代最严重的健康危机之一的病毒感染过程中,Karikó和Weissman通过对mRNA核酸碱基修饰的根本性发现,为这一变革性发展做出了杰出贡献。
Katalin Karikó(卡塔琳·考里科)
1955年生于匈牙利索尔诺克市(Szolnok,Hungary)。1982年,在匈牙利塞格德大学(Szeged′s University)获得博士学位,随后在匈牙利科学院进行博士后研究。1985年起,她先后在美国费城天普大学(Temple University)和贝塞斯达健康科学大学(University of Health Science,Bethesda)进行了博士后研究。1989年,她任职于宾夕法尼亚大学受聘为助理教授。2013年后,任职BioNTech公司副总裁、高级副总裁。2021年起担任塞格德大学教授和宾夕法尼亚大学佩雷尔曼医学院(Perelman School of Medicine at the University of Pennsylvania)兼职教授。
Drew Weissman(德鲁·韦斯曼)
1959年生于美国马萨诸塞州莱克星顿市(Lexington,Massachusetts,USA)。1987年,他在波士顿大学获得MD、PhD学位,随后在哈佛医学院贝斯以色列女执事医学中心(Beth Israel Deaconess Medical Center at Harvard Medical School )接受临床培训,并在美国国立卫生研究院进行博士后研究。1997年,他在宾夕法尼亚大学佩雷尔曼医学院成立了自己的研究小组。目前,他担任罗伯茨家族疫苗研究教授和宾夕法尼亚大学RNA创新研究所所长。
